
- •Общая характеристика p-элементов 7 группы
- •Простые вещества
- •Хлор (“хлорос” – желто-зеленый цвет-греч.)
- •Общая характеристика p-элементов 6 группы
- •Свойства элементов подгруппы кислорода
- •Физические свойства простых веществ. Таблица 2. Физические свойства простых веществ.
- •Общая характеристика p-элементов 5 группы
- •Аммиак (nh3), гидразин (n2h4), гидроксиламин (nh2oh)
- •Мышьяк, сурьма, висмут
- •Общая характеристика p-элементов 4 группы
- •Углерод
- •Общая характеристика p-элементов 3 группы
Общая характеристика p-элементов 6 группы
К элементам VI главной подгруппы (или 16-ой группы по новой номенклатуре ЮПАК) периодической системы элементов Д.И.Менделеева относятся кислород (О), сера (S), селен (Se), теллур (Te) и полоний (Ро). Групповое название этих элементов - халькогены (термин "халькоген" происходит от греческих слов "chalkos"-медь и "genos"- рожденный ), то есть "рождающие медные руды", обусловлено тем, что в природе они встречаются чаще всего в форме соединений меди (сульфидов, оксидов, селенидов и т.д.).
При переходе от кислорода к полонию размер атомов и их возможные координационные числа увеличиваются, а энергия ионизации (Еион) и электроотрицательность (ЭО) уменьшаются. По электроотрицательности (ЭО) кислород уступает лишь атому фтора, а атомы серы и селена также азоту, хлору, брому; кислород, сера и селен относятся к типичным неметаллам.
Свойства элементов подгруппы кислорода
Свойства |
O |
S |
Se |
Те |
Ро |
1. Порядковый номер |
8 |
16 |
34 |
52 |
84 |
2. Валентные электроны |
2s22р4 |
Зs23р4 |
4s24р4 |
5s25p4 |
6s26p4 |
3. Энергия ионизации атома, эВ |
13,62 |
10,36 |
9,75 |
9,01 |
8,43 |
4. Относительная электроотрицательность |
3,50 |
2,6 |
2,48 |
2,01 |
1,76 |
5. Степень окисления в соединениях |
-1, -2, +2 |
-2, +2, +4, +6 |
-2, +4, +6 |
-2, +4, +6 |
-2, +2 |
6. Радиус атома, нм |
0,066 |
0,104 |
0,117 0,137 |
0,164 |
|
|
|
|
|
|
|
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
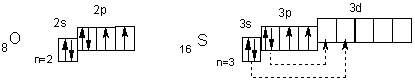
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6.
Устойчивость соединений с высшей степенью окисления уменьшается от теллура к полонию, для которого известны соединения со степенью окисления 4+ и 2+ (например, PoCl4, PoCl2, PoO2).
В свойствах серы, селена и теллура прослеживается больше аналогий, чем с кислородом и полонием. Так, в соединениях с отрицательными степенями окисления от серы к теллуру увеличиваются восстановительные, а в соединениях с положительными степенями окисления - окислительные свойства.
Водородные соединения элементов подгруппы кислорода отвечают формуле Н2R (R - символ элемента): Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
Полоний
- радиоактивный элемент. Наиболее
стабильный изотоп
![]() получают
в результате бомбардировки ядер
получают
в результате бомбардировки ядер
![]() нейтронами
и последующего
нейтронами
и последующего
![]() -распада
-распада
![]() :
:
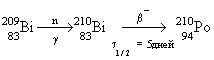 (
(![]() 1/2
= 138.4 дня).
1/2
= 138.4 дня).
 -распад
полония сопровождается выделением
большого количества энергии. Поэтому
полоний и его соединения разлагают
растворители и сосуды, в которых хранятся,
а изучение соединений Ро представляет
значительные трудности.
-распад
полония сопровождается выделением
большого количества энергии. Поэтому
полоний и его соединения разлагают
растворители и сосуды, в которых хранятся,
а изучение соединений Ро представляет
значительные трудности.
Таблица 1.Свойства атомов элементов VI группы
Элемент Свойства |
O |
S |
Se |
Te |
Po |
Атомный номер |
8 |
16 |
34 |
52 |
84 |
Число стабильных изотопов |
3 |
4 |
6 |
8 |
0 |
Электронная конфигурация |
[He]2s22p4 |
[Ne]3s23p4 |
[Ar]3d104s24p4 |
[Kr]4d105s25p4 |
[Xe]4f14 5d106s2 6p4 |
Ковалентный радиус, Е |
0.74 |
1.04 |
1.40 |
1.60 |
1.64 |
Первая энергия ионизации, Еион, кДж/моль |
1313.9 |
999.6 |
940.9 |
869.3 |
812.0 |
Элекроотрицательность (Полинг) |
3.5 |
2.5 |
2.4 |
2.1 |
2.0 |
Сродство атома к электрону, кДж/моль |
140.98 |
200.41 |
195.0 |
190.2 |
183 |
