
Билет 34
Фенолы.
Фенолами называются соединения, содержащие гидроксильную группу, связанную с атомом углерода ароматического кольца.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название “фенол”. Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров — орто-, мета- и пара-крезолов.
Изомерия
в многоатомных фенолах обусловлена
положением ОН-групп.
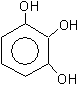
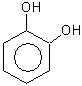
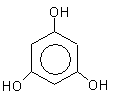 1,2,3-тригидроксибензол
1,2,4-тригидроксибзл
1,3,5-тригидроксибзл
(бензентриол-1,2,3)
(бензентриол-1,2,4) (бензентриол-1,3,5)
пирогаллол
оксигидрохинон флороглюцин
1,2,3-тригидроксибензол
1,2,4-тригидроксибзл
1,3,5-тригидроксибзл
(бензентриол-1,2,3)
(бензентриол-1,2,4) (бензентриол-1,3,5)
пирогаллол
оксигидрохинон флороглюцин
Физические свойства и применение фенола
Большинство фенолов — бесцветные твердые вещества. Сам фенол плавится при t°=41°C. Присутствие воды в феноле понижает его температуру плавления. Смесь фенола с водой при комнатной температуре — жидкость. Фенол обладает характерным запахом. Если при комнатной температуре фенол растворим в воде незначительно, то при нагревании до 70°С он растворяется полностью.
Фенол — антисептик, его водный раствор используется для дезинфекции и называется карболовой кислотой. Фенол не самый подходящий антисептик, так как вызывает ожоги кожи, а пары его токсичны. Многочисленными исследованиями было установлено, что некоторые замещенные фенолы являются более удобными антисептиками, чем сам фенол. Одно из наиболее употребительных соединений — 2,4,6-трихлорфенол. Фенол — один из важнейших продуктов нефтехимии.
Способы получения.
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолятнатрия, при дальнейшей обработке которого кислотой образуется фенол:
![]()
2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе “Химические свойства бензола”), реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

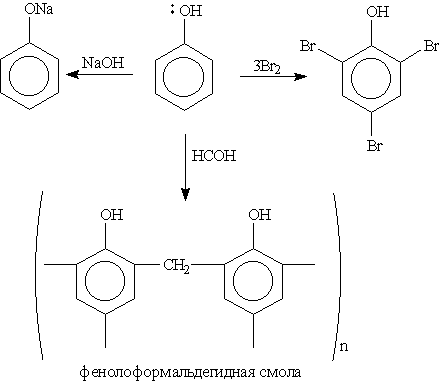
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”):
![]()
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол — такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
![]()
![]()
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
![]()
3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:
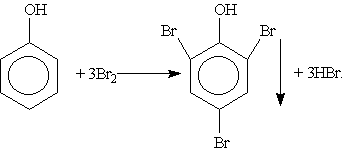
Это — качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20% -ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол — сильная кислота (пикриновая).
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
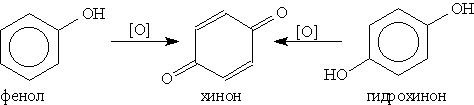
Билет 35
Эфиры.
1. ПРОСТЫЕ ЭФИРЫ – класс органических соединений содержащих фрагмент R–O–R', в котором две органические группы соединены атомом кислорода.
Номенклатура простых эфиров.
Если группы R и R' в простом эфире одинаковы, то его называют симметричным, если разные – несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C2H5OC3H7 – пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C2H5OC2H5 – диэтиловый эфир.
