ГОУ ВПО «Омский Государственный Университет им. Ф. М. Достоевского»
Кафедра химической технологии
Курсовая задача
по дисциплине
«Общая химическая технология».
Реакция дегидрирования бутана в бутилены в производстве синтетического каучука
Вариант 07-14
Исполнитель:
студент группы ХТ-301
Ковальчук Е.
Научный руководитель:
Ст. преподаватель кафедры
химической технологии
Реутова О.А.
Омск 2007
Содержание.
1. Изобутилен
1.1. Физические свойства………………………………………………….3
1.2. Получение изобутилена…………………………………………….…3
2. Дегидрирование изобутана
2.1. Основные факторы процесса……………………………………….....4
2.2. Катализаторы ………...……...……………………………………...…4
2.3. Основные стадии проведения процесса……………………………...5
2.4. Выбор реактора………………………………………………………...6
2.5. Возможные расположения реактора и регенератора………………..7
2.6. Принципиальная технологическая схема…………………………...11
2.7. Разделение изобутан-изобутиленовой фракции серной кислотой..15
3. Решение задачи…………………………………………………………18
1. Бутан
1.1. Физические свойства.
Горючий газ без цвета и запаха, растворим в органических растворителях, нерастворим в воде.
Существует
в виде двух изомеров: нормального бутана
с неразветвленной структурой
![]() и изо-бутана (2-метилпропан, триметилметан)
и изо-бутана (2-метилпропан, триметилметан)
![]() ,
так как в производстве синтетического
каучука применяется бутан неразветвленного
строения, то в дальнейшем речь пойдет
только о нем, по тексту – бутан.
,
так как в производстве синтетического
каучука применяется бутан неразветвленного
строения, то в дальнейшем речь пойдет
только о нем, по тексту – бутан.
Молекулярная масса 58,123.
Температуры (при атмосферном давлении), К:
кипения 272,65;
плавления 134,8;
воспламенения 678,15.
Показатель
преломления (жидкость)
![]() .
.
Мольная
теплоёмкость при постоянном давлении
![]() .
.
Удельная
теплоёмкость при 298,15 К
![]() .
.
Плотность
![]() .
.
Энтальпии:
образования
![]() ;
;
сгорания
![]() ;
;
плавления
![]() ;
;
испарения
![]() ;
;
Вязкость, кПас: при 263,15 К η = 0,227
Критическая
температура
![]()
Критическое
давление
![]()
Способы получения бутана.
В природе бутан содержится:
в природном газе (0,5-8,2 % по массе, в зависимости от месторождения);
в газовом конденсате (0,12 - 6,54 % по массе);
в попутных нефтяных газах (0,16 – 12,1 % по массе);
В газах стабилизации нефти (30-40% по массе).
В промышленности бутан выделяют из указанных природных источников и из продуктов каталитического крекинга и гидрокрекинга нефтяных фракций. Чистый пропилен получают дистилляцией или фракционированием при пониженном давлении, разработаны методы очистки на молекулярных ситах или адсорбцией в серной кислоте[3, c. 49-50 омгу]
2. Дегидрирование бутана.
2.1. Основы процесса.
Дегидрирование бутана в бутилены является целевой реакцией в схеме двухстадийного получения бутадиена, как мономера в синтезе синтетического каучука.
Подробное изучение этих реакций относится лишь к последнему времени. Алифатические углеводороды резко отличаются от ароматических своим поведением при высоких температурах. Они обладают более сильно выраженной тенденцией к крекингу, чем к дегидрированию. Для крекинга алифатической С—С связи требуется 58,6 ккал г-мол, а для дегидрирования С—Н связи 87 ккал г-мол. поэтому необходимо пользоваться катализаторами, которые могут избирательно снизить температуру реакции ниже порога крекинга. Такой процесс открывает новый путь для получения олефинов и диенов из парафинов.
Дегидрирование низших парафинов долгое время не могло быть осуществлено: только в 1933 г. было найдено, что из этана, пропана и бутана над Сr(ОН)3 при 350—500е получаются соответственно 1.2% С2Н4, 4.5% С3Н6 и 9% C4H8 и что тенденция к дегидрированию возрастает с увеличением длины углеродной цепи.
Предварительно бутановая фракция тщательно очищается от изобутана и пентенов, присутствие которых нежелательно.
Сам процесс дегидрирования бутана проводят при 450—550ºC и при этой же температуре периодически регенерируют катализатор воздухом, который выжигает кокс.
Н. Д. Зелинский с сотрудниками установили, что при объемной скорости (о.с.) 700—1000 выходы бутиленов составляют 45 % на пропущенный и 95% на разложенный бутан. Большое значение имеет время контакта (в.к.) так как при очень малом в.к. часть бутана проскакивает неразложенной при большом же в.к. (выше оптимального) усиливаются вторичные реакции разложения.
При дальнейшем контакте смеси бутана и бутилена легче дегидрируется бутилен до дивинила. Одновременно получаются СН4, C,Hri, С2Н4 и уголь. Лучшим в.к. является 1.5—2 сек.
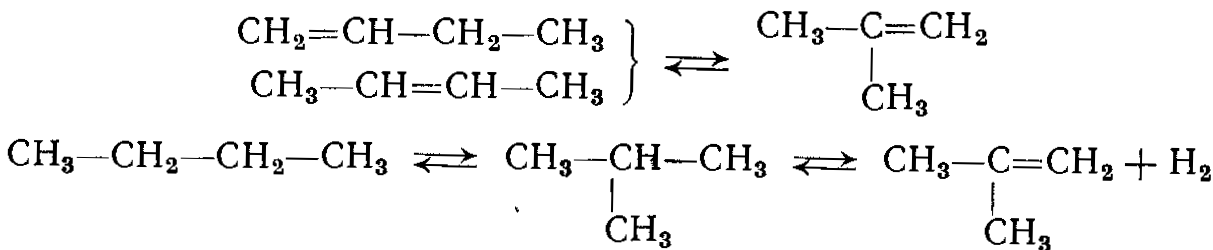
В результате реакции получается смесь бутенов, образование которых по дуплетному механизму можно представим, таким образом:


Между изомерами устанавливается равновесие с преобладанием бутена-2 (66%) в цис- и транс- формах. Термодинамику этих реакций изучала В. Р. Жаркова:



Равновесия между реакциями гидрирования олефинов и дегидрирования соответствующих парафинов исследовали А. А. Введенский с сотрудниками, предложившие для вычисления lg Кр при разных температурах следующее уравнение[долгов]:
![]()
![]()
Основными побочными реакциями являются крекинг и изомеризация. Реакции крекинга протекают в следующих направлениях:
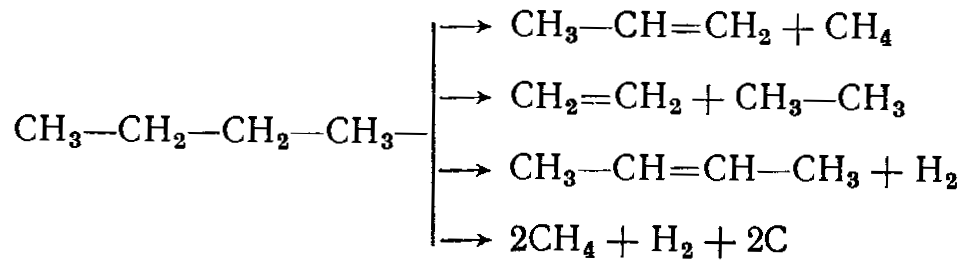
Наряду с крекингом бутана происходит также крекинг бутенов и частичная изомеризация бутенов в изобутилен, а бутана в изобутан, который тоже подвергается дегидрированию: