
3)Оксид меди (II)
4)сернистый газ
5)углекислый газ
6)глюкоза (раствор)
113. Слабым электролитом является вещество, формула которого:
1)HNO3
2)HBr
3)Ba(OH)2
+ 4)H2S
5)H2SO4
6)RbOH
114. Наиболее сильным электролитом является
1)HF
+ 2)HNO3
3)H3PO4
4)HCOOH
5)BaSO4
6)NH4OH
115. В качестве анионов только ионы ОН- образуются при диссоциации
1)CH3OH
2)ZnOHBr
+ 3)NaOH
4)CH3COOH
5)Na2[Zn(OH)4]
6)Al(OH)3
116. Ионы I- образуются при диссоциации
1)KIO3
+ 2)KI
3)CH3I
4)NaIO4
5)Na2[HgI4]
6)I2
117. Газ выделяется при сливании растворов
1)сульфата калия и азотной кислоты
2)хлороводородной кислоты и гидроксида хрома
+ 3)серной кислоты и сульфита калия
4)карбоната натрия и гидроксида бария
5)азотной кислоты и гидроксида бария
6)сульфата калия и гидроксида хрома
118. Нерастворимая соль образуется при взаимодействии
1)КОН (р-р) и Н3РО4 (р-р)
2)HNO3 (р-р) и CuO
3)HCl (р-р) и Mg(NO3)2 (р-р)
+ 4)Ca(OH)2 (р-р) и CO2
5)КОН (р-р) и HNO3 (р-р)
6)КОН (р-р) и CO2
119. Сокращенное ионное уравнение Fe2+ + 2OH- = Fe(OH)2 соответствует взаимодействию веществ
1)Fe(NO3)3 и KOH
+ 2)FeSO4 и LiOH
3)Na2S и Fe(NO3)2
4)Ba(OH)2 и FeCl3
5)FeCl3 и Ba(OH)2
6)FeSO4 и Ba(OH)2
120. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия 1 моль гидроксида цинка с 2 моль соляной кислоты равна
ОТВЕТ: 6
121. К электролитам относятся все вещества, указанные в ряду
1)N2O, KOH, Na2CO3
2)Cu(NO3)2, HCl, CH4
+ 3)Ba(OH)2, FeBr3, Na2CO3
4)CaCl2, C6H12O6, KOH
5)HCOONa, Cu(NO3)2, SO3
6)H2CO3, Ba(OH)2, Cl2
122. Сильным электролитом является
1)H2CO3
2)CH3OH
3)CH3COOH
+ 4)CH3COONa
5)Zn(OH)2
123. Какое молекулярное уравнение соответствует сокращенному ионному Ba2+ + SO42- = BaSO4
1)BaO + SO3 = BaSO4
2)Ba(OH)2 + SO3 = BaSO4 + H2O
3)BaO + H2SO4 = BaSO4 + H2O
4)Ba(OH)2 + H2SO4 = BaSO4 + H2O
+ 5)BaCl2 + H2SO4 = BaSO4 + 2HCl
6)BaCO3 + H2SO4 = BaSO4 + CO2 + H2O
124. Какое молекулярное уравнение соответствует сокращенному ионному Са2+ + СО32- = СаСО3↓
1)СаО + СО2 = СаСО3↓
2)Са(ОН)2 + СО2 = СаСО3↓+ Н2О
3)СаО + Н2СО3 = СаСО3↓+ Н2О
4)Са(ОН)2 + Na2СО3 = СаСО3↓+ 2NaОН
+ 5)СаCl2 + Na2СО3 = СаСО3↓+ 2NaCl
6)СаSO4 + Na2СО3 = СаСО3↓+ Na2SO4
125. Какое молекулярное уравнение соответствует сокращенному ионному Н+ + ОН- = Н2О
1)NaO + HCl = NaCl + H2O
2)2NaO + H2SO4 = Na2SO4 + H2O
+ 3)NaOH + HCl = NaCl + H2O
4)NaOH + H2SO4 = NaHSO4 + H2O
5)Cu(OH)2 + 2HCl = CuCl2 + 2H2O
6)Cu(OH)2 + HCl = CuOHCl + H2O
126. Химической реакции между гидроксидом меди (II) и раствором серной кислоты соответствует сокращенное ионное уравнение
1)ОН- + Н+ = Н2О
2)2ОН- + H2SO4 = 2Н2О + SO42-
3)Cu(OH)2 + SO42- = CuSO4 + 2OH-
+ 4)Cu(OH)2 + 2H+ = Cu2+ + 2Н2О
5)Cu2+ + SO42- = CuSO4
127. Сумма коэффициентов в уравнении реакции полной нейтрализации серной кислоты гидроксидом натрия равна:
ОТВЕТ: 6
128. В сокращенном ионном уравнении 2Н+ + ? = SO2 + H2O пропущен ион
ОТВЕТ: сульфит
129. Химическая реакция возможна между водными растворами веществ
1)сульфат калия и гидроксид натрия
2)хлорид натрия и серная кислота
+ 3)бромид бария и сульфат лития
4)нитрат цинка и хлорид алюминия
5)гидроксид натрия и нитрат бария
6)хлорид кальция и нитрат меди (II)
130. Уравнение реакции, практически осуществимой в водном растворе, имеет вид
+ 1)CuSO4 + 2KOH = K2SO4 + Cu(OH)2↓
2)NaNO3 + HCl = NaCl + HNO3
3)Ba(NO3)2 + 2NaOH = 2NaNO3 + Ba(OH)2
4)Fe2(SO4)3 + 6HNO3 = 2Fe(NO3)3 + 3H2SO4
5)CuSO4 + 2HNO3 = Cu(NO3)2 + H2SO4
6)CaCl2 + 2NaBr = CaBr2 + 2NaCl
131. Самопроизвольный распад молекул растворенного (иногда расплавленного) вещества на катионы и анионы называется
1)электролизом
2)гидролизом
3)ионной проводимостью
+ 4)электролитической диссоциацией
5)ионным произведением
6)гомогенным катализом
132. Мерой электролитической диссоциации электролита принято считать
+ 1)степень диссоциации
2)молярную концентрацию раствора
3)рН раствора
4)константу гидролиза
5)степень гидролиза
133. Степень диссоциации - это
1)отношение количества растворенного вещества к общему количеству веществ в растворе
2)отрицательный логарифм концентрации катионов в растворе
+ 3)отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества
4)число гидратированных молекул электролита
5)общее число диссоциированных молекул
134. Величиной, характеризующей диссоциацию и не зависящей от концентрации раствора, является
1)константа гидролиза
2)ионное произведение воды
+ 3)константа диссоциации
4)степень диссоциации
5)отношение количества растворенного электролита к общей массе раствора
135. Ионное произведение воды зависит только от температуры, численное значение этой величины при 25ºС составляет
1)6,02∙10-23
2)8,31∙10-3
3)6,63∙10-34
+ 4)1,0∙10-14
5)1,18∙10-27
136. Вода - очень слабый электролит, поэтому ее молярная концентрация [Н2О] остается практически постоянной при ее диссоциации, а следовательно, остается постоянной и величина Кw = [H+]∙[OH-], которую называют
1)водородным показателем
2)произведением растворимости воды
+ 3)ионным произведением воды
4)произведением дистилляции
5)константой диссоциации воды
137. Массовая доля показывает:
+ 1)содержание массы растворенного вещества в определенной массе раствора
2)содержание массы растворенного вещества в определенной массе растворителя
3)содержание количества растворенного вещества в 1 литре раствора
4)содержание массы растворенного вещества в 1 мл растворителя
5)содержание массы вещества в 1 мл раствора
6)содержание количества вещества в 1 кг растворителя
138. Молярная концентрация показывает
1)содержание массы растворенного вещества в определенной массе раствора
2)содержание массы растворенного вещества в определенной массе растворителя
+ 3)содержание количества растворенного вещества в 1 литре раствора
4)содержание массы растворенного вещества в 1 мл растворителя
5)содержание массы вещества в 1 мл раствора
6)содержание количества вещества в 1 кг растворителя
139. Титр показывает
1)содержание массы растворенного вещества в определенной массе раствора
2)содержание массы растворенного вещества в определенной массе растворителя
3)содержание количества растворенного вещества в 1 литре раствора
4)содержание массы растворенного вещества в 1 мл растворителя
+ 5)содержание массы вещества в 1 мл раствора
6)содержание количества вещества в 1 кг растворителя
140. Указать формулу для определения молярности раствора
1)![]()
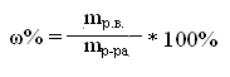
+
2)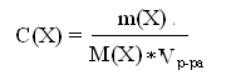
3)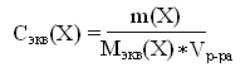
4)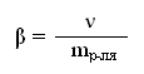
5)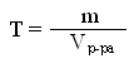
6)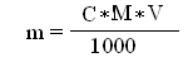
141. Величина, показывающая содержание массы вещества в 1 мл раствора называется
1)молярность
2)нормальность
3)моляльность
4)массовая доля
+ 5)титр
6)объемная доля
142. Смешали 200 г 20%-ного и 300 г 10%-ного раствора глюкозы. Массовая доля вещества в полученном растворе равна,(%)
ОТВЕТ: 14
143. Чему равен титр раствора (г/мл), полученного растворением 3,5 г хлорида натрия в 100 мл воды (плотность полученного раствора 1,12 г/мл). (До тысячных долей) …
ОТВЕТ: 0,038
144. Какова массовая доля (%) растворенного вещества в растворе, полученного растворением 50 г соли в 450 мл воды
ОТВЕТ: 10
145. Какова масса NaNO3 (г), необходимая для приготовления 300 мл раствора с молярной концентрацией 0,2 моль/л. (До десятых долей) …
ОТВЕТ: 5,1
146. Какова массовая доля (%) растворенного вещества в растворе, полученного растворением 20 г соли в 80 мл воды
ОТВЕТ: 20
147. рН раствора соляной кислоты равен 5. Вычислить молярную концентрацию этой кислоты
1)0,1 моль/л
2)0,2 моль/л
3)0,5 моль/л
4)10-3 моль/л
5)10-4 моль/л
+ 6)10-5 моль/л
148. Какая концентрация гидроксид-ионов ОН- соответствует щелочной среде
1)10-12 моль/л
+ 2)10-3 моль/л
3)10-7 моль/л
4)10-10 моль/л
5)10-11 моль/л
6)10-9 моль/л
149. Какой концентрации ионов водорода соответствует рН = 10
1)10-9 моль/л
2)10-6 моль/л
3)10-5 моль/л
+ 4)10-10 моль/л
5)10-12 моль/л
6)10-2 моль/л
150. Какая концентрация (моль/л) гидроксид-ионов ОН- соответствует кислой среде
+ 1)10-12
2)10-3
3)10-7
4)10-5
5)10-6
6)10-4
151. Какой концентрации гидроксид-ионов ОН- (моль/л) соответствует рН=10
1)10-10
2)10-3
3)10-7
4)10-5
5)10-6
+ 6)10-4
152. рН раствора равен 4. Какую окраску будет иметь в этом растворе метиловый оранжевый
1)желтую
+ 2)оранжевую
3)розовую
4)малиновую
5)синюю
6)бесцветную
153. Чему равен рН 0,01 н раствора КОН
ОТВЕТ: 12
154. В каких пределах может меняться pH реальных растворов?
1)pH = 1-14
+ 2)pH = 0-14
3)pH = 14-pOH
4)pH = -2 -16
5)рН = -1 - 15
6)рН = 0 - 15
155. Что такое буферные растворы?
1)это растворы, которые никогда не меняют своего значения рН
2)это растворы, которые добавляют к исследуемому веществу, чтобы изменить значение рН
+ 3)это растворы, которые не меняют значения рН при разбавлении, добавлении кислот, щелочей
4)это растворы, которые всегда имеют кислую среду
5)это растворы, которые всегда имеют щелочную среду
6)это растворы, которые имеют нейтральную среду
156. Как изменится рН воды, если к 10 л ее добавить 10-2 моль NaOH
1)возрастет на 2
+ 2)возрастет на 3
3)возрастет на 4
4)уменьшится на 4
5)уменьшится на 3
6)уменьшится на 2
157. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу
1)увеличить в 10 раз
2)увеличить на 1 моль/л
+ 3)уменьшить в 10 раз
4)уменьшить на 1 моль/л
5)увеличить на 2 моль/л
6)уменьшить на 2 моль/л
158. рН раствора равен 3. Какую окраску будет иметь в этом растворе лакмус
1)желтую
2)фиолетовую
+ 3)красную
4)малиновую
5)синюю
6)бесцветную
159. рН раствора равен 7. Какую окраску будет иметь в этом растворе фенолфталеин
1)желтую
2)оранжевую
3)розовую
4)малиновую
5)синюю
+ 6)бесцветную
160. Как изменится рН воды, если к 1 л ее добавить 10-3 моль HCl
1)возрастет на 2
2)возрастет на 3
3)возрастет на 4
4)уменьшится на 4
+ 5)уменьшится на 3
6)уменьшится на 2
161. рН раствора NаОН равен 8. Какой концентрации щелочи соответствует это значение рН
1)0,1 моль/л
2)0,2 моль/л
3)0,5 моль/л
4)10-8 моль/л
5)10-4 моль/л
+ 6)10-6 моль/л
162. Вычислить рН 0,001М раствора соляной кислоты, считая ее полностью диссоциированной
ОТВЕТ: 3
163. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН равный… (введите число)
ОТВЕТ: 1
164. Вещества, способные менять свою окраску в зависимости от среды раствора, называются
+ 1)индикаторы
2)реагенты
3)продукты
4)люминофоры
5)ингибиторы
6)катализаторы
165. В растворе какой из солей среда щелочная?
1)NH4Cl
2)(CuOH)2CO3
3)Ba(NO3)2
4)CaSO4
+ 5)CaCO3
6)Mg(NO3)2
166. Раствор какой из перечисленных солей будет иметь рН равный 7.
+ 1)NaCl
2)(NH4)2SO4
3)K2SO3
4)CH3COONa
5)KSCN
6)FeCl3
167. Фенолфталеин окрасится в растворе соли
1)Cu(NO3)2
2)KNO3
3)KClO4
+ 4)KF
5)KCl
6)KBr
168. В растворе какой из солей среда кислая
+ 1)AgNO3
2)KBr
3)Na2CO3
4)KNO3
5)CuS
