
- •Ответы на третьи вопросы экзаменационных билетов: Билет №1
- •Билет №2
- •Билет №3
- •Находим теоретическую массу спирта:
- •Билет №4
- •Билет №5
- •Билет №6
- •Билет №7
- •Билет №8
- •Билет №9
- •Билет №10
- •Билет №11
- •Билет №12
- •Билет №13
- •Билет №14
- •Билет №15
- •Билет №16
- •Билет №17
- •Билет №18
- •Билет №19
- •Билет №20
- •Билет №21
- •Билет №22
- •Билет №23
- •Билет №24
- •Билет №25
- •Билет №26
- •Билет №27
- •Билет №28
- •Билет №29
- •Билет №30
Билет №13
Написать реакции, подтверждающие качественный состав сульфата меди.
CuSO4 → Cu2+ + SO42-
Реакция на ионы Cu2+: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Реакция на ионы SO42-: CuSO4 + BaCl2 = CuCl2 + BaSO4↓
Билет №14
Какое количество вещества этана получится при пропускании 6,72 г этена, содержащего 20% примесей, с водородом над нагретым никелевым катализатором?
5,4 г Ni кат Х моль
Решение: С2Н4 + Н2 → С2Н6
28 г 1 моль
Находим теоретическую массу С2Н4:
m (С2Н4)теорет = ν (С2Н4) + М (С2Н4) = 1 моль · 28 г/моль = 28 г
М(С2Н4) = 2Ar(C) + 4Ar(H) = 2·12 + 4·1 = 28 г/моль
Находим массу С2Н4 практически:
m
(С2Н4)практ
=
![]() = 5,4 г
= 5,4 г
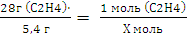 ; Х
=
; Х
= 
Билет №15
Испытать растворы карбоната натрия и хлорида алюминия индикатором. Результаты объяснить.
Na2CO3 → 2Na1+ + CO32- - эта соль образована сильным основанием (NaOH)
 и
слабой
кислотой
(H2CO3)
и
слабой
кислотой
(H2CO3)
Na2CO3 ↔ 2Na1+ + CO32-
+
HOH ↔ OH1- + H+ → HCO31-
Na2CO3 + HOH ↔ 2Na1+ + OH1- + HCO31- (реакция среды щелочная – цвет
лакмуса синий)
AlCl3 → Al3+ + 3Cl1- – соль образована слабым основанием (Al(OH)3) и
 сильной
кислотой (HCl)
сильной
кислотой (HCl)
AlCl3 ↔ Al3+ + 3Cl1-
+
HOH ↔ OH1- + H1+
↓
Al(OH)2+
AlCl3 + HOH ↔ Al(OH)2+ + 3Cl1- + H1+ (реакция среды кислая – цвет
лакмуса красный)
Билет №16
Определить массу соли, которая образуется при взаимодействии 245 г 20%-ной серной кислоты с хлоридом бария, при условии, что они вступили в реакцию полностью.
49 г Х г
Решение: H2SO4 + BaCl2 = BaSO4↓ + 2HCl
98 г 233 г
Находим массу H2SO4 практически:
m
(H2SO4)практ
=
![]() = 49 г
= 49 г
Находим теоретическую массу H2SO4:
m (H2SO4)теорет = ν (H2SO4) + М (H2SO4) = 1 моль · 98 г/моль = 98 г
М(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2·1 + 32 + 4·1 = 98 г/моль
Находим теоретическую массу BaSO4:
m (BaSO4)теорет = ν (BaSO4) + М (BaSO4) = 1 моль · 233 г/моль = 233 г
М(BaSO4) = Ar(Ba) + Ar(S) + 4Ar(O) = 137 + 32 + 4·1 = 98 г/моль
 ; Х =
; Х = 
Билет №17
Написать реакции получения амфотерного гидроксида алюминия и реакции, подтверждающие его свойства.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaOH
Реакция подтверждающая основные свойства Al(OH)3:
Al(OH)3 + 3НСl = AlCl3 + 3H2O
Реакция подтверждающая кислотные свойства Al(OH)3 ↔ H3AlO3
H3AlO3 + 3NaOH = Na3AlO3 + 3H2O
