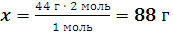- •Ответы на третьи вопросы экзаменационных билетов: Билет №1
- •Билет №2
- •Билет №3
- •Находим теоретическую массу спирта:
- •Билет №4
- •Билет №5
- •Билет №6
- •Билет №7
- •Билет №8
- •Билет №9
- •Билет №10
- •Билет №11
- •Билет №12
- •Билет №13
- •Билет №14
- •Билет №15
- •Билет №16
- •Билет №17
- •Билет №18
- •Билет №19
- •Билет №20
- •Билет №21
- •Билет №22
- •Билет №23
- •Билет №24
- •Билет №25
- •Билет №26
- •Билет №27
- •Билет №28
- •Билет №29
- •Билет №30
Ответы на третьи вопросы экзаменационных билетов: Билет №1
При взаимодействии пропанола с металлическим натрием выделился 0,01 моль водорода. Определить массу спирта, вступившего в реакцию.
хг 0,01моль
Решение: 2 C3H7OH + Na = C3H7ONa + H2↑
120г 1моль
Находим теоретическую массу спирта:
m (C3H7OH) = ν(C3H7OH) · M(C3H7OH) = 2 моль· 60 г/моль = 120 г
M(C3H7OH) = 3·Ar(C) + 8·Ar(H) + Ar(O) = 3·12 + 8·1 + 16 = 60 г/моль
 ;
;

Билет №2
Выданы три пробирки с растворами:
А) гидроксида натрия; Б) хлорида натрия; В) сульфата натрия.
Определить с помощью характерных реакций каждое из предложенных веществ.
Определение веществ в растворах осуществляется путем проведения качественных реакций на ионы, содержащиеся в растворе.
А) NaOH + 1-2 капли лакмуса →синяя окраска раствора
Б) NaCl + AgNO3 = NaNO3 + AgCl↓
В) Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Билет №3
Какая масса гидроксида натрия образуется при взаимодействии 0,1 моль натрия с водой?
0,1моль xг
Решение: 2 Na + 2Н2О= 2NaОН + H2
2моль 80 г
Находим теоретическую массу спирта:
m (NaОН) = ν(NaОН) · M(NaОН) = 2 моль· 40 г/моль = 80 г
M(NaОН) = Ar(Na) + Ar(О) + Ar(Н) = 23 + 16 + 1 = 40 г/моль
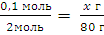 ;
;

Билет №4
Определите с помощью характерных реакций три органических вещества:
А) крахмал; Б) глицерин; В) белок.
Определение веществ в растворах осуществляется путем проведения качественных реакций на ионы, содержащиеся в растворе.
А) р-р крахмала (С6Н10 О5)n + р-р йода (J2) желто-коричневый = синее окрашивание
Б) глицерин + Cu(OH)2 голубой = синее окрашивание раствора
t˚C
В) белок + H2SO4 конц → белый↓ → желтый↓
Билет №5
Какой объем кислорода необходим для полного сгорания 7 л сероводорода?
7 л xл
Решение: 2H2S + 3O2 = 2SO2 + 2H2O
2 моль 3 моль
![]() ;
;
![]()
Билет №6
Написать реакции, подтверждающие химические свойства кислот (на примере серной кислоты).
Действие индикатора: H2SO4 + 1-2 капли лакмуса → красный цвет раствора
Взаимодействие с металлами:
а) H2SO4 разб + Zn → ZnSO4 + H2↑
б) 2H2SO4 конц + Сu → CuSO4 + SO2↑ + 2H2O
Взаимодействие с оксидами: H2SO4 + Na2O → Na2SO4 + H2O
Взаимодействие с основаниями: H2SO4 + 2NaOН → Na2SO4 + 2H2O
5) Взаимодействие с солями более слабых кислот:
H2SO4 + Na2СO3 → Na2SO4 + H2СO3
/ \
Н2О + СО2
Билет №7
Какая масса уксусного альдегида потребуется для получения из него путем окисления оксидом серебра 2 моль уксусной кислоты?
xг //О 2 моль //О
Решение: СН3–С + Ag2O = 2Ag + CH3–C
\Н \OН
44 г 1 моль
Находим теоретическую массу альдегида:
m (C2H4O) = ν(C2H4O) · M(C2H4O) = 1 моль· 44 г/моль = 44 г
M(C2H4O) = 2·Ar(C) + 4·Ar(H) + Ar(O) = 2·12 + 4·1 + 16 = 44 г/моль
 ;
;