
- •1 Кинетика процессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток
- •1.1 Идеальные реакторы для изучения кинетики клеточного роста
- •1.2 Идеальный реактор периодического действия
- •1.3 Идеальный проточный реактор с полным перемешиванием (прпп)
- •1.2 Кинетика сбалансированного роста
- •Рост филаментозных организмов
- •Структурированные модели кинетики клеточного роста
- •Компартментальные модели
- •Неструктурированные модели
- •Химически структурированные модели кинетики образования продуктов жизнедеятельности клеток
- •Кинетика образования продуктов жизнедеятельности филаментозными организмами
- •Кинетика тепловой гибели клеток и спор
- •Заключение
- •Вопросы для самоконтроля.
- •2 Проектирование и расчет биологических реакторов
- •1. Идеальные биореакторы
- •1.1. Реакторы периодического действия с добавлением субстрата
- •1.2. Реакции в прпп, катализируемые ферментами
- •1.3. Проточные реакторы с полным перемешиванием для культур клеток и пристеночный рост клеток
- •9.1.4. Идеальный трубчатый реактор полного вытеснения (трпв)
- •3. Реакторы с неидеальным перемешиванием
- •3.1. Время выравнивания концентраций в реакторах с перемешиванием
- •3.4. Взаимосвязь между перемешиванием и биологическими превращениями
- •4. Стерилизаторы
- •4.1. Периодическая стерилизация
- •4.2. Непрерывная стерилизация
- •5. Иммобилизованные биокатализаторы
- •5.1. Типы биокатализаторов на основе иммобилизованных клеток и их свойства
- •5.2. Применение биокатализаторов на основе иммобилизованных клеток
- •7. Технология микробиологических процессов
- •7.1. Подбор состава среды
- •7.2. Проектирование типичного асептического аэробного микробиологического процесса и его ведение
- •7.3. Биореакторы других типов
- •8. Особенности технологии процессов с участием растительных и животных клеток и соответствующих реакторов
- •8.1. Культивирование животных клеток; требования к среде
- •8.2. Промышленные реакторы для крупномасштабных процессов с участием животных клеток
- •8.3. Культивирование растительных клеток
- •1. Детекторы для определения физических и химических параметров среды и газов
- •1.1. Детекторы для определения физических свойств среды и газов
- •1.2. Детекторы для определения химического состава среды
- •1.3. Газовый анализ
- •2. Детекторы для непрерывного контроля характеристик популяции клеток
- •3. Автономные методы анализа
- •3.1. Определение свойств среды
- •3.2. Анализ состава популяции клеток
- •4. Эвм и интерфейсы
- •4.1. Основные элементы цифровых эвм
- •4.2. Интерфейсы и периферийные устройства эвм
- •4.3. Системы программного обеспечения
- •5. Анализ данных
- •5.1. Сглаживание и интерполяция данных
- •6. Управление процессами биохимической технологии
- •6.1. Непосредственное управление процессами
- •6.2. Каскадное управление метаболизмом
Химически структурированные модели кинетики образования продуктов жизнедеятельности клеток
В сравнении с
изучением кинетики роста индивидуальной
клетки и популяций клеток в проблеме
кинетики процессов образования продуктов
метаболизма разработке структурированных
моделей посвящено относительно небольшое
число работ. Можно ожидать, однако, что
развитие структурированных моделей
клеточного роста в ближайшем будущем
потребует разработки ряда таких моделей.
В этом разделе мы рассмотрим интересный
процесс образования одного из множества
вторичных метаболитов, на примере
которого познакомимся с рядом важных
аспектов процессов микробиологического
синтеза антибиотиков, а также с новыми
подходами к моделированию кинетики
таких процессов. 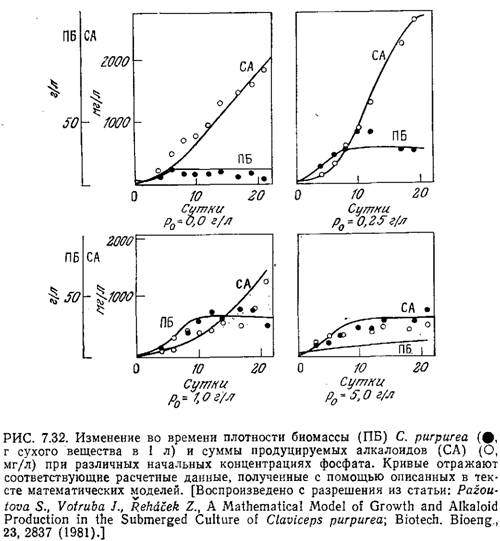
Синтез ряда микробных антибиотиков и других продуктов вторичного метаболизма ингибируется высокими концентрациями фосфатного иона. Поскольку для роста клеток фосфат совершенно необходим, очевидно, должен существовать некоторый оптимальный уровень его концентрации. Действительно, такой оптимальный уровень начальной концентрации фосфата наблюдался, например, при биосинтезе алкалоидов Claviseps purpurea (рис. 7.32).
Приведенные на рис. 7.32 экспериментальные данные хорошо моделируются следующими уравнениями кинетики клеточного роста периодической культуры и образования продукта жизнедеятельности [26]. Рост клеток:
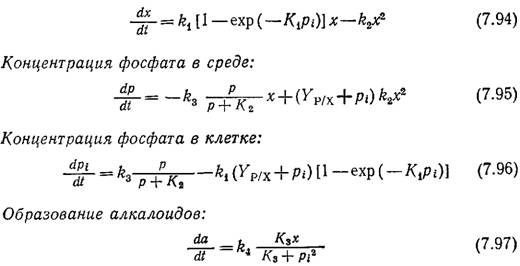
В результате лизиса фосфат выделяется в среду; как показывает второе слагаемое правой части уравнения (7.95), его количество пропорционально содержанию фосфата в клеточной массе Ур/х и внутриклеточной концентрации фосфата рi. Первое слагаемое той же части того же уравнения описывает активный транспорт фосфата в клетку; кинетика этого процесса характеризуется наличием режима насыщения. Уравнение материального баланса по внутриклеточному фосфату [уравнение (7.96)] является вариантом уравнения (7.67); здесь учтено, что скорость его образования равна разности между скоростью транспорта фосфата в клетку и скоростью включения фосфата в компоненты клетки. В уравнении скорости образования продуктов принято во внимание ингибирование процесса фосфатом в том виде, в каком этот эффект учитывался ранее при моделировании репрессии фермента фосфатазы.
Сплошные кривые на рис. 7.32 были вычислены с помощью описанной модели, а значения соответствующих параметров перечислены в табл. 7.5. Эта структурированная модель хорошо отражает закономерности изменения биомассы и массы алкалоидов во времени, в том числе наличие максимума на кривой накопления суммы алкалоидов, но в то же время при высоких концентрациях фосфата ее точность недостаточно высока. С помощью такой модели, в частности, было показано, что максимальное количество суммы алкалоидов продуцируется при начальной концентрации фосфата в среде 0,17 г/л. Математическое моделирование различных методик введения фосфата (в том числе добавления фосфата по частям в различные фазы процесса) показало, что таким путем нельзя добиться существенного повышения выхода алкалоидов по сравнению с обычным периодическим процессом при оптимальной начальной концентрации фосфата в среде. В других случаях, которые мы рассмотрим в последующих главах, периодические процессы с добавлением субстрата оказываются очень полезными.
