
- •1 Кинетика процессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток
- •1.1 Идеальные реакторы для изучения кинетики клеточного роста
- •1.2 Идеальный реактор периодического действия
- •1.3 Идеальный проточный реактор с полным перемешиванием (прпп)
- •1.2 Кинетика сбалансированного роста
- •Рост филаментозных организмов
- •Структурированные модели кинетики клеточного роста
- •Компартментальные модели
- •Неструктурированные модели
- •Химически структурированные модели кинетики образования продуктов жизнедеятельности клеток
- •Кинетика образования продуктов жизнедеятельности филаментозными организмами
- •Кинетика тепловой гибели клеток и спор
- •Заключение
- •Вопросы для самоконтроля.
- •2 Проектирование и расчет биологических реакторов
- •1. Идеальные биореакторы
- •1.1. Реакторы периодического действия с добавлением субстрата
- •1.2. Реакции в прпп, катализируемые ферментами
- •1.3. Проточные реакторы с полным перемешиванием для культур клеток и пристеночный рост клеток
- •9.1.4. Идеальный трубчатый реактор полного вытеснения (трпв)
- •3. Реакторы с неидеальным перемешиванием
- •3.1. Время выравнивания концентраций в реакторах с перемешиванием
- •3.4. Взаимосвязь между перемешиванием и биологическими превращениями
- •4. Стерилизаторы
- •4.1. Периодическая стерилизация
- •4.2. Непрерывная стерилизация
- •5. Иммобилизованные биокатализаторы
- •5.1. Типы биокатализаторов на основе иммобилизованных клеток и их свойства
- •5.2. Применение биокатализаторов на основе иммобилизованных клеток
- •7. Технология микробиологических процессов
- •7.1. Подбор состава среды
- •7.2. Проектирование типичного асептического аэробного микробиологического процесса и его ведение
- •7.3. Биореакторы других типов
- •8. Особенности технологии процессов с участием растительных и животных клеток и соответствующих реакторов
- •8.1. Культивирование животных клеток; требования к среде
- •8.2. Промышленные реакторы для крупномасштабных процессов с участием животных клеток
- •8.3. Культивирование растительных клеток
- •1. Детекторы для определения физических и химических параметров среды и газов
- •1.1. Детекторы для определения физических свойств среды и газов
- •1.2. Детекторы для определения химического состава среды
- •1.3. Газовый анализ
- •2. Детекторы для непрерывного контроля характеристик популяции клеток
- •3. Автономные методы анализа
- •3.1. Определение свойств среды
- •3.2. Анализ состава популяции клеток
- •4. Эвм и интерфейсы
- •4.1. Основные элементы цифровых эвм
- •4.2. Интерфейсы и периферийные устройства эвм
- •4.3. Системы программного обеспечения
- •5. Анализ данных
- •5.1. Сглаживание и интерполяция данных
- •6. Управление процессами биохимической технологии
- •6.1. Непосредственное управление процессами
- •6.2. Каскадное управление метаболизмом
1.2 Кинетика сбалансированного роста
Моделирование и анализ кинетики роста популяций клеток мы начнем с неструктурированных моделей, в которых биофаза характеризуется только величиной клеточной массы или численной концентрацией. Суммарную скорость роста клеточной массы rх часто выражают как µх, где х — клеточная масса в единице объема культуры, µ — удельная скорость роста клеток, выраженная в единицах обратного времени. В этих параметрах уравнение материального баланса клеточной массы для ПРПП в стационарном состоянии будет выглядеть следующим образом:
![]()
Часто поступающий в проточный реактор поток раствора питательных веществ состоит только из стерильного питательного вещества, так что Xf=0. В таком случае из уравнения (7.8) следует, что отличная от нуля популяция клеток может существовать в стационарном состоянии только при D=µ т. е. тогда, когда удельная скорость клеточного роста равна скорости разведения. Если выполняется условие уравнения (7.9), то при стерильном питательном веществе уравнение (7.8) уже не определяет х. Неопределенность уровня популяции была подтверждена в экспериментах с культурой Bacillus linens в проточном реакторе.
В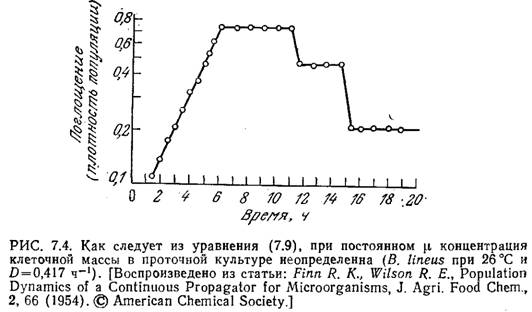 этих экспериментах стационарное
состояние было достигнуто через 6 ч
(рис. 7.4), после чего культуру подвергали
двум последовательным разведениям, при
которых часть содержимого реактора,
состоящего из популяции клеток и среды,
удаляли и замещали чистой средой.
После каждого такого разведения через
некоторое время в системе устанавливалось
новое стационарное состояние,
характеризующееся иной концентрацией
клеточной массы.
этих экспериментах стационарное
состояние было достигнуто через 6 ч
(рис. 7.4), после чего культуру подвергали
двум последовательным разведениям, при
которых часть содержимого реактора,
состоящего из популяции клеток и среды,
удаляли и замещали чистой средой.
После каждого такого разведения через
некоторое время в системе устанавливалось
новое стационарное состояние,
характеризующееся иной концентрацией
клеточной массы.
Уравнение Моно для кинетики клеточного роста
Приведенная на рис. 7.4 зависимость характерна только для тех случаев, когда удельная скорость клеточного роста не зависит от х и s. [Здесь под s мы понимаем массовую концентрацию субстрата, лимитирующего клеточный рост.] Система становится определенной, если скорость роста клеток лимитируется каким-либо питательным веществом.
Прежде чем перейти к обсуждению деталей зависимости скорости роста от подачи питательных веществ, рассмотрим общие теоретические и практические пути создания сред для культивирования клеток.

В зависимости от состава различают два типа сред. Синтетическими называют среды с четко определенным химическим составом. Как показано в табл. 7.1, такие среды создаются на основе раствора неорганических солей, к которому добавляют необходимые источники углерода, азота и энергии, а также все незаменимые витамины. Неорганические соли служат не только источником ионов, необходимых для нормального функционирования клеток, но и выполняют буферную функцию, сглаживая большие флуктуации рН в процессе роста популяций. Сложные среды содержат материалы неопределенного состава. Например, среда 4 в табл. 7.1 относится к сложным, поскольку точный химический состав дрожжевого экстракта неизвестен. В состав других сложных сред входят мясной бульон, кровяной бульон, кукурузный экстракт и сточные воды.
Основное требование, предъявляемое к среде, заключается в обеспечении высокой скорости роста клеток и(или) синтеза продуктов их жизнедеятельности.
Отсюда, однако, отнюдь не следует (как можно было бы предположить чисто интуитивно), что все питательные вещества нужно подавать в большом избытке. Во-первых, избыточная концентрация питательного вещества может ингибировать рост клеток или даже привести к их гибели. Во-вторых, если клетки растут слишком интенсивно, то накапливающиеся конечные продукты метаболизма могут нарушить нормальные биохимические процессы в клетках. Поэтому обычно общий рост клеток лимитируют, ограничивая количество одного питательного вещества в среде.
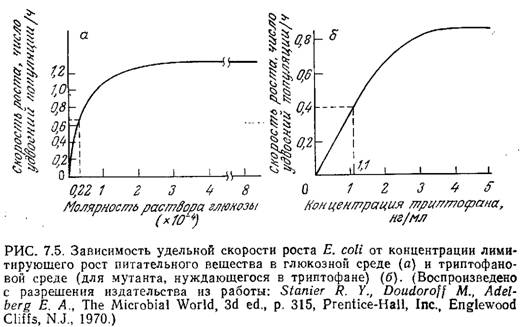
Если концентрация одного незаменимого компонента среды изменяется, а концентрации всех других компонентов остаются без изменения, то, как это показано на рис. 7.5, зависимость скорости клеточного роста от концентрации незаменимого питательного вещества обычно выражается кривой типа гиперболы. Математическое выражение, отражающее функциональную зависимость удельной скорости клеточного роста р, от концентрации незаменимого питательного вещества, было предложено Моно в 1942 г. Уравнение Моно имеет ту же форму, что и уравнение изотермы адсорбции Ленгмюра (1918 г.) и обычное уравнение скорости катализируемой ферментом реакции с одним субстратом, предложенное Анри (1902 г.) и Михаэлисом. и Ментен (1913 г.), и устанавливает, что
![]()
В этом уравнении µmax — максимальная скорость роста, достигаемая при s>Ks и постоянных концентрациях всех других незаменимых питательных веществ. Ks — это такая концентрация лимитирующего клеточный рост питательного вещества, при которой удельная скорость роста вдвое ниже максимального значения. В первом приближении можно считать, что Ks представляет собой промежуточную зону между диапазоном низких концентраций, при которых µ линейно зависит от s, и диапазоном высоких концентраций, когда µ становится независимым от s. Как показано на рис. 7.5, значения Ks для штаммов Е. coli, растущих в лимитируемых глюкозой и триптофаном средах, составляют 0,22-10-4 М и 1,1 нг/мл соответственно.
Поскольку мы уже знакомы с биохимией клетки, для нас должно быть очевидно, что уравнение Моно, скорее всего, чрезмерно упрощено. Как, однако, это часто бывает и в других областях технологии, относительно простое уравнение иногда удовлетворительно описывает определенные зависимости, хотя физический смысл параметров модели неизвестен или, возможно, даже, вообще не существует. Впрочем, в некоторых специфических ситуациях уравнению Моно можно приписать определенный физический смысл. Одна из наиболее показательных ситуаций такого типа складывается тогда, когда скорость клеточного роста лимитируется скоростью транспорта через мембрану при участии пермеаз (вспомните разд. 5.7).
В уравнении Моно (7.10) привлекает его простота, однако применение этого простого выражения требует от исследователя большой осторожности. Во-первых, величина Ks часто довольно мала, поэтому s обычно намного больше Ks и выражение s/(Ks + s) можно рассматривать как адекватное выражению для расчета отклонений µ от µmах по мере снижения концентрации s. Это соотношение предполагает также, что удельная скорость роста р, не равна нулю при любых отличных от нуля концентрациях лимитирующего скорость клеточного роста компонента. В общем случае данное условие нельзя считать доказанным для s<Ks.
Если скорость роста популяции клеток связана с концентрацией лимитирующего клеточный рост питательного вещества математическим выражением типа уравнения Моно, то отсюда следует, что между условиями работы реактора и кинетическими и стехиометрическими параметрами популяции клеток должны существовать определенные зависимости. Для выявления этих зависимостей можно начать с уравнения материального баланса по лимитирующему клеточный рост субстрату, связанного с балансом по, клеточной массе, поскольку ц зависит от s. В балансе по субстрату мы будем использовать экономический коэффициент Ух/s (см. разд. 5.10.1):

Уравнения (7.14) и (7.15) отражают зависимость х и s от скорости потока (D = F/V) в стационарном состоянии. Для очень медленных скоростей потока при заданном объеме, следовательно, s также приближается к нулю. Поскольку почти весь вводимый в реактор субстрат поглощается клетками, то концентрация клеточной массы на выходе из реакторах х будет равна SfYx/s.
По мере постепенного повышения D возрастает и s: сначала пропорционально D, а затем, по мере приближения D к µmах, еще быстрее. Точно таким же образом снижается и концентрация клеточной массы — сначала в линейной зависимости от D, а затем, при D→ µmах, с большей скоростью. При приближении D к µmах в какой-то момент х становится равной нулю; это означает, что скорость разведения D только что превысила максимально возможную скорость роста и решение уравнения (7.14) в условиях стационарного состояния возможно только при х = 0.

Потеря всех клеток в стационарном состоянии, называемая вымыванием, происходит, когда D больше Dmаx; последний параметр можно определить по уравнению (7.14) при х = 0:
![]()
На рис. 7.6 приведены отражаемые уравнениями (7.14) и (7.15) графики зависимостей концентраций субстрата и клеточной массы от D для следующего ряда значений параметров:
µmах =1,0ч-1 Ух/s = 0,5 Кs=0,2г/л sf=10 г/л
Заметьте, что вблизи точки вымывания реакционная смесь становится очень чувствительной к колебаниям D; даже небольшое изменение D сопровождается относительно большим изменением х и (или) s.
Эту зависимость необходимо иметь в виду в тех случаях, когда целью непрерывного микробиологического процесса является производство биомассы. Скорость продуцирования клеток в единице объема реактора равна Dx; на кривой зависимости Dx от D (рис. 7.6) имеется резкий максимум. Максимальную скорость образования клеток можно вычислить, решив дифференциальное уравнение
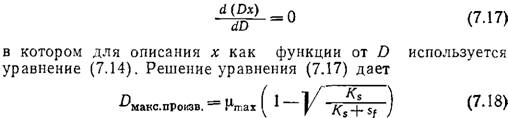
Если, как это часто бывает на практике, Sf>Ks, то D макс.произв. приближается к µmах и, следовательно, находится вблизи точки вымывания. В такой ситуации, изображенной, в частности, на рис. 7.6, как правило, чтобы избежать диапазона наибольшей чувствительности, целесообразно не добиваться максимальной скорости образования биомассы. Вообще при решении любых проблем оптимизации в поисках сравнительно легко регулируемых параметров важно не забывать практические аспекты сочетания чувствительности, регулируемости и надежности.
При изучении закономерностей образования конечных продуктов непрерывных микробиологических процессов введем еще один коэффициент Yр/х, представляющий собой отношение

Вместе с приведенными выше уравнениями, выражающими зависимость |µ и х от параметров процесса, уравнение (7.21) позволяет вычислить концентрацию продукта в выходящем из реактора потоке. Производительность реактора по отношению к продукту равна pD и при постоянном Yp/х максимальна, если D имеет значение, определяемое уравнением (7.18). Следовательно, при попытках добиться максимальной производительности процесса также необходимо учитывать фактор чувствительности. [При каком значении D величина pD максимальна, если YP/x = f (D) ?]
В качестве примера на рис. 7.7 приведены результаты экспериментального изучения роста культуры бактерий Aerobacter aerogenes в проточном реакторе. Экспериментальные результаты и описанная выше простая математическая модель качественно вполне согласуются. В то же время найденная скорость образования клеточной массы и найденная концентрация субстрата остаются приблизительно постоянными в значительно более широком диапазоне условий, чем следует из рассчитанных по уравнению Моно данных (рис. 7.6). Кроме того, модель Моно не согласуется с экспериментальными данными при очень низких и очень высоких скоростях разведения.
В следующем разделе мы изучим эти две
экстремальные ситуации и попытаемся
понять, почему в таких случаях модель
Моно неприменима.
следующем разделе мы изучим эти две
экстремальные ситуации и попытаемся
понять, почему в таких случаях модель
Моно неприменима.
Влияние эндогенного метаболизма и метаболизма поддержания на кинетику клеточного роста
Приведенные на рис. 7.8 данные для культуры А. aerogenes показывают, что при малых скоростях разведения концентрация клеток заметно снижается. Аналогичное поведение наблюдалось и в случае кормовых дрожжей Toruta utilis. Эту особенность, противоречащую модели Моно для хемостата, можно объяснить, если в модели учесть возможность эндогенного метаболизма.
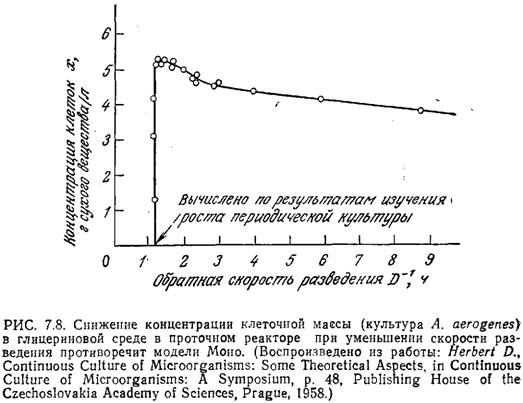
Под эндогенным метаболизмом подразумеваются происходящие в клетке реакции, в которых расходуются клеточные вещества. Чтобы учесть этот эффект, дополним уравнение Моно слагаемым —kex:
![]()
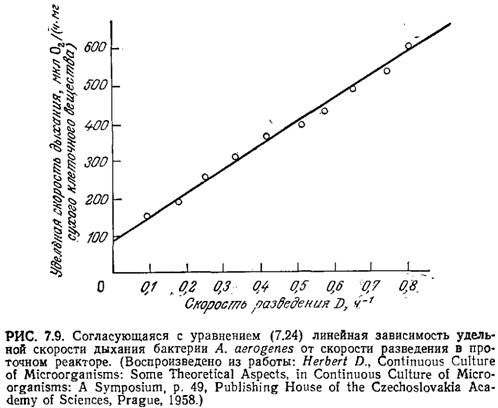

Приведенные на рис. 7.9 экспериментальные данные хорошо согласуются с уравнением (7.24).
Наблюдаемая зависимость экономического коэффициента У от D также подтверждает справедливость уравнения (7.22) для скорости клеточного роста. Если скорость поглощения субстрата равна

Экспериментально показано, что для ряда микроорганизмов зависимость Yx/s от D выражается именно таким уравнением.
Другая возможность, рассмотренная вкратце при обсуждении стехиометрии клеточного роста в разд. 5.10.1, заключается в параллельной утилизации субстрата как для клеточного роста, так и для других энергетических потребностей клетки (метаболизм поддержания). В этом случае скорость утилизации субстрата определяется выражением
Таким образом, мы получили точно такую же функциональную зависимость Yx/s от D, как и в случае модели эндогенного метаболизма [уравнение (7.26)].
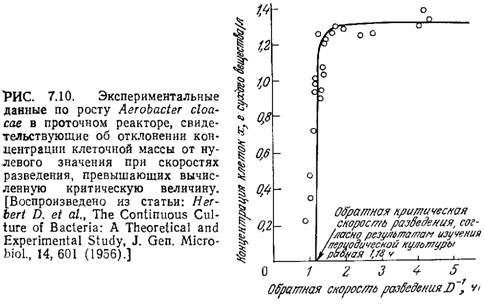
Как показано на рис. 7.10, при высоких скоростях разведения поведение культуры клеток в проточном реакторе может существенно отклоняться от поведения, предсказываемого моделью Моно для хемостата. Здесь не только слишком велика ошибка в определении концентрации клеток вблизи точки вымывания, но и вся популяция клеток может существовать при скоростях разведения, значительно превышающих предсказываемую теорией критическую величину. Более того, по мере приближения D к критическому максимальному значению экономический коэффициент снижается. Одна из возможных причин этого несоответствия может заключаться в относительно высокой концентрации субстрата, характерной для высоких скоростей разведения. В таких условиях субстрат часто не ограничивает рост клеток, и составляющие популяцию клетки могут изменить характер метаболизма, выбрав какой-либо другой лимитирующий фактор среды.


Влияние других параметров среды на кинетику клеточного роста
При сбалансированном росте для характеристики кинетики роста популяции клеток достаточно только одного параметра д. (или времени удвоения численности популяции td = ln2/µ). По этой причине параметр удельной скорости роста д. широко используется для описания влияния среды на поведение популяции. Рассмотрим прежде всего влияние температуры; известно, что живые организмы могут существовать в диапазоне температур примерно от -5 до 95 °С Принято классифицировать прокариоты в соответствии с диапазоном температур их роста. Как показывают приведенные в табл. 7.2 данные, для каждого класса микроорганизмов характерна некоторая оптимальная температура, при которой скорость роста достигает максимума, а также верхняя и нижняя температурные границы, вне которых популяция вообще не способна к росту.
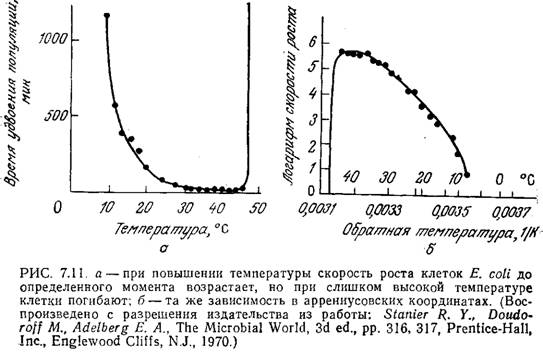
Приведенные на рис. 7.11 кривые свидетельствуют об очень сильном влиянии температуры на рост Е. coli. Обратите внимание на то, что в координатах Аррениуса классическое аррениусовское поведение наблюдается только при низких температурах, а по мере приближения температуры к той границе, при которой бактерии начинают погибать, скорость их роста резко падает. Бросается в глаза сходство зависимостей клеточного роста (рис. 7.11) и каталитической активности ферментов (рис. 3.25) от температуры.

В этой связи неудивительно, что зависимость удельной скорости клеточного роста от температуры часто можно выразить в виде уравнения типа (3.73). Очевидно, в диапазоне относительно низких температур возрастание метаболической активности клетки при повышении температуры связано с повышением каталитической активности входящих в ее состав ферментов. Когда же температура достигает того предела, при котором начинается денатурация термически наиболее лабильных важных для жизнедеятельности клетки белков, то клетка погибает. В ряде случаев эта гипотеза была подтверждена генетическими методами; показано» в частности, что мутация одного гена может существенно изменить максимальную температуру, которую способен выдержать микроорганизм.
Поскольку конформация белка и его активность зависят от рН, мы вправе ожидать, что величина рН будет оказывать существенное влияние на процессы клеточного транспорта, скорости реакций, а следовательно, и скорость роста клеток. Обычно скорость роста бактерий максимальна в диапазоне pFi от 6,5 до 7,5. В качестве примера на рис. 7.12 приведена зависимость скорости роста Е. coli от рН.
Впрочем, из этого правила есть и исключения. Так, ацидофильные бактерии растут при рН 2,0. Обычно отклонение рН на 1,5—2 единицы в любую сторону от оптимальной величины приводит к практически полному прекращению роста (рис. 7.12). Дрожжи лучше всего растут в диапазоне рН от 4 до 5, а оптимальный рН для роста плесневых грибов обычно равен 5—7. Для дрожжей и плесеней характерен довольно широкий диапазон роста — приблизительно от рН 3,0 до рН 8,5. Как показывают приведенные на рис. 7.12 данные, при повышении температуры рН максимальной скорости клеточного роста обычно возрастает.
Н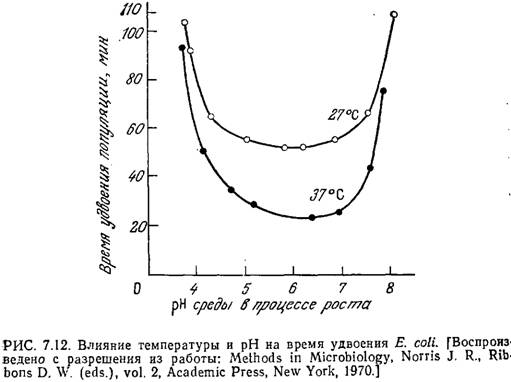 а
удельную скорость роста микроорганизмов
влияют также термодинамическая активность
среды (зависящая в свою очередь от
растворенных в ней веществ) и
гидростатическое давление. Скорость
роста аэробных организмов, очевидно, в
существенной степени зависит от
концентрации растворенного кислорода.
а
удельную скорость роста микроорганизмов
влияют также термодинамическая активность
среды (зависящая в свою очередь от
растворенных в ней веществ) и
гидростатическое давление. Скорость
роста аэробных организмов, очевидно, в
существенной степени зависит от
концентрации растворенного кислорода.
Кинетика клеточного роста в переходном состоянии
В определенные периоды роста культур клеток в реакторах периодического действия или после возмущений в проточных реакторах непрерывного действия популяции клеток находятся в переходном состоянии, кинетика которого может оказаться весьма сложной. Для описания различных вариантов роста клеток в переходном состоянии могут потребоваться разные типы математических моделей кинетики роста. Здесь мы рассмотрим несколько примеров кинетики клеточного роста в переходном состоянии, причем основное внимание уделим наиболее общему случаю роста популяции в реакторе периодического действия.
Основные фазы роста клеток в реакторах периодического действия
К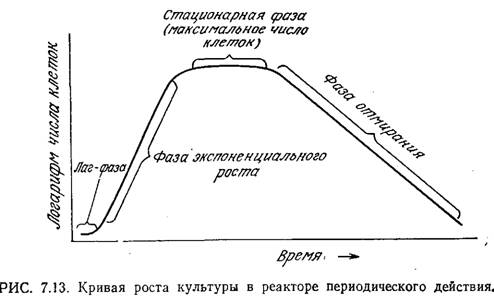 ак
показано на рис. 7.13, в типичном периодическом
процессе число живых клеток изменяется
во времени. После лагфазы (фазы задержки,
латентной фазы), в течение которой
численность популяции практически не
изменяется, наступает период быстрого
роста, когда число клеток возрастает
во времени экспоненциально. Часто эту
стадию роста культур клеток в реакторе
периодического действия называют
логарифмической фазой (лаг-фазой); мы
предпочитаем более точный термин -
экспоненциальный рост, который и будем
использовать в последующем изложении.
ак
показано на рис. 7.13, в типичном периодическом
процессе число живых клеток изменяется
во времени. После лагфазы (фазы задержки,
латентной фазы), в течение которой
численность популяции практически не
изменяется, наступает период быстрого
роста, когда число клеток возрастает
во времени экспоненциально. Часто эту
стадию роста культур клеток в реакторе
периодического действия называют
логарифмической фазой (лаг-фазой); мы
предпочитаем более точный термин -
экспоненциальный рост, который и будем
использовать в последующем изложении.
Понятно, что в закрытом сосуде клетки не могут размножаться бесконечно, и вслед за фазой экспоненциального роста наступает стационарная фаза. В этот момент число клеток достигает максимума. В конце концов стационарная фаза сменяется фазой отмирания, когда число клеток начинает снижаться. Здесь также часто наблюдается экспоненциальное снижение, численности популяции живых организмов.
В микробиологических процессах важную роль может играть любая из фаз. Так, при разработке процесса одной из его задач может быть сокращение до минимума продолжительности лаг-фазы и достижение максимальной длительности фазы экспоненциального роста (и скорости роста клеток в этой фазе); вторая цель в свою очередь достигается путем искусственного торможения перехода к стационарной фазе. Часто очень важно к концу процесса добиться максимальной плотности популяции клеток, что возможно только при условии учета всех переменных, влияющих на фазы роста культуры. В последующем изложении мы будем рассматривать каждую фазу отдельно и в соответствующие моменты обсудим математические модели наиболее важных явлений. Это обсуждение мы продолжим в разд. 7.3.2, где рассмотрим математические модели всего процесса клеточного роста в реакторе периодического действия.
Продолжительность лагфазы, наступающей после инокуляции свежей среды, зависит как от изменений в составе питательных веществ (если такие изменения имеют место), так и от возраста и массы инокулята. Сопровождающее перенос клеток из одной среды в другую резкое изменение условий может оказывать на живые клетки разностороннее действие. Во-первых, как мы уже знаем, системы контроля и регуляции ферментативной активности включают и адаптационные механизмы; в частности, сталкиваясь с новым питательным веществом, клетка начинает его усваивать только после синтеза новых ферментов. Поэтому, например, перенос находящейся в экспоненциальной фазе культуры из глюкозной среды в лактозную всегда сопровождается периодом с незначительной скоростью деления клеток; в этот период в клетках синтезируются ферменты и кофакторы, участвующие в пути метаболизма лактозы. (Что произойдет, если выращенную на лактозе культуру перенести в глюкозо-лактозную среду) Аналогично лаг-фаза может наступить и после изменения концентраций питательных веществ. Если новая питательная среда богаче лимитирующим клеточный рост питательным веществом, то в течение некоторого времени это вещество будет расходоваться не на рост клеток, а на повышение концентраций метаболизирующих ферментов. Снижение концентрации питательного вещества может и не сопровождаться лаг-фазой; в этом случае экспоненциальный рост возобновляется сразу же после снижения концентрации, но скорость клеточного роста снижается.
Д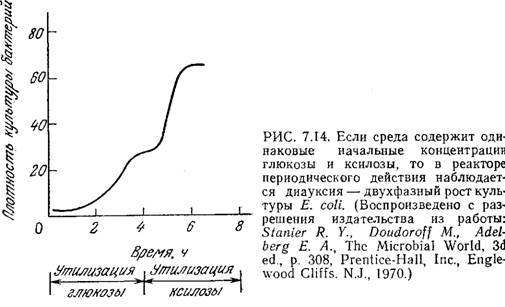 ля
активации многих внутриклеточных
ферментов необходимы те или иные
низкомолекулярные соединения (витамины,
кофакторы) или ионы металлов (активаторы),
которые могут проникать через клеточные
мембраны. Перенос небольшого объема
культуры клеток или инокулята в
значительно больший объем среды вызовет
обратную диффузию этих необходимых для
ферментативного катализа веществ в
среду, если в последней они отсутствуют
или если среда резко отличается от
инокулята по своей ионной силе. В таком
случае опять-таки скорость роста упадет
соответственно понижению концентрации
активаторов в клетке, что в свою очередь,
повлечет за собой лаг-фазу на период
«включения» новых механизмов синтеза
этих активаторов. Если в описанных
процессах снижаются концентрации
незаменимых активаторов (ионов и
витаминов, которые не могут синтезироваться
в клетке), то общий уровень клеточной
активности должен снизиться необратимо.
ля
активации многих внутриклеточных
ферментов необходимы те или иные
низкомолекулярные соединения (витамины,
кофакторы) или ионы металлов (активаторы),
которые могут проникать через клеточные
мембраны. Перенос небольшого объема
культуры клеток или инокулята в
значительно больший объем среды вызовет
обратную диффузию этих необходимых для
ферментативного катализа веществ в
среду, если в последней они отсутствуют
или если среда резко отличается от
инокулята по своей ионной силе. В таком
случае опять-таки скорость роста упадет
соответственно понижению концентрации
активаторов в клетке, что в свою очередь,
повлечет за собой лаг-фазу на период
«включения» новых механизмов синтеза
этих активаторов. Если в описанных
процессах снижаются концентрации
незаменимых активаторов (ионов и
витаминов, которые не могут синтезироваться
в клетке), то общий уровень клеточной
активности должен снизиться необратимо.
На длительность лаг-фазы очень большое влияние оказывает фаза роста, в которой находится инокулят, полученный в свою очередь путем культивирования клеток в небольшом реакторе периодического действия. Объем инокулята также является важной переменной; в частности, как мы уже упоминали, она влияет на количество диффундирующих в среду веществ, например витаминов и активаторов. Так, перенос популяции молодых клеток в среду, богатую промежуточными метаболитами (например, аминокислотами), не сопровождается лаг-фазой; напротив, при переносе того же самого инокулята в среду с сульфатом аммония клетки будут обедняться жизненно важными промежуточными веществами за счет их транспорта в раствор. Если в момент переноса культура находится в фазе экспоненциального роста, то в среде инокулята уже должны содержаться в значительных концентрациях продукты промежуточного метаболизма, поэтому сопровождающее перенос разведение окажет меньший эффект.
Перенос в аммониево-сульфатную среду старой культуры (находящейся в стационарной фазе или близкой к ней) приведет к более длительной лаг-фазе. Если среда содержит несколько источников углерода, то иногда можно наблюдать ряд последовательных лаг-фаз (рис. 7.14). Это явление, называемое диауксией (двухфазным ростом), обусловливается изменением метаболического механизма в процессе роста. При диауксии клетки сначала усваивают один источник углерода, а затем, когда это питательное вещество истощается, клеткам приходится переключать свою активность с роста на «перестройку», необходимую для усвоения нового источника углерода. В основе такой последовательной утилизации питательных веществ, возможно, лежит явление катаболитной репрессии, рассмотренное в разд. 6.1.4.
Попытки свести к минимуму время роста культуры и всего процесса обычно включали сокращение продолжительности лаг-фазы, типичной для любого периодического процесса с участием микроорганизмов. Из уже рассмотренного нами материала и ряда других данных (описанных в приведенной в конце главы литературе) вытекают следующие общие принципы:
1. Культура инокулята должна обладать максимальной активностью, а в момент введения в среду инокулят должен находиться в фазе экспоненциального роста.
2. Среда, в которой выращивается инокулят, по своему составу должна быть близкой к составу среды крупномасштабного микробиологического процесса.
3. Для предотвращения обусловленных диффузией потерь незаменимых промежуточных веществ и активаторов целесообразно применять инокулят большего объема (до 5—10% от объема новой среды).
К концу лаг-фазы популяция микроорганизмов приспосабливается к новым условиям. Теперь клетки могут быстро размножаться, и клеточная масса (или число живых клеток) удваивается через определенные промежутки времени. Увеличение числа клеток в этот период может быть описано уравнением

Как и в случае роста клеток в стационарном состоянии в ПРПП, для описания популяции в ходе экспоненциального роста в периодическом процессе необходим только один параметр µ (или td). В первом приближении можно считать, что в этой фазе рост периодической культуры сбалансирован. Следовательно, путем изучения роста культуры клеток в реакторе периодического действия можно получить полезные данные о кинетике сбалансированного роста, если только это изучение ограничено фазой экспоненциального роста.
Экспоненциальный рост заканчивается, когда одна из важных переменных процесса (например, концентрация питательного вещества или токсина) достигает значения, не обеспечивающего максимальную скорость роста клеток. Истощение запасов лимитирующего рост питательного вещества может привести к очень резкому изменению скорости клеточного роста, поскольку в экспоненциальной фазе общая скорость утилизации питательного вещества возрастает очень быстро. Чтобы найти описывающее это явление приближенное математическое выражение, предположим, что до установления стационарной фазы скорость потребления питательного вещества А пропорциональна массовой концентрации живых клеток:
![]()
Допустим далее, что экспоненциальный рост продолжается до тех пор, пока не установится стационарная фаза, и что экспоненциальный рост начинается в нулевой момент времени. Тогда
![]()
где хо — массовая концентрация живых клеток в момент начала экспоненциального роста.
Если в нулевой момент времени концентрация А равна aо, то из уравнений (7.38) и (7.39) следует, что А будет полностью утилизировано, когда
![]()
Здесь xs—массовая концентрация популяции в тот момент, когда вещество А истощено и популяция переходит в стационарную фазу.
Следовательно, xs представляет собой максимальную концентрацию биомассы в периодическом процессе (ср. рис. 7.13). Преобразованием уравнения (7.40) можно получить уравнение, выражающее максимальную концентрацию биомассы в момент истощения питательного вещества:
![]()
Линейная зависимость xs от начальной концентрации питательного вещества ао во многих случаях наблюдалась экспериментально (x0 часто настолько мало, что им можно пренебречь). Пример такого поведения популяции клеток приведен на рис. 7.15. В то же время график зависимости ns (численной плотности клеток в стационарной фазе) бактерии A. aerogenes от концентрации лактозы заметно отличается от зависимости, предсказываемой уравнением (7.41).
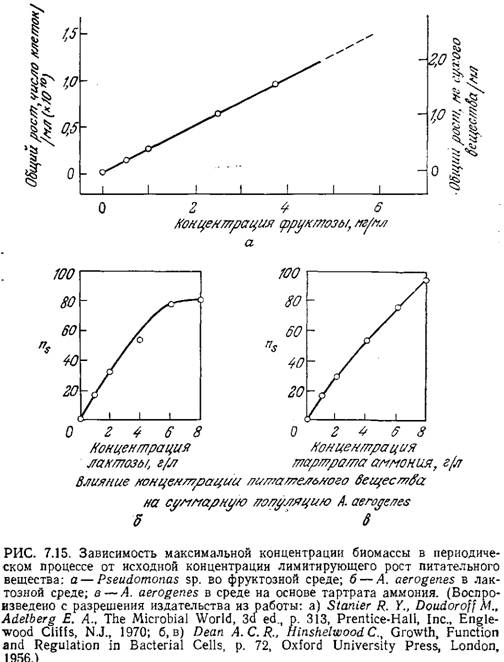
Очевидно, на начало стационарной фазы и максимальную концентрацию биомассы могут влиять и другие факторы.

Согласно уравнению (7.42), рост клеток прекращается только тогда, когда ct достигает значения, равного 1/b. Разведение данной среды, содержащей токсин, или введение непитательного вещества, связывающего этот токсин, должно сопровождаться возобновлением клеточного роста и, следовательно, увеличением максимальной концентрации биомассы xs в стационарной фазе. Если рост сдерживается истощением питательного вещества, то разведение раствором, не содержащим питательных веществ, не влияет на xs. Этими зависимостями можно пользоваться в качестве критериев для предварительной оценки причин снижения скорости и прекращения клеточного роста. Более точные критерии сформулировать труднее, поскольку, как мы увидим позднее, рост популяции клеток в условиях истощения основного питательного вещества замедляется несколько раньше, чем это вещество полностью утилизируется, а скорость роста клеток в присутствии токсина может стать неизмеримо малой задолго до того момента, когда dx/dt станет равным нулю.
Н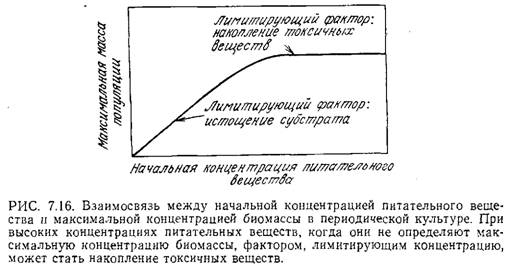 а
рис. 7.16 изображена предсказываемая
теорией зависимость максимальной
концентрации биомассы от исходной
концентрации данного питательного
вещества.
а
рис. 7.16 изображена предсказываемая
теорией зависимость максимальной
концентрации биомассы от исходной
концентрации данного питательного
вещества.
Постепенное снижение концентрации питательного вещества в конце концов приводит к линейной зависимости максимальной концентрации биомассы от начальной концентрации питательного вещества. В этом случае отсутствие фазы экспоненциального роста, очевидно, вызвано недостатком питательного вещества. Напротив, повышение начальной концентрации питательного вещества может привести к тому, что величина xs в конце концов перестанет быть зависимой от а0; возможно, это объясняется накоплением токсичных веществ или влиянием другого лимитирующего клеточный рост питательного вещества.
Изучая всю популяцию, мы не должны забывать о судьбе индивидуальных клеток. В общем случае популяции всегда негомогенны, и кривая роста популяции в периодическом процессе отражает лишь некоторый усредненный параметр чрезвычайно сложной системы. Во время фазы экспоненциального роста, например, некоторые клетки делятся и порождают новые, молодые клетки, а другие в тот же самый момент растут и созревают. Поскольку клетки разного возраста обычно имеют различные размеры и химический состав, мы можем рассматривать клетки одного возраста как некоторое «вещество». С этой точки зрения рост одного вида микроорганизма приводит к популяции, содержащей множество различных «веществ».
Гетерогенность популяции становится особенно заметной в стационарной фазе и фазе отмирания. Так, в стационарной фазе некоторые клетки делятся, а некоторые погибают. Мертвые клетки часто подвергаются лизису (разрушению и растворению); в результате углеводы, аминокислоты и другие компоненты клеток попадают в среду и становятся питательными веществами для живых членов популяции. Такой каннибализм способствует сохранению массы популяции в стационарной фазе. В конце концов, однако, истощение питательных веществ и накопление токсинов приводит к тому, что популяция не может поддерживать далее свое существование и наступает фаза отмирания.
Фазе отмирания было посвящено сравнительно небольшое число исследований, возможно, вследствие того, что многие промышленные микробиологические периодические процессы заканчиваются задолго до наступления этой фазы. Обычно считается, что гибель популяции подчиняется экспоненциальному закону: х=хse-kt (7.48)
В этом уравнении t означает время, прошедшее с начала фазы отмирания
В основу уравнения (7.48) положено допущение о том, что в любое время погибает одна и та же доля живых клеток.
О дно
из объяснений экспоненциального
уменьшения численности популяции в
фазе отмирания заключается в том, что
в культуре клеток летальный исход
является случайным событием и гибель
данной клетки определяется только
вероятностью этого события. Недостатком
такого объяснения является пренебрежение
историей популяции. Дин и Хиншелвуд
предположили, что в стабильной и
отмирающей популяциях не только живые
клетки существуют за счет отмерших, но
и конкурирующие участки метаболического
механизма клетки в борьбе за дефицитные
промежуточные соединения также существуют
один за счет другого [3]. Если принять
это предположение, можно показать, что
скорость гибели клеток должна подчиняться
экспоненциальному закону. Другие модели
снижения численности популяции мы
обсудим в разд. 7.7.
дно
из объяснений экспоненциального
уменьшения численности популяции в
фазе отмирания заключается в том, что
в культуре клеток летальный исход
является случайным событием и гибель
данной клетки определяется только
вероятностью этого события. Недостатком
такого объяснения является пренебрежение
историей популяции. Дин и Хиншелвуд
предположили, что в стабильной и
отмирающей популяциях не только живые
клетки существуют за счет отмерших, но
и конкурирующие участки метаболического
механизма клетки в борьбе за дефицитные
промежуточные соединения также существуют
один за счет другого [3]. Если принять
это предположение, можно показать, что
скорость гибели клеток должна подчиняться
экспоненциальному закону. Другие модели
снижения численности популяции мы
обсудим в разд. 7.7.
Неструктурированные модели клеточного роста в периодических процессах
В простейшем подходе к моделированию роста культуры клеток в периодическом процессе мы допускаем, что скорость роста клеточной массы во времени является функцией одной лишь клеточной массы, т. е.
![]()
Как мы скоро увидим, из этого уравнения отнюдь не следует, что мы должны пренебрегать любыми изменениями, происходящими в ходе клеточного роста в среде.
Одной из простейших
моделей типа (7.49) является закон Мальтуса,
который математически можно выразить
следующим образом:
![]()
г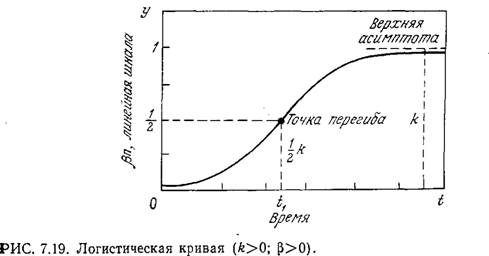 де
µ — константа. Нетрудно видеть, что
таким же образом выражается уже известная
нам закономерность накопления клеточной
массы в фазе экспоненциального роста.
Предсказание Мальтуса о неизбежности
рокового конца человечества в результате
неконтролируемого роста народонаселения
не оправдалось (или, быть может, пока
еще не оправдалось?); так же и в случае
популяций микроорганизмов вслед за
фазой экспоненциального роста наблюдается
переход к стационарной популяции.
де
µ — константа. Нетрудно видеть, что
таким же образом выражается уже известная
нам закономерность накопления клеточной
массы в фазе экспоненциального роста.
Предсказание Мальтуса о неизбежности
рокового конца человечества в результате
неконтролируемого роста народонаселения
не оправдалось (или, быть может, пока
еще не оправдалось?); так же и в случае
популяций микроорганизмов вслед за
фазой экспоненциального роста наблюдается
переход к стационарной популяции.
Эта теория получила дальнейшее развитие в работах Ферлхурста (1844 г.), а также Перла и Рида (1920 г.), которые при анализе роста популяции стали учитывать ингибирующий фактор. Допустив, что ингибирование пропорционально х2, эти исследователи предложили уравнение
![]()
Это выражение представляет собой уравнение Риккати; его интегрирование не представляет затруднений и приводит к уравнению логистической кривой:
![]()
Как показано на рис. 7.19, логистическая кривая имеет S-образную форму и приводит к стационарной популяции с максимальной концентрацией биомассы xs=l/β.
Одно из возможных объяснений логистической кривой сводится к допущению, что скорость продуцирования токсина пропорциональна скорости роста популяции:
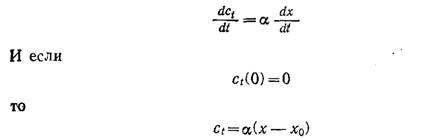
Обычно пренебрежимо мало по сравнению с x; в таких случаях подстановка уравнения (7.55) в (7.42) приводит к уравнению типа (7.51).
Описанные выше неструктурированные модели клеточного роста имеют несколько недостатков. В частности, в них не находит отражения лаг-фаза, не учтены влияющие на рост клеток различные переменные, а также данные о метаболизме клетки и его регуляции. В последующих разделах мы попытаемся найти связи между сложной биохимией клетки и явлениями, наблюдаемыми при росте популяции в периодическом процессе.
