
ТЕСТИРОВАНИЕ КОЛЛОКВИУМ ПО ТИТРИМЕТРИИ (2 часть)
Число____________ ФИО______________________________
Билет № 5
1. Мерную посуду в титриметрическом анализе применяют для:
-
приготовления рабочих растворов
приготовления стандартных растворов
отбора пробы исследуемого раствора
добавления растворов индикаторов
измерения объема растворов титрантов
2. EMnO4-+8H+/Mn2+=1,51 В. Восстановить MnO4–- в кислой среде может …
KBrO3; Eo2BrO3-–/Br2=1,52 В
Na2C2O4; E2CO2/C2O42–-=0,49 B
H2O2; EH2O2+2H+/2H2O=1,77 B
Na2S4O8; ES2O82-/2SO42–-=2,0 B
F2; EF2-/2F–-=2,87 B
3. Координаты кривой титрования в редоксиметрии
E=f(Vтитранта)
pH=f(Vтитранта)
E=f(c)
pMe=f(Vтитранта)
4. Соответствие метода, индикатора и изменения цвета титруемого раствора при фиксировании точки эквивалентности:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Винно-красный – синий |
5. На титрование 20,0 см3 раствора щавелевой кислоты с концентрацией с(1/2H2C2O4) = 0,100 моль/дм3 затрачено 25,0 см3 раствора KMnO4. Вычислите молярную концентрацию эквивалента KMnO4 (моль/дм3).
-
1. 0,064.
3. 0,032.
2. 0,080.
4. 0,010.
6. Продукты реакции FeSO4+KMnO4+H2SO4→
Fe2(SO4)2
MnSO4
MnO2
K2SO4
H2O
K2MnO4
Напишите уравнение реакции, расставьте коэффициенты.
7. Способ фиксирования ТЭ в перманганатометрии
применение специфического индикатора
безиндикаторное титрование
применение редокс-индикатора
применение фенолфталеина
8. Катионы,определяемые методом комплексонометрии
K+
Mg2+
H+
Ca2+
Na+
NH4+
9. Буферная смесь, применяемая в комплексонометрии, для поддержания pH>9
1. NH4OH+NH4Cl
2. CH3COOH+CH3COONa
3. HCOOH+HCOONa
4. C6H5OOH+C6H5OONH4
10. На титрование раствора 10,00 см3 0,02000 моль/дм3 раствора MgSO4 расходуется 10,20 см3 раствора комплексона III. Титр комплексона III (г/см3)
-
5,836∙10–2.
6,59∙10–3.
6,85∙10–2.
1,35∙10–3.
11. Соответствие между значениями рН при комплексонометрическом титровании и титруемыми ионами металлов
Значение рН |
Титруемые ионы |
1. рН = 2 |
1. Mg 2+ |
2. рН = 9–10 |
2. Fe 3+ |
|
3. Th4+ |
|
4. Al3+ |
12. Соответствие между формулами комплексонов и их названиями:
-
1.
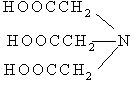
Двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), комплексон III
2.
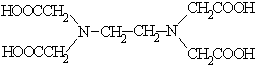
Нитрилотриуксусная кислота (НТУ), комплексон I
3.
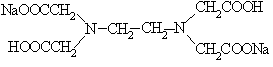
Этилендиаминтетрауксусная кислота (ЭДТУ), комплексон II
13. Селективное определение двух разных металлов в растворе методом комплексонометрического титрования возможно если
1. Куст (Ме1R)/ Куст (Ме2R)≥104-105
2. Куст (Ме1R)/ Куст (Ме2R)≤104-105
3. Куст (МеR) › Куст (МеInd)
4. Куст (МеR) ‹ Куст (МеInd)
14. Металлиндикаторы – это аналитические реагенты, образующие окрашенные комплексы с …
титрантом
титрируемым ионом металла
ионом, входящим в состав буферной смеси
15. Титрант и индикатор при определении хлорид-ионов в растворе методом Мора
1. AgNO3, Fe(III) 3. AgNO3, K2CrO4
2. I2, крахмал 4. KSCN, Fe(III)
Ответ пояснить уравнениями реакций.
16. При добавлении избытка раствора серной кислоты к 20 мл 0,1 М раствора ВаCl2 образуется осадок массой ________ мг.
0,233
0,208
0,416
0,466
Число__________________ Ф. И. О.__________________
Билет № 6
1. Точка эквивалентности – это такой момент в процессе титрования, когда:
Индикатор поменял окраску;
Титрант и титруемое вещество прореагировали между собой в эквивалентных количествах;
Вещества прореагировали между собой в равных количествах;
Число моль – эквивалентов титранта и титруемого вещества обратно пропорционально
2.
Какой ион можно окислить KMnO4
в кислой среде?
![]() =
+ 1,51 В.
=
+ 1,51 В.
-
1. Bi3+;
 =
+ 1,80 B.
=
+ 1,80 B.2. NO2–;
 =
+ 0,94 B.
=
+ 0,94 B.3. SO42–;
 =
+ 2,01 B.
=
+ 2,01 B.4. F–;
 = + 2,87 B.
= + 2,87 B.
3. Вычислите массу (мг) Fe2+ в растворе, на титрование которого затрачено 12,50 см3 раствора перманганата калия с концентрацией с(1/5KMnO4) = 0,02000 моль/дм3.
-
1. 14,00 ∙ 10–3.
3. 14,00.
2. 7,900.
4. 7,90 ∙ 10–3.
4. Скачок на кривой титрования в редоксиметрии при использовании в качестве индикатора эриоглауцина (Е0ind = 1,00 В) составляет
0,60….....1,00
0,80….....1,40
1,10….....1,31
0,60….....0,90
Найдите стехиометрический коэффициент перед окислителем в реакции
KMnO4 + H2C2O4 + H2SO4 → MnSO4 + CO2+ K2SO4 + H2O.
1. 2 3. 1
2. 5 4. 3
6. Почему для подкисления растворов в перманганатометрии не применяется HCl, а в основном H2SO4?
1. Происходит реакция окисления хлорид-ионов перманганат-ионами
2. Улетучивается часть хлора, образовавшегося в результате окисления хлорид-ионов
3. Повышается расход перманганата калия на титрование анализируемого вещества
4. Объясняется всеми вышеперечисленными причинами.
7. В иодометрии титрантом является стандартный раствор…
I2
KI
Na2S2O3
KIO3
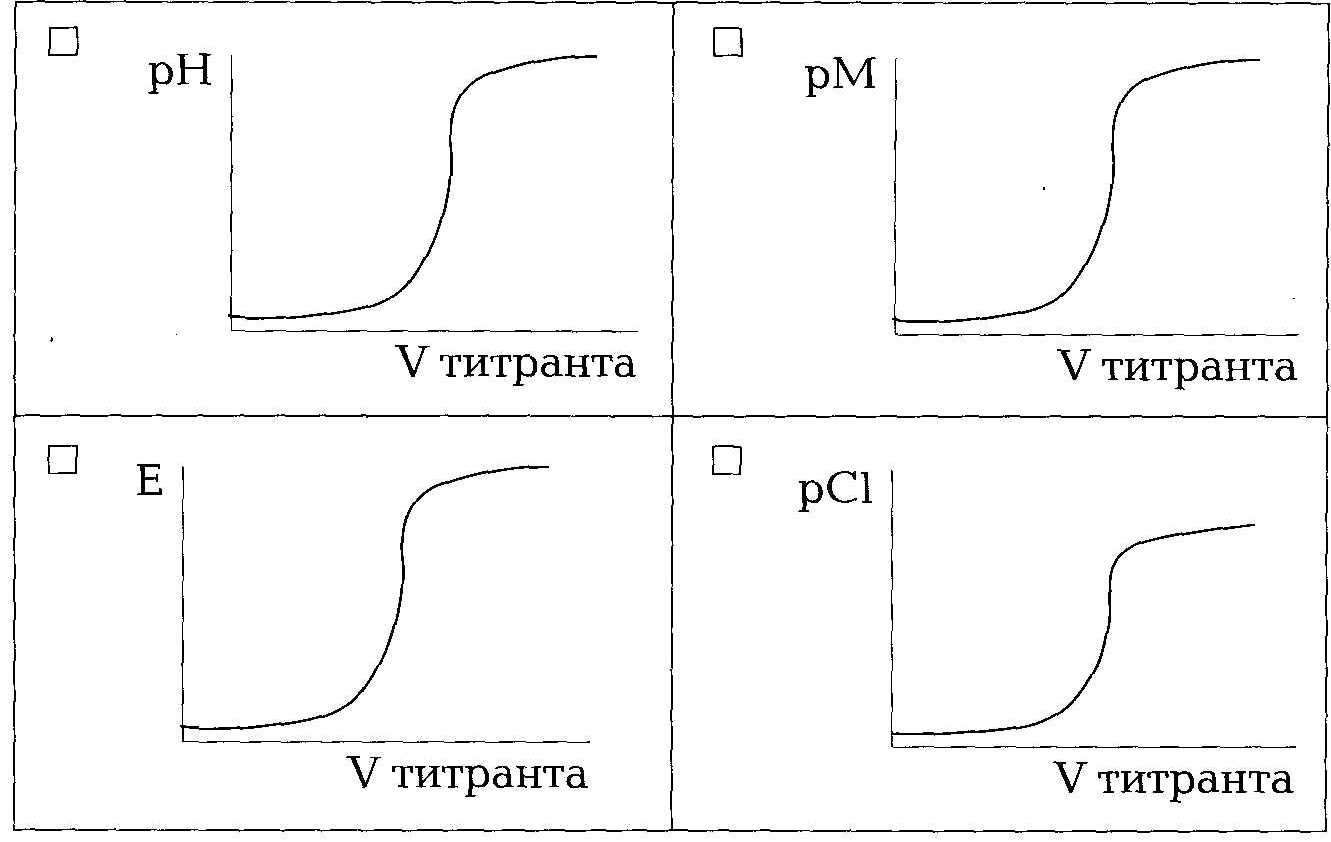
8. Кривая окислительно-восстановительного титрования …
9. В процессе комплексонометрического титрования в растворе изменяется (несколько ответов)
1. pH 3. E 5. pT
2. pMe 4.pK 6.C(Me2+)
10. Комплексонометрическим методом можно определить в растворе:
Ca2+, Mg2+
Ca2+, Na2+
K+, Na+
Cu2+, K+
Написать уравнение реакции комплексообразования, находящейся в основе метода
11. На титрование 20,0 см3 водопроводной воды израсходовано 5,80 см3 0,020 моль/дм3 раствора комплексона III. Общая жесткость воды (ммоль/дм3)
-
5,8.
11,6.
2,9.
1,5.
12. Укажите метод и индикатор для определения жесткости воды
1. Кислотно-основное титрование, эозин
2. Комплексонометрия, эриохромовый черный Т
3. Йодометрия, крахмал
4. Аргентометрия, дихромат калия
13. Фактор эквивалентности Al3+ в реакции с ЭДТА…
1/1 3. 1/3 5. 1/5
½ 4.1/4 6.1/6
14. При прямом комплексонометрическом титровании окраска раствора изменяется, потому что в конечной точке титрования протекает реакция…
Мn+ + Ind- = МIndn-1
МIndn-1 +H2Y2 - = MYn-4 + HInd + H+
Мn+ + H2Y2- = MYn-4 + 2H+
15. Титрант и индикатор метода Фольгарда при определении хлорид-ионов
1. AgNO3, K2CrO4 3 NH4SCN, K2CrO4
2. NH4SCN, NH4Fe(SO4)2 4. Na2S2O3, крахмал
Ответ пояснить уравнениями реакций.
16. Объем 0,1 М раствора NаOН, необходимый для осаждения железа в виде гидроксида из 20 мл 0,05 М раствора нитрата железа (III), равен ________ мл (с точностью до точного значения).
Число________________ Ф.И.О.________________
