
- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
![]() (1)
(1)
Однако анализ равновесной системы с учетом только реакции (1) является неполным. Газовая фаза наряду с молекулярным кислородом при высоких температурах в условиях равновесия будет содержать и другие компоненты — насыщенный пар металла РОМе насыщенный пар окисла —Р°МеО атомарный кислород. Указанное число, газообразных компонентов является минимальным, возможно наличие и других газообразных окислов.
Результаты масс-спектрометрических исследований показывают, что существующая теория термической диссоциации соединений не может объяснить ряд экспериментальных данных. Так, А12Оз диссоциирует на пары алюминия, атомарный кислород, газообразную моноокись алюминия АlO и субокись алюминия А12О; окись германия GeO2 — на газообразную моноокись германия GеО и молекулярный кислород; кремнезем — на газообразную моноокись кремния SіО, молекулярный и атомарный кислород; окись циркония ZnО — на газообразную моноокись циркония ZbО и атомарный кислород; полутораокись титана Ті2Оз — на газообразные окислы (моноокись титана ТіО и двуокись титана ТіО2); закись марганца МnО —на атомарный марганец, молекулярный и атомарный кислород .
Р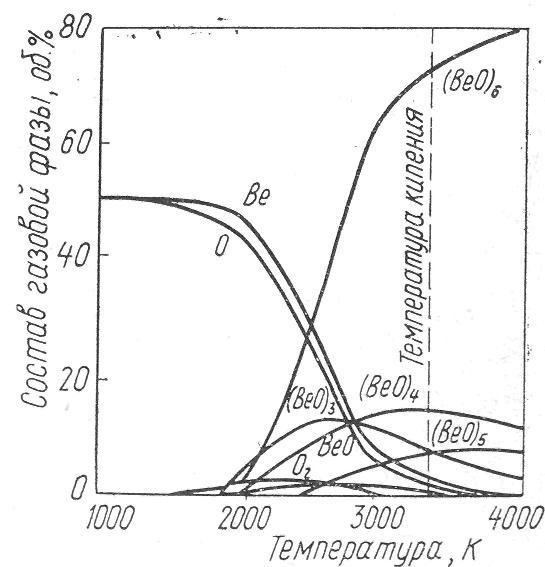 ис
2.2 Температурная зависимость состава
газовой фазы над окисью бериллия.
ис
2.2 Температурная зависимость состава
газовой фазы над окисью бериллия.
И. С. Куликов обосновал необходимость рассматривать диссоциацию окислов и других соединений, исходя из следующих двух положений:
1. В комплексе реакций перехода веществ из конденсированного состояния в газообразное наибольшее развитие получают те реакции, которые сопровождаются минимальными затратами (минимальными положительными изменениями свободной энергии на 1 моль газообразных продуктов реакции).
2. Новая конденсированная фаза в результате диссоциации хи-мического соединения появится лишь в том случае, когда в газовой фазе будет обеспечено давление насыщенного пара новой конденсированной фазы.
Продукты диссоциации станут газообразными только тогда, когда в газовой фазе не будет обеспечиваться давление насыщенных паров ни для одной из конденсированных фаз, при этом переход из конденсированного состояния в газообразное примет конгрунтный характер. Такую разновидность диссоциации называют газообразной диссоциацией. Если химические соединения диссоциируют на газовую и конденсированную фазы, то этот вид диссоциации называется конденсатным.
При диссоциации химического соединения МеО паровая фаза над ним будет состоять из О, О2, Ме, МеО, МеО2 и других газов. Суммарное давление паравой фазы можно записать в виде следующего уравнения:
![]() (1)
(1)
Уравнения констант равновесия химического соединения и газообразных соединений имеют вид
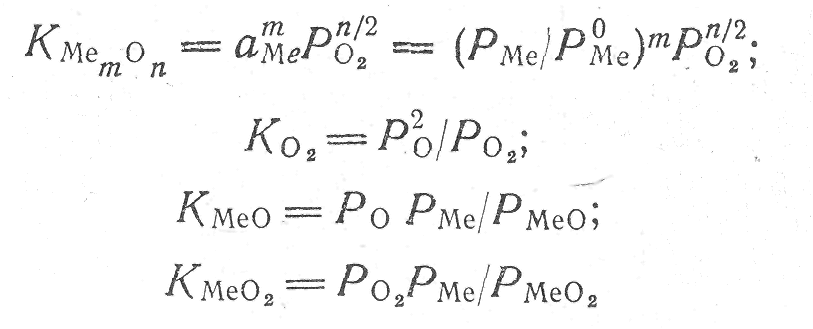 (2)
(2)
В первом уравнении величина
![]() заменяется отношением упругости пара
Ме в данном состоянии Рме
к упругости пара Ме в стандартном
состоянии P
заменяется отношением упругости пара
Ме в данном состоянии Рме
к упругости пара Ме в стандартном
состоянии P![]() .
Зависимость парциальных
давлений Ро2,
РМе,
Рмео2
от величины Р0
и соответствующих констант равновесия
описывается уравнениями.
.
Зависимость парциальных
давлений Ро2,
РМе,
Рмео2
от величины Р0
и соответствующих констант равновесия
описывается уравнениями.
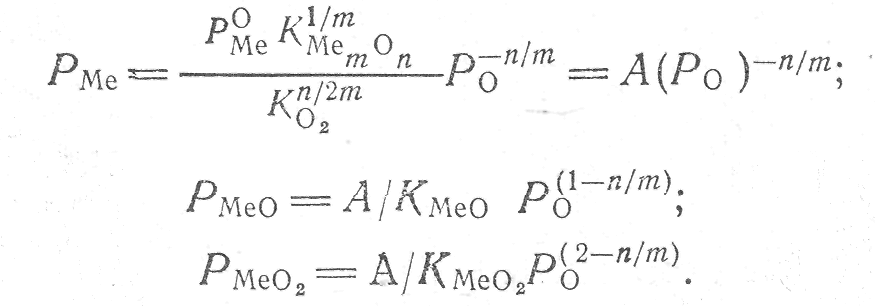
После подстановки величин парциальных давлений в формулу (1) получим
![]()
Наличке экстремума определяется в результате дифференцирования уравнения (2) по РО и приравнивания производной к нулю. При этом получается следующее уравнение:
![]() (3)
(3)
Состав конденсированной фазы при конгруэнтном переходе не претерпевает изменений, поэтому паровая фаза характеризуется таким же составом, как и химическое соединение:
![]() (4)
(4)
где
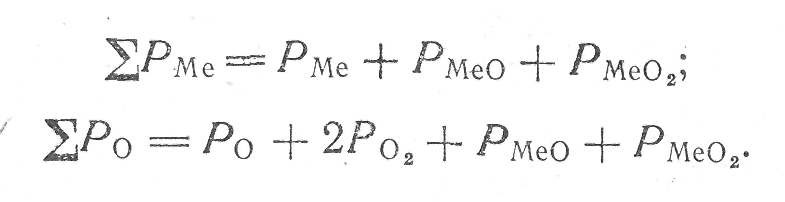
После подстановки в уравнение (4) значений 2РМе и 2Р0 получим
![]() (5)
(5)
Пользуясь уравнением (5), можно по значениям констант рав-новесия реакций диссоциации рассчитать упругость пара металла.
Рассмотрим процесс диссоциации глинозема по И. С. Куликову . Основным окислом алюминия является глинозем А12О3. В продуктах диссоциации А12О3 в газообразном состоянии обнаружены АІО, А12О и А12О2. Наряду с атомами, алюминий в газообразном состоянии образует и молекулы А1. Однако соответствующие расчеты показали, что в насыщенном паре АІ доля молекул алюминия А12 составляет менее 1 % и их можно не учитывать при расчете состава газовой фазы над глиноземом. Таким образом, в газовой фазе над глиноземом будет шесть компонентов — А1, О, О2, АlO, А12О, А12О2.
Ниже приведены следующие балансовые уравнения:
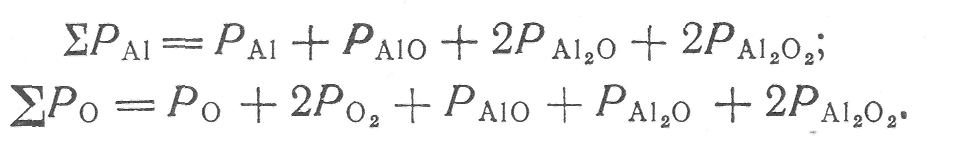 (6) (7)
(6) (7)
По стехиометрии глинозема
![]()
или
![]() (8)
(8)
Если парциальные давления соответствующих компонентов заменить константами равновесия К1, К2,К3, К4 К5 и РO, получим
![]()
![]()
![]()
![]() и
и
![]() (9)
(9)
Подставив эти величины в уравнение (8), получим следующее уравнение:
![]() . (10)
. (10)
В табл. 1 приведены значения парциальных давлений газообразных компонентов, полученные указанным способом; Суммарные давления компонентов
![]() (11)
(11)
в зависимости от температуры можно выразить в виде следующих уравнений:
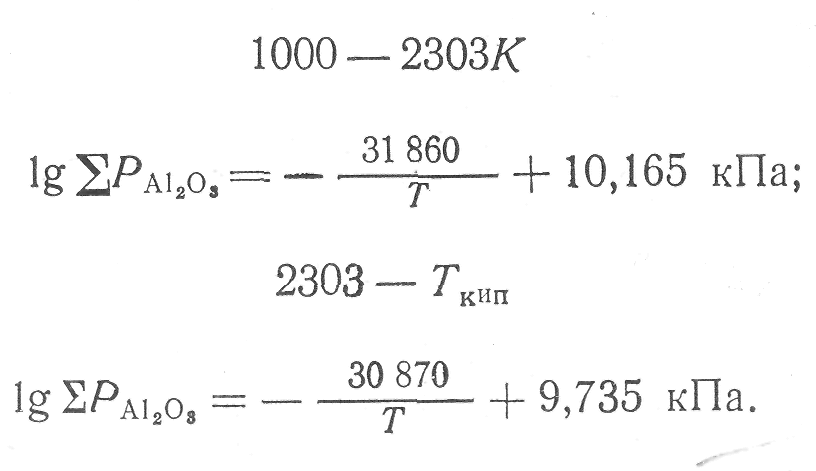 (12) (13)
(12) (13)
Парциальные давления алюминия в газообразной фазе над окисью алюминия на 5—12 порядков ни-же давлений насыщенного пара алюминия. Из этого следует, что диссоциация глинозема может иметь только газообразный характер.
Т а б л и ц а 1. Константы диссоциации и парциальные давления компонентов при диссоциации глинозема
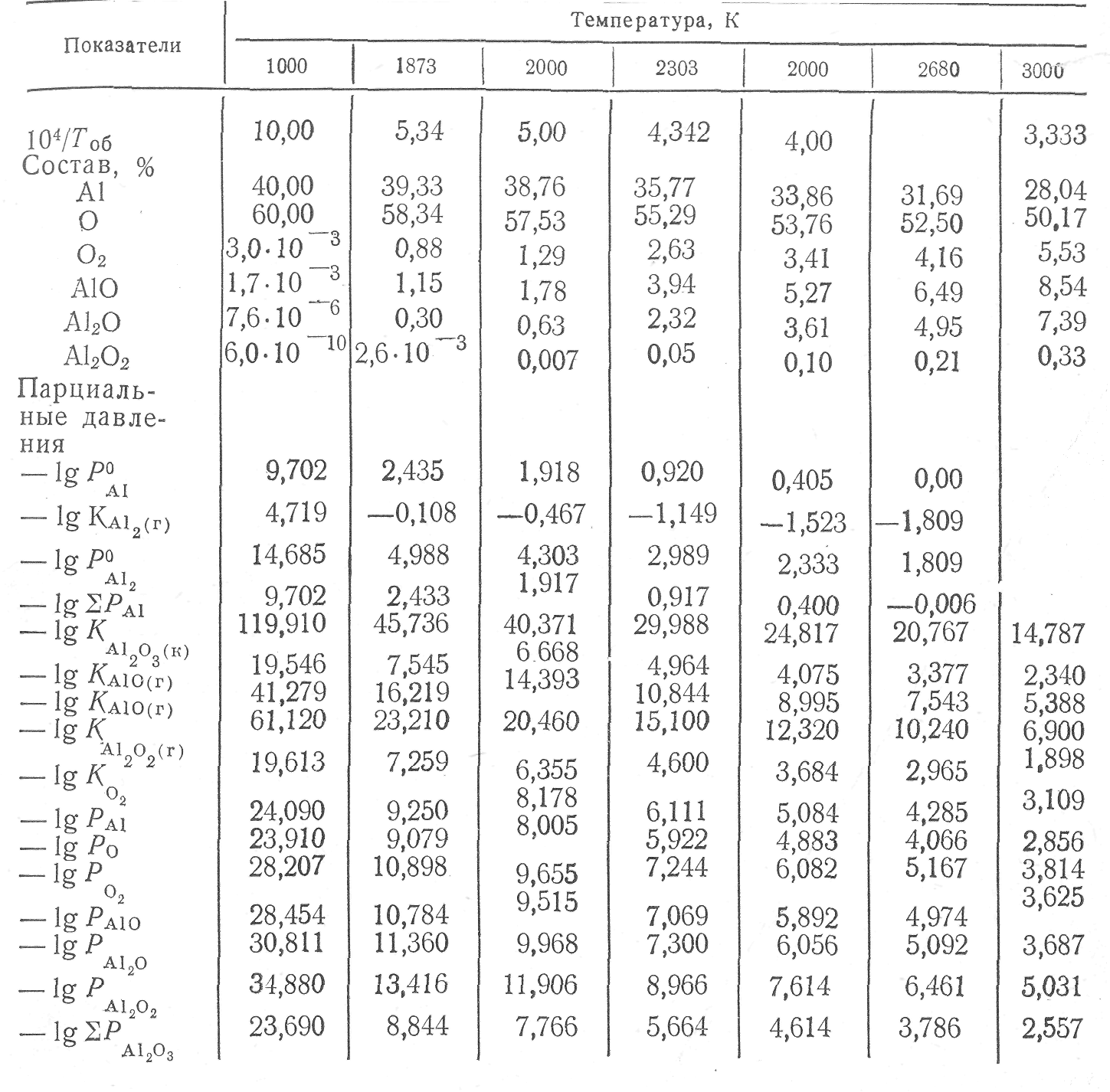
При диссоциации суммарное давление паровой фазы имеет минимальное значение (1,4-10-7 кПа), давление атомарного кислорода составляет 8,3-10-8 кПа, а молекулярного кислорода—1,25-10-9 кПа". В продуктах диссоциации основ-ными компонентами являются одноатомный кислород, алюминий и его пар, молекулярные компоненты АlO, А12О и А120з. Для температуры 1873 К содержание трех последних компонентов не превышает 2,5%, а при 3000 K — увеличивается до 20%. Из приведенных данных следует, что теория диссоциации химических соединений, разрабатываемая И. С. Қуликовым, более полно охватывает многообразие процессов диссоциации.
В металлургических процессах важную роль играют химические реакции, связанные с различными превращени-ями окислов, прочность которых определяется сродством соответствующих элементов к кислороду. Для того чтобы осуществить термическую диссоциацию таких окислов, как ҒеО, МпО, Sі02, при температурах 1500—1600° С, необходимо понизить давление кисло-рода до очень малых значений или повысить температуру до значитель-ных величин. Последнее невозможно осуществить в обычных металлургических агрегатах.
Чтобы получить для - FеО, МпО и SіО2 давление кислорода, равное 21,3 кПа, необходимо нагреть их соответственно до 3500, 4000 и 5000° С.
На величину реакций образования окислов оказывают влияние фазовые переходы и особенно переходы Ме и МеО в газообразное состояние.
Химические взаимодействия протекают как между твердыми веществами, так и между веществами, находящимися в растворах. Активности конденсированных веществ в ненасыщенных растворах зависят от концентрации веществ и не равны единице. Тогда упругость диссоциации окислов в ненасыщенных растворах можно определять, пользуясь формулой
![]() (15)
(15)
где Ро2/МеО/ и Ро2/МеО/ — соответственно упругость диссоциации окисла в растворе и в конденсированном состоянии; а и а/Ме/ — активности окисла и металла в ненасыщенных растворах.
Активности компонентов в растворах связаны с концентрациями соотношением
![]() (16)
(16)
где γi — коэффициент активности; Ні — концентрация, выраженная в мольных долях. С учетом соотношения (16) уравнение (17) записывается так:
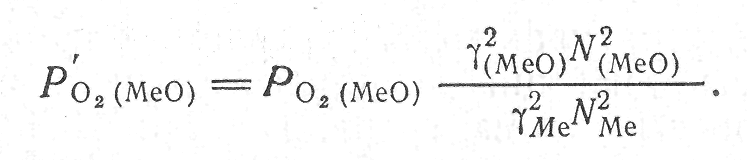 (17)
(17)
Из уравнения (17) следует, что с уменьшением в растворе концентрации диссоциирующего окисла МеО упругость диссоциации последнего снижается, а прочность возрастает. Когда уменьшается концентрация окисляющегося вещества, повышается упругость диссоциации окисла, что связано с понижением сродства металла к кислороду.
