
- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
Взаимодействие углерода с СО2 усиливается с повышением температуры: при 1300°С оно завершается через 2—З сек, тогда как при 900°С процесс не заканчивается и через 80 сек. Установлено, что наиболее реакционноспособным является древесный уголь, значительно медленнее реагирует с С02 антрацит. Кокс занимает промежуточное положение.
Взаимодействие углерода с его двуокисью, как и взаимодействие углерода с кислородом, связано с адсорбцией реагирующего газа углеродом.
При температурах 400°С и выше развиваеься химическая адсорбция, связанная с поглощением активными поверхностными атомами углерода молекул СО2. Дальнейшее повышение температуры характеризовается тем, что во взаимодействие вовлекалось увеличивающееся количество поверхностных атомов углерода, силовое поле которых приводило к растягиванию молекул СО2 и отрыву от них по одному атому кислорода. Такие процессы завершались образованием двух поверхностных соединений, названных кетенными комплексами:
![]()
Когда температура достигала 500—600°С, кетенные комплексы становились неустойчивыми и начинают распадаться с выделением молекул СО:
![]()
![]()
Повышение температур способствует увеличению количества распадающихся кетенных комплексов.
Процесс образования и разрушение кетенных комплексов развивается постепенно. С ростом температуры во взаимодействии участвует большее число комплексных соединений. Это приводит к разрушению кристаллической решетки, в результате чего новые атомы углерода начинают участвовать в образовании поверхностных комплексов.
Взаимодействие углерода с СО2 в зависимости от тормозящего звена может развиваться в диффузионной, промежуточной или кинетической областях. Для указанного процесса характерно перемещение реакционной зоны с поверхности в объем углеродистого материала, что связано с его пористостью и дополнительным разрыхлением поверхности.
Механизм реакции взаимодействия углерода с водяным паром изучен менее подробно, чем взаимодействие СО2 с твердым углеродом. Вместе с тем ряд экспериментальных данных указывает на аналогию между этими двумя процессами. Проведенными исследованиями в условиях вакуума установлено, что в результате взаимодействия водяного пара с углеродом в эквимолекулярных количествах образуются только СО и Н2. Таким образом, первичное взаимодействие углерода с водяным паром, когда продукты взаимодействия не вступают в последующую вторичную реакцию с углеродом, можно представить суммарным стехиометрическим уравнением
![]()
Реакция газификации углерода водяным паром развивается как реакция нулевого порядка. Подтверждением этому является независимость скорости процесса от давления водяных паров.
Механизм взаимодействия С + Н2О сходен с принятым для реакции С + СО2. На поверхности углерода молекулы водяного пара распадаются, образуя кетокомплексы и адсорбированные атомы водорода:
![]()
При дальнейшем ходе реакции кетокомплексы распадаются с выделением газообразной окиси углерода. Взаимодействие СО2 в зависимости от тормозящей стадии может развиваться как в диффузионной так и кинетической области. В диффузионной области скорость процесса характеризуется скоростью конвективной диффузии и может быть рассчитана по уравнению;
 (1)
(1)
где: К – константа скорости химической рекций, D – коэффициент диффузии, α – коэффициент скорости потока, n – порядок реакции, S – реакционная поверхность, СS – концентрация газа на поверхности, γ – размер частиц углеродистого материала. В кинетической области при минимальной скорости самой химической реакции скорость процесса определяется кинетическим уравнением:
![]() (2)
(2)
Влияние температуры в зависимости от температурной области описывается правилами Вант-Гоффа и Аррениуса.
Глоссарии
Восстановитель – это химический элемент, которое обладает повышенной химическим сродством к кислороду, по сравнению с тем оксидом, которое мы хотим восстановить. Восстановители могут быть кокс, полукокс, уголь, газообразные природные газы, активные металлы.
Окисление – процесс присоединения кислорода
Блиц – тест
|
|
|
|
|
А.
В. -lnC = Kτ + C0
С.
D. - E.
K =
|
|
|
|
|
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекции №6 «Основные теоретические положения о механизме восстановления металлов и твёрдых оксидов»
План лекции:
1. Кинетические особенности восстановления газом восстановителем и твёрдым углеродом.
2.Теоретические положения твёрдофазного восстановителя металлов углеродом.
3.Физико-химические особенности регенерации оксида углерода и диссоциации оксидов металлов.
4.Диссоционно – адсорбционный механизм восстановления металлов.
5.Электрофизические свойства твёрдых восстановителей и оксидов металлов. Кинетика слоевого восстановления газом.
6.Закономерности кинетики процессов. Влияние температуры и состава газа на скорость процессов.
7.Особенности восстановления металлов твердым углеродом в несмешивающихся и пространственно – разобщенных слоях.
8.Теоретические основы и возможности организации селективного восстановления металлов при использовании в качестве восстановителя твердого углерода.
Цель лекции
Ознакомление с основными положениями о механизме восстановления металлов и твердых сплавов
Дидактические единицы:
Процессы восстановления; диффузия; восстановительная рудная плавка; жидкие шлаки
1. Молекулы сложных химических соединений при нагревании распадаются на более простые молекулы или атомы. При нагревании химические соединения разлагаются, при охлаждении они снова. могут образовываться из продуктов их диссоциации.
Многие химические реакции протекают с участием твердых фаз, при этом процессы сосредоточиваются на границах фаз: твердое вещество — твердое вещество, твердое вещество — газовая фаза и сопровождаются перестройкой их кристаллических решёток. Такие химические реакции относятся к числу топохимдческих реакций, при которых в объеме фазы исходного вещества (материнская фаза) образуется новая твердая фаза конечного продукта. Так, если разлагается карбонат кальция СаСОз, то в его ромбэдрической кристаллической решетке возникает новая фаза—окись кальция СаО*. имеющая ионную кубическую решетку типа хлористого натрия.
Топохимические реакции состоят из двух стадий: образоваиия зародыша новои фазы и его роста. Первая стадия связана с преодолением определенного энергетического барьера и обычно протекает медленнее, чем вторая. Поэтому скорость топохимических реакций в большинстве случаев возрастает со временем (как и при автокаталитических процессах), достигает определенного значения и затем начинает уменьшаться.
К числу топохимических реакций, связанных с разложением твердых веществ и образованием более простых веществш соответствующих газов, относятся реакции диссоциации карбонатов, окислов, сульфидов, нитридов. Каждая из этих реакций может быть представлена уравнением
ТВ1 ↔ ТВ2 + Г
твердое вещество I = твердое вещество II + газ,
где твердое вещество I является карбонатом, окислом или сульфидом; твердое вещество II — соответственно окислом, металлом или низшим окислом; газ - двуокисью углерода, кислородом или па-рами серы. Равновесное давление газовой фазы в системе твердое вещество I - твердое вещество II - газ называется упругостью диссоциации соответствующего химического соединения.
При диссоциации химических соединений кинетическая энергия колебаний атомов или групп атомов превышает энергию химической связи. Поэтому изучение реакций диссоциации позволяет устанавливать критерии прочности химических соединений, уточнять условия их разложения и образования, сравнивать прочность различных соединений и на основе этого оценивать их поведение в металлургических процессах.
§ 2. Относительную прочность окислов металлов, карбонатов и других химических соединений можно определять как по изменению термодинамических потенциалов и ∆G°, так и по величине упругости диссоциации. Чем больше убыль свободной энергии и меньше упругость диссоциации химических соединений, тем выше его прочность. В упрощенном виде общее уравнение диссоциации металлических окислов можно записать в следующем виде:
2→ 2МеО ↔ 2Ме + О2
Если металлий окисел представляют собой конденсированные фазы (твердые или жидкие), которые не находятся в растворе, то константа равновесия реакции определяется из уравнения
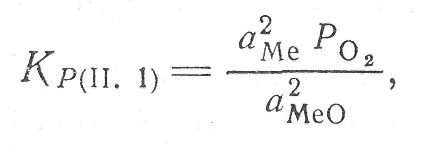 (1)
(1)
где аме и аМеО — активности металла и его окислы; Ро2 — равновесное давление кислорода в системе окисел — металл — кислород или упругость диссоциации окисла.
Если металл и окисел не образуют растворов, то
аМеО аМе ~ 1, а Кр = Ро2. Рассматриваемая система состоит из трех фаз: двух твердых (МеО и Ме) и одной газообразной О2. Пользуясь правилом фаз, определим число степеней свободы:
С = К – Ф + 2 = 3 + 2 = 1 (2)
В реакции (1) участвуют три вещества: окисел, металл и кислород, а независимых компонентов - два. Таким образом, при установившемся равновесии каждому давлению кислорода соответствует определенная температура, т. е. система имеет одну степень свободы.
На рис. 1 приведен график зависимости упругости диссоциации окислов от температуры. Кривая упругости диссоциации разбивает поле графика на две области. В области I парциальное давление кислорода в газовой фазе Ро2/ф больше упругости диссоциации окисла Ро2/МеО/.
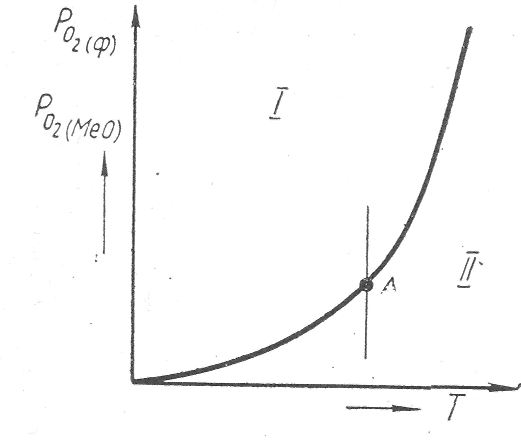
Рис. 1. Зависимость упругости диссоциации
окислов от температуры.
При этом условии окисел является устойчивым, а металл окисляется:
2→ 2Ме + О2 →2МеО
В области // упругость диссоциации окисла Ро2/МеО больше -парциального давления кислорода в газовой фазе Ро2/Ф, поэтому реакция идет в направлении
3→ 2МеО →2Ме + О2
В точке А Ро2/МеО = Ро2/ф и система находится в равновесии. Любая точка на кривой упругости диссоциации соответствует равновесному давлению кислорода, при котором согласно реакции диссоциации существуют два определенных окисла или окисел и металл. Точки вне кривой отвечают неравновесному давлению кислорода в системе и свидетельствуют о возможности превращений в определенном направлении, которое находится по знаку, стоящему перед DОг:
![]() (3)
(3)
где D— детерминант химической реакции, характеризующий ис-ходное состояние системы.
Для реакции диссоциации окисла уравнение (З) записывается в следующем виде:
![]() (4)
(4)
Если Ро2/ф
> Ро2/Ме
(область /), то
![]() имеет
положительные значения и прямая реакция
(реакция диссоциации окисла) невозможна.
Если же Ро2/ф
< Ро2/Ме
(область //), то
имеет
отрицательные значения и в этом случае
протекает прямая реакция.
имеет
положительные значения и прямая реакция
(реакция диссоциации окисла) невозможна.
Если же Ро2/ф
< Ро2/Ме
(область //), то
имеет
отрицательные значения и в этом случае
протекает прямая реакция.
При образовании растворов МеО и Ме переменной концентрации N уменьшается количество фаз, в результате чего увеличивается число степеней свободы:
![]() (5)
(5)
Таким образом, при взаимодействии веществ в растворах величина равновесного давления кислорода над диссоциирующим окислом зависит от температуры и концентрации раствора:
![]()
Упругость диссоциации окислов в большинстве случаев неизмеримо мала. Поэтому большая часть металлов в атмосфере воздуха окисляется. Металлы, кислородные соединения которых отличаются высокой упругостью диссоциации и трудно окисляются на воздухе или совсем не окисляются, относятся к благородным металлам (платина, золото), в отличие от неблагородных металлов, окислы которых обладают малой упругостью диссоциации.
Новые теоретические представления о процессах образования и диссоциации химических соединений разрабатывались И. С. Куликовым . Он показал, что термическая диссоциация может иметь две формы — конденсатную и газообразную. Такие особенности диссоциации зависят от свойств участвующих в процессе веществ.
