
- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
1 → Н2О + СО ↔ Н2 + СО2; ΔН = - 40 840 кДж (1)
Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
Т.К. 500 1000 1500 2000
ΔН , кДж - 40350 – 35170 – 29180 – 26700
При повышении температуры равновесие реакций водяного газа смещается в сторону образования исходных веществ (водяных паров и окиси углерода), понижение температуры сопровождается развитием экзотермической реакции и образованием дополнительного количества водорода и двуокиси углерода. Равновесный состав газовой фазы реакции водяного газа в соответствии с принципом Ле – Шателье не зависит от давления, так как объем исходных веществ и продуктов реакций не изменяется. Константа равновесия реакций 1 выражается уравнением
Кр= (2)
(2)
Вследствие небольшого теплого эффекта реакции 1 влияние температуры на величину Кр незначительно. Реакция водяного газа является однофазной и при трех компонентах К характеризуется четырьмя степенями свободы:
С=К+Ф+2=3-1+2=4. (3)
Конечный состав газовой фазы при равновесии реакции 1. определяется четырьмя независимыми переменными:
РСО
= ƒ(Т,РН![]() Р
Р![]() Р
Р![]() )
)
С. И. Филиппов на
основе обобщения имеющихся данных
рекомендует следующие уравнения для
расчета значений
![]() и lnКр
реакции водяного газа 1:
и lnКр
реакции водяного газа 1:
интервал температур 500—1200 К:
![]()
![]() (4)
(4)
![]() кДж
(5)
кДж
(5)
интервал температур 1300—1800 К
![]()
![]() (6)
(6)
![]() кДж
(7)
кДж
(7)
В константу равновесия реакции водяного газа входят четыре переменных Рн2о, РСО, Рсо2, Рнг. Вместе с тем для определения равновесного состава газа имеются только два уравнения:
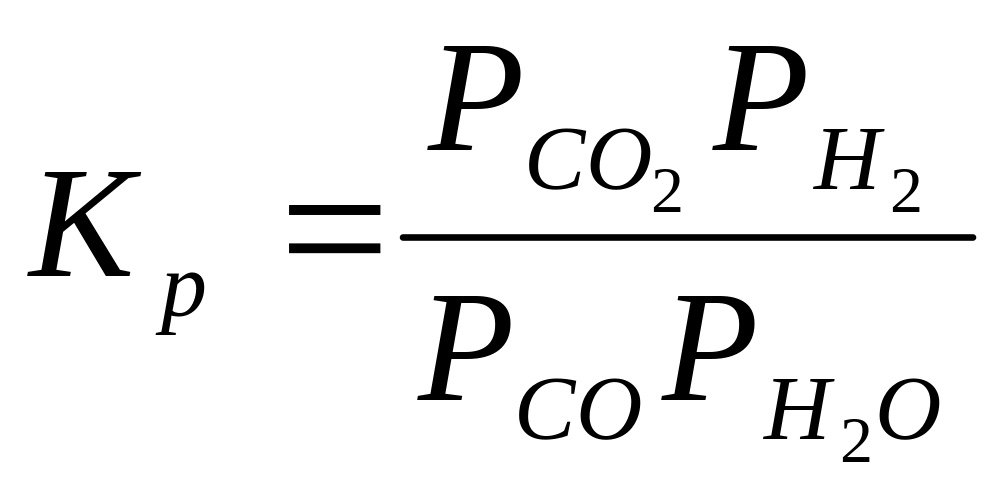
![]() (8)
(8)
В действительности каждой определенной температуре соответствует одно значение Кр и множество равновесных составов газовой фазы, которые подчиняются определенной закономерности.
Примем следующие обозначения отношений равновесных парциальных давлений:
![]()
 (9)
(9)
По величине этих отношений можно определить степень превращения СО в СО2 и Н2 в Н2О. Чем больше величина а, тем большее количество окиси углерода оставалось непрореагировавшим. Такая зависимость справедлива и для водорода: величина в характеризует число оставшихся молекул водорода на каждую молекулу водяного пара.
Введем в газовую смесь, состоящую из 50% окиси углерода и 50% водорода, количество кислорода, недостаточное для полного окисления СО и Н2. После установления равновесия газовая фаза будет содержать СО2, Н20, СО и Н2 в таких концентрациях, которые определяются термодинамикой реакции водяного газа.
Потребителями кислорода в изучаемой системе являются СО и Н2. При этом в зависимости от температуры преобладающая доля кислорода будет взаимодействовать с тем газом, у которого сродство к кислороду больше. Как указывалось ранее, при температурах ниже 1093 К сродство окиси углерода к кислороду больше, чем водорода. Из этого следует, что количество окиси углерода, превратившейся в СО2, превысит количество водорода, окислившегося в Н2О. Таким образом, равновесный состав газовой смеси будет определяться относительно малой величиной а и большей величиной в. Температуры выше 1093 К характерны тем, что водород обладает большим сродством к кислороду и а >в. При температуре 1093 К сродство водорода и окиси углерода к кислороду одинаковое и а =в.. Константу равновесия реакции 1 можно записать так:
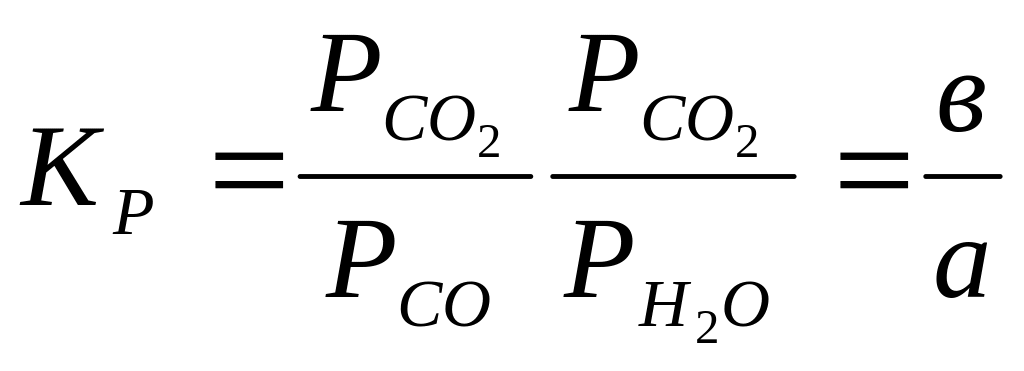 (10)
(10)
или
![]() (11)
(11)
Тогда
![]() (12)
(12)
Из уравнения следует, что зависимость между рассматриваемыми величинами описывается уравнением прямой, выходящей из начала координат, а константа К'р является тангенсом угла наклона к оси абсцисс.
Значения констант равновесия реакции водяного газа могут быть вычислены по равновесным концентрациям этих газов или по их парциальным давлениям. Величина констант равновесия не зависит от того, в каких единицах выражены концентрации и парциальные давления.
Термодинамические характеристики реакции водяного газа важны не только для анализа процессов горения. Ими пользуются при изучении окислительно-восстановительных процессов в газовых смесях СО—С02 и Н2—Н2О. Если в смесь, состоящую из 50% СО и 50% Н2, внести Fе2Оз, то при определенных температурах начнется процесс восстановления: температура ниже 1093 К — окись углерода произведет больший объем восстановительной работы и а<в; температура выше 1093 К — равновесие реакции удовлетворяет условию а >в, что свидетельствует о большем объеме восстановительной работы, выполненной водородом.
В смеси, состоящей из 50% СО2 и 50% Н2О, внесенное металлическое железо окисляется с переходом СО2 и Н2О в СО и Н2. В условиях низких температур (ниже 1093К) больший объем окислительной работы выполняет водяной пар, так как а <в, в условиях высоких температур (выше 1093 К)—углекислый газ (а>в),
Величины Кр
и ∆G![]() реакции водяного газа определяются
такими же величинами частных реакций
диссоциации СО2
и Н2О.
Сродство СО к кислороду больше, чем к
Н2,
и в газовой фазе повышается относительное
содержание водорода.
реакции водяного газа определяются
такими же величинами частных реакций
диссоциации СО2
и Н2О.
Сродство СО к кислороду больше, чем к
Н2,
и в газовой фазе повышается относительное
содержание водорода.
При 1093 К имеет место равенство химического сродства СО и Н2 к кислороду. Увеличение содержания СО в газовой фазе обусловлено более высоким химическим сродством водорода к кислороду. В газовой фазе, содержащей СО2 ,СО, О2 или Н2О, Н2, О2 изменением состава изменяются ее окислительно-восстановительные свойства.
Количественной мерой окислительных свойств газовой фазы может служить ее кислородный потенциал или величина упругости диссоциации СО2 и Н2О. Окислительные свойства газовой смеси возрастают с повышением содержания в ней СО2 и уменьшением содержания СО.
В реакции водяного газа кислород в газовой фазе появляется в результате диссоциации СО2 и Н2О. Наличие кислорода характеризует окислительно-восстановительные свойства многокомпонентной газовой смеси. Если константу равновесия реакции водяного газа 1 записать в виде соотношения
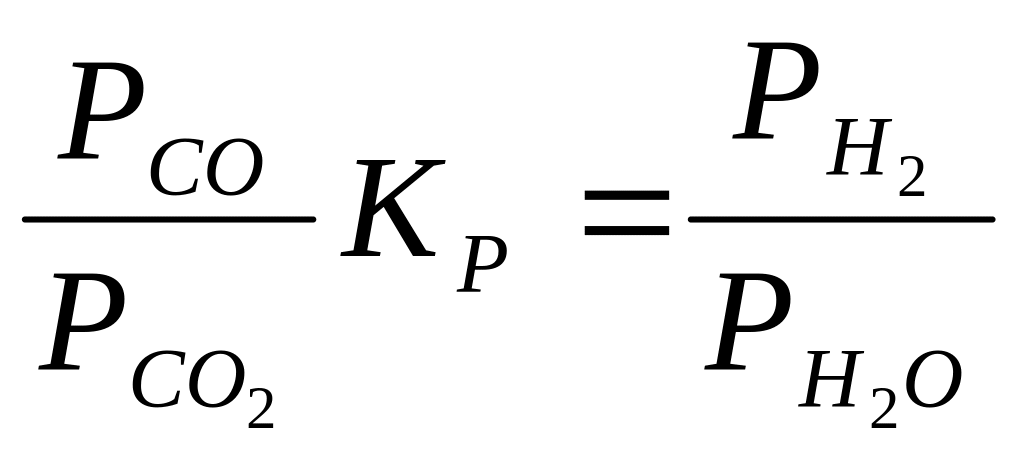
и подставить в него выражение константы равновесия реакции водяного пара,получим
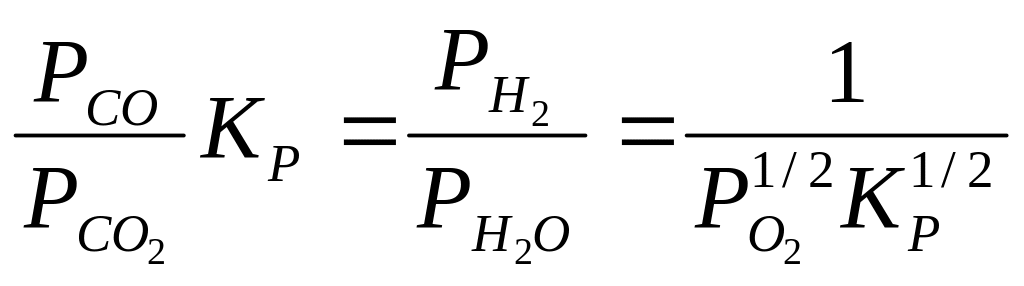
Каждое из
соотношений Рсо/Рсо2
и Р![]() /Р
/Р![]() характеризует в качественной форме
окислительные свойства сложной газовой
фазы, дает представление о влиянии
атмосферы по отношению к различным
металлам и их окислам и позволяет
подбирать составы безокислительных
или нейтральных газовых смесей.
характеризует в качественной форме
окислительные свойства сложной газовой
фазы, дает представление о влиянии
атмосферы по отношению к различным
металлам и их окислам и позволяет
подбирать составы безокислительных
или нейтральных газовых смесей.
§7. Природный газ, состоящий в основном из метана, используется в огромных количествах для энергетических целей, получения чистого водорода, в химии органического синтеза и в металлургии. При нагревании метан разлагается. Рассмотрим обратимую реакцию образования и разложения метана:
1→ С+2Н2 ↔СН4
Выражение константы равновесия и уравнение температурной зависимости константы равновесия реакции разложения метана могут быть записаны в следующем виде:
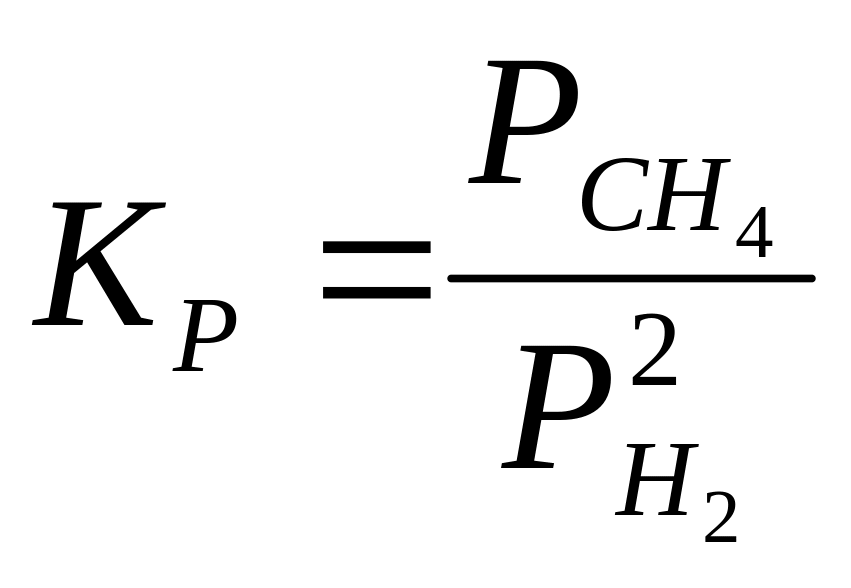 (1)
(1)
и
![]() (2)
(2)
Равновесный состав газовой смеси, образующейся при диссоциации метана (Р = 101,3 кПа), приведен в табл. 3, из которой видно, что заметное разложение метана начинается при 300 С, а при 1000°С метан может разлагаться практически полностью. Из приведенных данных также следует, что пониженные температуры благоприятны для образования метана из углерода и водорода. Реакция 1 протекает с изменением объема и равновесие ее зависит от давления. С увеличением давления развивается прямая реакция.
Таблица 3
Температура, 0С |
Состав смеси, об. % |
Температура, 0 С |
Состав смеси, об. % |
||
СН |
Н2 |
СН4 |
Н2 |
||
300 400 475 500 506 536 550 |
94,90 86,16 69,86 62,53 60,71 51,16 46,69 |
5,10 13,84 30,14 37,47 32,29 48,84 53,31 |
567 600 700 800 1000 1100 1150 |
41,26 31,68 11,07 4,41 0,50 0,20 0,10 |
58,74 68,32 88,93 95,59 99,50 99,80 99,90 |
При горении метана в окислитеяьной среде протекают следующие реакции:
2→ СН4 + 2О2 = СО2 + 2Н2О
3→ СН4 + О2 = СО + 2Н2
Экспериментальные данные показывают, что метан предрасположен не только к крекингу, но при определенных условиях и к конвертированию и реформированию. К конвертированию относятся реакции взаимодействия метана с водяными парами и углекислым газом:
4→СН4+ Н2О↔ СО + 3Н2
5→ СН4+ 2Н2О↔ СО2 + 4Н2
6→ СН4+ СО2↔ 2СО + 2Н2
При горении природного газа с недостатком воздуха происходит процесс реформировация газа, сопровождающийся изменением его состава и выделением частиц сажистого углерода. Последние значительно повышают светимость факела в мартеновских печах, отапливаемых реформированным природным газом, при этом ускоряется нагрев металла.
Для ряда технологических факторов целесообразно в качестве газа-восстановителя применять конвертированный газ, получаемый из метана — природного газа. Парогазовая смесь, включающая 50% природного газа и 50% водяного пара, при наличии никелевого катализатора нагревается до 1100°С. В этих условиях происходит реакция 2, в результате которой образуется газ-восстановитель, состоящий из 74—75% водорода, 22—23% окиси углерода и незначительного количества углекислого газа и паров воды. Значения логарифмов констант равновесия реакций диссоциации и конвертирования метана даны в табл.4.
Таблица 4
Т, К |
СН4↔С+2Н2 |
СН4+СО2↔2СО+2Н2 |
СН4+Н2О↔СО+3Н2 |
СН4+2Н2О↔СО+4Н2 |
298,26 500 800 1000 1300 1500 2000 2500 3000 |
-8,899 -3,428 -0,167 1,009 2,104 2,579 3,403 3,886 4,207 |
-29,920 -12,219 -2,151 1,246 4,381 5,765 7,985 9,281 10,120 |
-24,920 -10,082 -1,525 1,401 4,134 5,350 7,322 8,488 9,150 |
-19,904 -7,944 -0,900 1,557 3,886 4,936 6,659 7,694 8,380 |
Вычислим по приведенным термодинамическим потенциалам константу равновесия реакции конвертирования метана водяным паром при 1000К, используя уравнение (2).
СН4+ Н2О↔ СО + 3Н2
Из работы выпишем
необходимые значения
![]() и
и
![]() для 1000К. При вычислении суммарной реакции
Л величины функций для водорода умножаются
на три, так как в результате реакции
образуется три моля водорода:
для 1000К. При вычислении суммарной реакции
Л величины функций для водорода умножаются
на три, так как в результате реакции
образуется три моля водорода:
СН4 Н2О СО Н2 ∆
![]() Дж/(моль/град) -199,313 -196,744 -204,074 -136,963
-218,911
Дж/(моль/град) -199,313 -196,744 -204,074 -136,963
-218,911
Н![]() кДж/моль -66,965 -238,906 -113,880
0 -191,991
кДж/моль -66,965 -238,906 -113,880
0 -191,991
Определим значения
∆![]() и ∆
и ∆![]()
∆
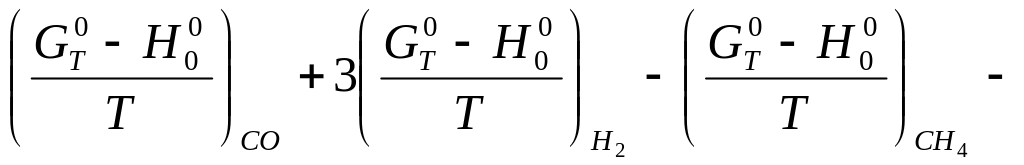

-204079-3∙136963+199313+196744= -218911 кДж
![]()
Значения константы равновесия реакции 4 находятся по уравнению:
![]()
Так же вычислим константу равновесия для реакции конверсии метана углекислым газом при 1273 К.
СН4+ СО2↔ 2СО + 2Н2
В работе приводятся
значения
![]() —
—![]() /Т
для
веществ, участвующих
в реакции при Т
= 1000 и
1500 К. Требуется рассчитать константу
равновесия при 1273 К. Соответствующие
значения находятся интерполяцией:
/Т
для
веществ, участвующих
в реакции при Т
= 1000 и
1500 К. Требуется рассчитать константу
равновесия при 1273 К. Соответствующие
значения находятся интерполяцией:
СН4 СО2 СО Н2 ∆
G![]() Дж/(моль*град)
-211,123 -235,990 -210,939 -143,483 -261,731
Дж/(моль*град)
-211,123 -235,990 -210,939 -143,483 -261,731
Н ,кДж/моль -66,965 -393,229 -113,880 0
Oпределим значения — /Т ,
∆


=2∙210,939-2∙1,43483+211,123+235,990=-261,731 Дж/(моль∙град)
![]()
![]()
По уравнению вычислим:
![]()
Результаты сопоставления расчетных величин констант равновесия реакций конверсии метана водяным паром и углекислым газом с данными табл. 2 показывают, что они совпадают.
Глоссарии
Горения – понимают реакции взаимодействия веществ с кислородом, источником которым чаще всего служит атмосферный воздух.
Диссоциация – распад сложных веществ на более простые.
Блиц – тест
Каков физический смысл универсальной газовой постоянной? Универсальная газовая постоянная равна работе…
Совершаемой 1 молем идеального газа при нагревании на 10
Совершаемой 1 г идеального газа при нагревании на 10
Совершаемой 1 молем идеального газа при нагревании
Совершаемой идеальным газом
Совершаемой идеальным газом при стандартных условиях
Какова связь константы равновесия с химическим сродством ?
ΔGo = –RT(ln Kp – ln ΔPнеравн)
ΔGo = –RT ln Kp
ΔGo = RT ln Kp
ΔGo = –RT ln KC
ΔGo = RT ln KC
Какое из уравнений является завиcимостью теплоемкости от температуры для металлов, находящихся в твердом состоянии вплоть до температуры плавления
Сж = соnst
С = а0 + а1 Т
С = а Т3
С = а0 + а1 Т+ а2Т2 – Т-2
Cг = соnst
Найди среди приведенных выражений уравнение Аррениуса
А. ln К =
![]()
В. К =
С. ln K =
![]() +lnВ
+lnВ
D. K = +В
E. ln K = +В
Какая закономерность определяет влияние температуры на скорость в области низких температур:
 =
2 + 4
=
2 + 4 =
1,5 + 3
=
1,5 + 3 =
1 + 4
=
1 + 4= ln
= 4-6
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
Лекции №4 «Химическая прочность структур, соединений дефектность кристаллических структур»
План лекции
1.Диаграммы состояния металлургических систем.
2.Кинетика и механизм процессов образования и диссоциации соединений. 3.Закономерности образования зародышей.
Цель лекции
Ознакомление с химической прочностью и дефектами кристаллических структур
Дидактические единицы:
Диссоциация химических соединений; горение углерода
1. Тепловые эффекты гетерогенных реакций горения зависит от кристаллического строения твердого углерода. Из его двух известных в природе модификаций, алмаза и графита, для процессов горения практический интерес представляет вторая.
Так называемый «аморфный» углерод, встречающийся в разновидностях твердого топлива, в действительности состоит из мелкодисперсных кристалликов, имеющих решетку графита. Эти формы углерода, при прочих равных условиях, различаются значениями энтальпии. При повышении температуры
Сал→ Сгр ∆Н=-15250 кДж/м.
ΔН![]() кДж/моль
кДж/моль
У крупно – кристаллического графита она меньше, чем у аморфного углерода, и последний сгорает с большим выделением тепла, чем графит.
Теплоты сгорания углерода каменноугольного кокса лежат м/у указанными тепловыми эффектами, т.к. кокс содержит и мелкодисперсные и сравнительно крупные кристаллы графита.
Поэтому нужно учитывать форму углерода, который претерпевает превращения в том или ином процессе.
2. При взаимодействии твердого углерода с газообразными окислителями, а именно с кислородом и водяным паром возможно одновременное протекания следующих пар реакций:
Неполное горение:
1.
![]()
![]() Кдж
Кдж
ΔG![]() = –221120–180Т Дж/моль
(1)
= –221120–180Т Дж/моль
(1)
Полное горение:
2. С + О2 = СО2
![]() Кдж
Кдж
ΔG = –393260 – 2,3Т Дж/моль (2)
Обе реакции наблюдается при сжигании твердого топлива.
Газификация углерода
3.
2С + 2Н2О
= 2СО + 2Н2
![]() Кдж
Кдж
паром образование до СО:
ΔG = 271080-288Т Дж/моль (3)
Газификация до СО2:
4. С + 2Н2О
= СО2 + 2Н2
![]() Кдж
Кдж
ΔG = 98960-1106Т Дж/моль (4)
Экспериментальные данные ΔG при Т = 0, 1000, 2000оС даны в таблице:
Реакция |
Температура |
||
0 |
1000 |
2000 |
|
1 |
-221120 |
-401120 |
-581120 |
2 |
-393260 |
-395560 |
-397860 |
3 |
271080 |
-16920 |
-304920 |
4 |
98960 |
-11640 |
-122240 |
Из анализа данных нормального сродства для реакции 1 и 2 следует, что они необратимы, т.е. идут практически до полного сгорания углерода в левой части равенства, так как реакции 1 и 2 имеют малую термодинамическую вероятность протекания в обратном направлении и во всем температурном интервале ΔG имеет отрицательные значения. Реакции 3 и 4 термодинамически вероятны как в прямом так и в обратном направлении. Это связано с различием знаков ΔН. В реакциях со свободным кислородом ΔН отрицательны (реакции горения), а в реакциях с водяным паром положительны. Вместе с тем изменение энтропии ΔS в реакциях 1, 3, 4 идущих с увеличением числа газовых молей положительно, а в реакции 2- слабо положительно. При сравнении реакций 3 и 4 видно, что до температуры пересечение более вероятно образования СО2 (2), а после пересечения – образование СО (1). Для реакций 6 и 7 зависимость аналогичная.
Характер изменения ΔG от температуры предопределяют температурные области преимущественного содержания в газовой фазе СО и СО2 в присутствии твердого углерода.
3. Что бы определить количественный состав и свойства газовой фазы в присутствии углерода удобно использовать суммарные реакции 1-2 и 3-4.
При алгебраическом суммировании с сокращением свободного кислорода получается реакция
1 → 2С + О2 = 2СО
2 → С + О2= СО2
5 → Ссг + СО2 2СО
![]() Кдж или 41,1 ккал
Кдж или 41,1 ккал
Реакция газификации углерода газом СО2 идет с поглощением тепла. Этот процесс развивается при горении углерода в слое и играет большую роль в шахтных печах. Обратный процесс экзотермический, где окись углерода разлагается с выделением сажистого углерода, наблюдаемых в восстановительных металлургических процессах.
При суммировании с сокращением углерода
1 → 2С + О2 = 2СО
2 → 2С + 2О2 = 2СО2
6 → 2СО + О2 = 2СО2
реакция догорания СО и
3 → 2С + 2Н2О = 2СО + 2Н2
4 → 2С + 4Н2О = 2СО2 + 2· 2Н2
7 → 2СО + 2Н2О = 2СО2 + 2Н2
или 8 → Н2 +СО2 = Н2О + СО (II) – реакция водяного газа.
Наиболее важным соотношением в газовой фазе с присутствиям углерода является отношения РСО / РСО2 определяемое реакцией газификации углерода 5.
Его можно определить из диаграмм равновесия этой реакции в координатах : состав газовой фазы СО - СО2 – температуры (РСО / РСО2 - параметр)
Резкое изменение равновесного состава газовой фазы от СО2 к СО происходит в интервале температур 500-900оС. При повышении давления в газовой фазе увеличивается содержание СО2 , а при понижении давления – увеличивается содержание СО.
Реакция газификации углерода 5 имеют большое значение в доменном процессе и генераторным. Как видно она протекают слева направо с поглощением тепла и увеличением объема. При повышении температуры в равновесной газовой смеси увеличивается концентрация СО , а при повышении давления – концентрация СО2.
Система является двухкомпонентной и двухфазной. Поэтому С = К – Ф + 2 = 2 –2 + 2 = 2 , следовательно равновесные концентрации СО и СО2 определяются двумя параметрами – температурой и давлениям. Равновесные условия этой реакции изучались в интервале температур 404-904оС при трех давлениях как со стороны СО2 (СО2 + С → 2СО), обратной так и со стороны
СО (2СО → СО2 + С) – прямой
В таблице приведены равновесный состав газовой фазы и значения Кр.
Т, Со |
Давления кПа |
Характеристика равновесия при достижении со стороны |
||||||||||
СО2 |
СО |
|||||||||||
Состав газов. фазы , % |
|
Состав газов. фазы , % |
|
|||||||||
СО |
СО2 |
СО |
СО2 |
|||||||||
404 |
50,65 110,42 172,21 |
1,60 1,10 0,90 |
98,4 98,9 99,10 |
0,13∙10-3 0,133∙10-3 0,6∙10-2 |
1,70 1,20 0,90 |
98,30 98,80 99,10 |
0,147∙10-3 0,158∙10-3 0,139∙10-3 |
|||||
504 |
50,65 110,42 172,21 |
10,40 7,30 5,85 |
89,60 89,60 94,15 |
0,139∙10-3 0,626∙10-2 0,60∙10-2 |
10,50 7,25 6,0 |
89,50 92,75 94,0 |
0,61∙10-2 0,61∙10-2 0,65∙10-2 |
|||||
667 |
50,65 110,42 172,21 |
62,20 49,55 42,05 |
37,80 50,45 57,95 |
0,511 0,530 0,518 |
62,25 49,50 42,30 |
37,75 50,50 57,70 |
0,513 0,529 0,527 |
|||||
904 |
50,65 110,42 172,21 |
98,65 97,10 95,70 |
1,35 2,90 4,30 |
36,044 35,438 36,208 |
98,55 97,15 95,80 |
1,45 2,85 4,20 |
36,044 36,097 37,147 |
|||||
Константа равновесия рассчитывалась по уравнению:
Кр =
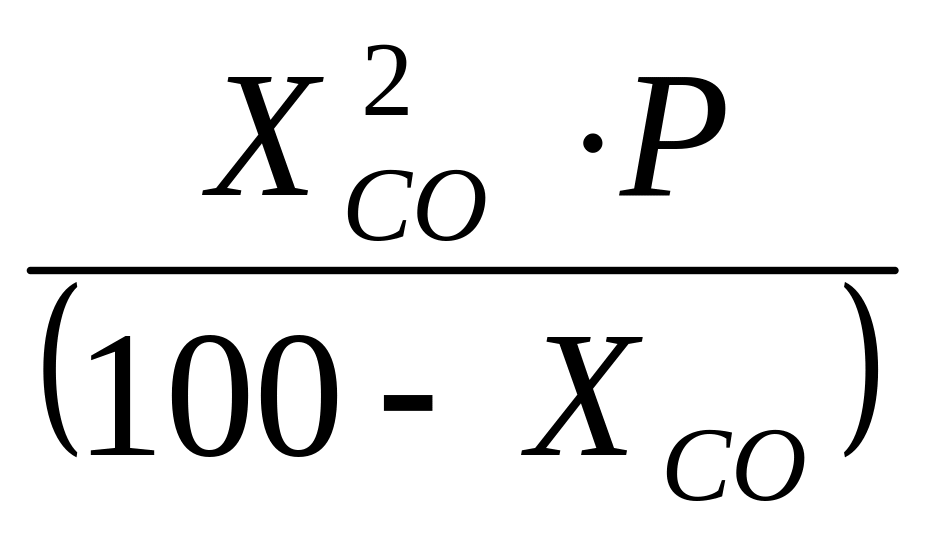 (5)
(5)
где Р – общее давления
ХСО – содержание СО при равновесии
Катализаторами реакции распада СО являются при низкой температуре железо, кобальт, никель, хром, алюминий, титан. Распад в ДП идет плохо.
Термодинамические характеристики состава и свойств газовой фазы можно определить величиной химического потенциала компонента μi измеренной относительно стандартные состояния μiо. Разность химических потенциалов кислорода (О2) в стандартном состоянии при Р = 101,3 кПа и при любом другом давлении (РО ) называется кислородным потенциалом
П =Δμ = RTmPO2 (6)
При изотермическом переходе одного моля кислорода от Р = 101,3 кПа до РО кислородный потенциал газовой фазы П0 (г.ф.) равен стандартному изменению изобарного потенциала :
П0 = ΔG (7)
Для реакции 5 кислородный потенциал можно получить через давление кислороды или через отношение РСО2 / РСО
КР/3 =
 (8)
(8)
логарифмируем это уравнение и умножаем на RT.
На основании этого уравнения можно построить график температурной зависимости кислородного потенциала для газовых смесей различного состава.
Глоссарии
Диссоциация химических соединении – это распад сложных веществ, с образованием простых компонентов
Горение углерода – это процесс окисления углерода кислородом воздуха.
Блиц – тест
|
|
|
|
|
|
|
|
|
|
