
- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
Z = Ae-ΔG/RT (2)
где
![]()
![]()
Z— число зародышей, возникающих в единицу времени в 1 см3 металла; п/ — число частиц на поверхности зародыша критического размера; V — объем, приходящийся на один атом исходной фазы; п — число атомов в единице объема исходной фазы; X и h — постоянные Больцмана и Планка; М -молекулярная масса вещества; р — плотность вещества; σм.в— межфазное натяжение на границе металл — включение; R — газовая постоянная; ΔG — изменение термодинамического потенциала при образовании зародыша новой фазы.
Критический радиус зародыша, способного к дальнейшему росту, определяется из уравнения Гиббса — Томсона:
![]() (3)
(3)
где С'/С — степень пересыщения раствора.
По уравнениям (1) и (2) рассчитаны интенсивность (I) образования зародышей и критический радиус неметаллических включений различного состава, образующихся в стали при 1600°С и степенях пересыщения 1,5; 3,5; 10. Для неметаллических включений, состоящих из FеО и МnО (при ам.в=180 мДж/м2 и С'/С=1,5), rкрит — 1,6• 10~9 м и I —1028. При этом интенсивность образования зародышей настолько большая (порядок 1028), что такое их
количество не может разместиться в 1 см3 металла. Это означает, что FеО и МnО могут самопроизвольно выделяться из металла при значительно меньших пересыщениях. В процессе охлаждения недостаточно раскисленной стали не исключена возможность образования в ней мельчайших частиц FеО и МnО. Разность плотностей этих включений и металла Δр =1 кг/м3, поэтому они медленно всплывают.
Если составляющей оксидной фазы неметаллических включений является система FеО—МnО—SiO2, то при содержании SіО2 = 25% межфазное натяжение возрастает до 500 мДж/м2, критические размеры включений существенно увеличиваются, а интенсивность их образования I значительно снижается. Включения системы FеО— МnО—SіО2 для которых σм.в=700 мДж/м2, выделяются лишь при десятикратном пересыщении. Включения системы SіО2—А12О3—СаО, для которых ам.в=1000 мДж/м2, не могут зарождаться даже при десятикратном пересыщении.
Зарождение неметаллических включений в объеме металла затрудняется с повышением значений межфазной поверхностной энергии на границе металл—включение. Поэтому образование твердых включений окислов при раскислении сильными раскислителями (А1, Ті, Zr) может происходить лишь в результате значительного пересыщения.
По времени образования различают первичные, вторичные и третичные неметаллические включения. Первичные включения образуются сразу после ввода раскислителей в печь или в ковш, вторичные — в процессе охлаждения раскисляемого металла до температуры ликвидуса и третичные — в ходе охлаждения в двухфазной области (между линиями ликвидуса и солидуса).
В связи с трудностью проведения экспериментов влияние расхода раскислителей на образование первичных, вторичных и третичных неметаллических включений оценивали путем термодинамических расчетов для содержаний углерода в металле 0,10; 0,30; 0,5%. Активность кислорода перед раскислением ао для каждого значения концентраций [С] принимали по данным проведенных измерений э. д. с.
Сущность термодинамических расчетов состояла в следующем. По уравнениям:
![]() (4)
(4)
![]() (5)
(5)
рассчитывалась активность кислорода в металле после его раскисления.
Количество первичных, вторичных и третичных включений (соответственно индексы I, II, III вверху) І-SіО2 и А12О3 определялось по разностям активностей кислорода:
![]()
![]()
![]()
где индексами «р», «л» и «с» обозначена равновесная с данным количеством раскислителя активность кислорода в металле при температуре соответственно раскисления, ликвидуса и солидуса.
На опытных плавках железа Армко (в печи сопротивления с графитовым нагревателем) активность кислорода резко снижается в течение первой минуты после присадки раскислителей (Sі, А1).
Таблица 2. Последовательность ввода раскислителей и варианты
раскисления опытных плавок
Вариант раскисления |
Последовательность ввода раскислителя |
Расход раскислителей, кг/т |
|
Al |
Ti |
||
А Б Г1 Г2 Д1 Е1 Е2 |
Al+(KМБаК+FeMn) Al+(KМБаК+FeMn)+Ti (SiMn+FeSi)+Al (SiMn+FeSi)+Al+Ti Al+(SiMn+FeSi)+Ti KМБаКT Al+ KМБаКT |
от 0,25 до 0,70 0,45 0,45 1,00 1,35 0,45 0,10 |
0,30 0,15-0,30
0,30 0,30 |
Это свидетельствует о быстром завершении химического взаимодействия раскислителей и растворенного в металле кислорода. Однако образовавшиеся окисные включения удаляются сравнительно медленно.
На основании термодинамических расчетов сделано заключение, что образование вторичных и третичных неметаллических включений можно в значительной степени предотвратить, увеличив содержание элементов-раскислителей в стали (в пределах, допускаемых стандартами) и обеспечив защиту струи металла от вторичного окисления при разливке. Показано также, что порядок введения раскислителей в печь не сказывается на глубине раскисления стали и слабо влияет на удаление из металла оксидных включений — продуктов раскисления. Остаточное содержание кислорода в металле, раскисленном в печи и в ковше и только в ковше, примерно одинаково.
Результаты применения комплексного сплава КМБаК (с барием) для раскисления спокойной стали, разливаемой на машинах непрерывного литья заготовок, представлены для сплава со следующим. Химический составом: 48—54% Sі; 16—20% Мn; 6—12% Ва; 6—10% Са; 1,5—2,5% А1 и 8—13% Fе. Были исследованы также варианты раскисления стали с применением силикомарганца, ферросилиция, алюминия, титана. С целью более эффективного использования модифицирующего действия кальция и бария алюминий вводился раньше остальных раскислителей. Сплав KМБаК расходовали в количестве 5,8—5,0 кг/т стали. Титан присаживали в виде отходов, содержащих 98% Ті, после ввода раскислителей.
На основании результатов исследований были разработаны новые комплексные кремнекальцебариевые сплавы, содержащие алюминий и титан. При раскислении стали сплавом КМБаКАТ и присадке алюминия лишь 0,1 кг/т стали обеспечивалась удовлетворительная разливаемость стали, высокий уровень меха-нических свойств и удовлетворительное качество поверхности листа.
Для получения мелкозернистой стали широко применяется алюминий. В зависимости от содержания углерода в стали присадки алюминия могут составлять 0,06—0,12%. Из других элементов, способствующих получению мелкозернистой структуры, следует отметить ванадий. При его введении в сталь получается более однородное зерно, чем при раскислении стали алюминием.
Имеются данные, свидетельствующие о тормозящем действии выделений нитридов алюминия на рост зерна в углеродистой (0,2% С) и никелевой стали (3,5% Ni). Температура роста зерна с увеличением содержания [А1] для никелевой стали примерно на 70—90° С выше, чем для углеродистой.
Вредные элементы, содержащиеся в стали, способствуют возникновению неметаллических включений — сульфидов, нитридов, оксидов. Самая многочисленная группа неметаллических включений — оксиды. Значительную часть оксидных включений составляют SiO2 и Аl2О3, а также их производные — силикаты и алюминаты. Большинство неметаллических включений являются комплексными образованиями — алюмосиликатами, оксисульфидами, отнести их к определенной группе включений затруднительно.
По происхождению неметаллические включения делятся на две группы: эндогенные, т.е. выделяющиеся из расплава при кристаллизации и возникающие в процессе раскисления стали; экзогенные (внешнего происхождения), образующиеся в результате контакта жидкого металла с огнеупорной кладкой (наваркой) мартеновской печи, кислородного конвертера, сталеплавильного желоба, футеровкой сталеразливочного ковша.
На неметаллические включения в жидкой стали действуют выталкивающие силы, равные массе вытесненного ими металла. Для сферических включений в соответствии с законом Архимеда эта сила определяется из уравнения
![]() (6)
(6)
Включения, всплывающие под действием выталкивающей силы F, испытывают сопротивление стали
![]() (7)
(7)
где η— вязкость стали; V — скорость перемещения включения относительно стали.
При условии равенства выталкивающих и тормозящих сил правые части уравнений (1) и (2) можно приравнять и после соответствующих преобразований получить значения величины скорости всплывания включений
![]() (8)
(8)
Формула (3) известна как формула Стокса. Она применима для условий ламинарного движения, которое наблюдается при малых значениях критерия Рейнольдса, и для малых частиц неметаллических включений (до 100 мк):
![]()
Для расчета скорости всплывания жидких включений следует пользоваться формулой Рыбчинского—Адамара:
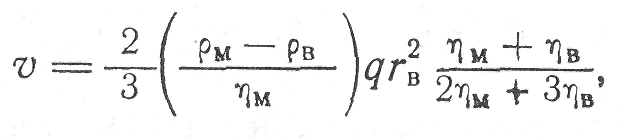 (9)
(9)
где гв -— радиус включений: рм>. pв, ηв, ηm — плотность и вязкость металла и включений соответственно. При наличии поверхностно-активных веществ скорость всплывания жидких капель может изменяться и вследствие эффекта торможения быть меньше рассчитанной по формуле Стокса.
Тормозящее влияние поверхностно-активных веществ может быть определено по уточненной формуле Стокса с учетом поверхностной вязкости:
 (10)
(10)
где ηn— коэффициент поверхностной вязкости, пропорциональный количеству адсорбированного вещества и изменению поверхностного натяжения в результате адсорбции; р, η, р1, η1 — соответственно плотность и вязкость жидкой среды и капли.
Укрупнение неметаллических включений может происходить двумя путями:
- Слиянием нескольких отдельных образований в одно более крупное с исчезновением разделяющих поверхностей. Этот процесс называется коалесценцией и происходит при укрупнении в металле жидких включений и газовых пузырьков;
- Срастанием, спеканием или слипанием отдельных мелких образований, при которых разделяющие их поверхности не исчезают полностью. Такой процесс называется коагуляцией и протекает при двух или большем количестве твердых включений, а также при встрече капель малорастворимых жидкостей. К гетерофазной коагуляции относятся прилипание твердых или жидких включений к поверхности газовых пузырей, смачивание твердых включений каплями жидкости.
Движущей силой процесса укрупнения взвешенных в металле твердых, жидких или газообразных включений является изменение свободной энергии системы. Математическое выражение энергетического баланса слияния капель неметаллических включений имеет вид
ΔG = σм.в.·ΔW < 0 (11)
σм.в ·Wм.в./ > σм.в ·Wм.в.// (12)
где Wм.в./ и Wм.в./ — контактные поверхность металл — включение до и после слияния капель.
Коалесценция газовых пузырьков протекает при условии
σм.г ·Wм.г./ > σм.г ·Wм.г.// (13)
где Wм.г./ — межфазная поверхностная энергия на границе металл— газ; σм.г и Wм.г.// — контактные поверхности до и после слияния пузырьков. Неравенство в уравнениях (7) и (8) обеспечивается, так как W/ больше W ".
Коагуляция твердых включений возможна при условии
![]()
где Wм.в./ — часть всей поверхности включений, на которой происходит их контакт при встрече; σВ.В Wм.в./ — удельная поверхностная энергия на границе укрупняющихся включений.
Процессы укрупнения неметаллических включений связаны с температурой жидкой стали. С повышением температуры процессы укрупнения обычно ускоряются. Это обусловлено изменением динамической вязкости жидкого металла физических свойств самих включений.
§3. Диффузионное раскисление стали состоит в том, что раскисляющие вещества (молотый коксик, ферросилиций, силикокальций) вводятся на поверхность шлака. Плотность раскисляющих веществ такова, что часть из них находится на поверхности шлака, а часть—погружается в шлак, в котором происходит восстановление FеО по реакциям
FeO + C = Fe + CO;
2FeO + Si = SiO2 + 2Fe
FeO + Ca = CaO + Fe
Минимально возможное остаточное содержание кислорода после диффузионного раскисления определяется из уравнения закона распределения
[%O]
=
![]() (1)
(1)
где [%0] — остаточное содержание кислорода в металле; (%-FеО) —содержание закиси железа в шлаке после завершения процесса его раскисления; Lо — коэффициент распределения кислорода между шлаком и металлом.
Из уравнения (1) следует, что степень диффузионного раскисления при заданной температуре зависит от концентрации закиси железа в шлаке. В дуговых электропечах низкое содержание FеО (<0,5%) в шлаке наблюдается в восстановительный период. В мартеновском процессе при диффузионном раскислении шлака содержание FеО редко снижается ниже 2—3%, при этом ванна продолжительное время не кипит, в результате чего повышается содержание водорода в металле.
Преимущество диффузионного раскисления стали перед осаждающим состоит в том, что в первом случае продукты раскисления не остаются в металле. Вместе с тем на диффузионное раскисление расходуется большое количество раскисляющих шлак веществ и требуется значительное время. Диффузионное раскисление осуществляется только при плавке стали в дуговых электропечах. Для уменьшения продолжительности восстановительного периода проводится предварительное осадочное раскисление.
По ходу восстановительного периода в шлаке понижается содержание не только FеО, но и МnО и Сr2О3. В зонах наиболее высоких температур под электрическими дугами происходит восстановление окиси кальция:
4. (CaO) + 3C(тв) = (СаС2) + {CO}
В белом шлаке электроплавки концентрация карбида кальция СаС2 не превышает 0,5%. С увеличением количества молотого кокса, расходуемого для раскисления шлака, содержание СаС2 в шлаке возрастает до 1,5—2% и такой шлак относится к карбидному.
Одновременно с понижением содержания FеО в шлаке при диффузионном раскислении постепенно уменьшается концентрация кислорода в стали. Так, при наличии в шлаке 0,5% FеО, температуре 1600°С, основности шлака (%СаО)/(%Sі02), равной двум, коэффициент распределения кислорода между шлаком и металлом составляет 166, а равновесная концентрация кислорода в металле [%О] =0,003%. Фактическая концентрация кислорода в металле близка к равновесной. Во время выпуска, разливки и затвердевания концентрация кислорода в стали повышается в результате взаимодействия струи стали с кислородом, а также вследствие ликвационных явлений, происходящих при затвердевании металла.
Опыт работы металлургических заводов и специально проведенные исследования показали, что при диффузионном раскислении равновесие металла и шлака практически не достигается, так как контактные поверхности двух смежных фаз незначительны: 1,5; 0,8; 0,4 м2/т стали соответственно для 5-, 10- и 30- тонных дуговых печей. Длительная выдержка металла под известковым восстановительным шлаком сопровождается крайне медленным снижением концентрации кислорода и существенным поглощением ванной азота и водорода, в результате чего ухудшается качество металла.
Наиболее характерные изменения условии массопереноса наблюдаются в восстановительный период электроплавки. Так, равномерное распределение радиоизотопа 59Fе в ванне 40-тонной электропечи в окислительный период достигается через 5—6 мин, а в восстановительный период (в раскисленной ванне) — через 60— 80 мин. Значения коэффициентов турбулентной диффузии в окислительный период составляют 57—146, а в восстановительный период при диффузионном раскислении — 0,5—2,4 см2/с. Эти величины были определены по данным распределения примесей в ванне электропечей емкостью 10, 40 и 100 т.
Более эффективно диффузионное раскисление протекает при обработке жидкой стали синтетическими шлаками, когда концентрация кислорода значительно снижается в течение 2—3 мин после образования шлакометаллической эмульсии, что обеспечивается чрезмерно развитой контактной поверхностью в системе шлак-металл, достигающей 500 м2/т стали.
Под вакуумом понимается состояние газовой среды с давлением ниже атмосферного. Различают низкий, средний и высокий (глубокий) вакуум в зависимости от давления газовой среды и соответствующей этому давлению величины средней длины свободного пробега газовых молекул:
![]() (2)
(2)
где d — диаметр газовой молекулы. Расчеты показывают, что при 20°С значения l для давления 0,133 Па составляют 0,051 м, а для давления 1,33-10~4 Па — 51 м.
Низкому вакууму соответствует давление газовой среды, при котором средняя длина свободного пробега газовых молекул значительно меньше линейных размеров вакуумного пространства, т.е. l<<I Соответственно для среднего вакуума l<<I, а для высокого — l>>I.
Отдельные виды вакуума характеризуются следующими границами давления: низкий вакуум — ниже 101,3 кПа до 13,3 Па; средний вакуум — от 13,3 Па до 1,33-10~2 Па; высокий вакуум — ниже 1,33-10-2Па.
§4.Теоретические расчеты и экспериментальные данные, полученные для реакций раскисления стали, показывают, что углерод является более слабым раскислителем, чем кремний и алюминий. Однако это справедливо для раскисления стали углеродом при атмосферном давлении. Если создать над жидким металлом давление ниже атмосферного, раскислительная способность углерода значительно увеличится.
Реакцию обезуглероживания в общем виде можно записать следующим образом:
1. [C]+[O] = CO
Kонстанта равновесия реакции 1
![]() (3)
(3)
где ас и а0 — активности углерода и кислорода в металле. Так как константа равновесия реакции (1) при постоянной температуре является величиной постоянной, то с уменьшением величины парциального давления окиси углерода Рсо должна уменьшаться и величина а[С] а[0] . Это означает, что чем ниже давление Рсо, тем выше раскислительная способность углерода, тем меньше кислорода должно находиться в равновесии с углеродом.
Термодинамические расчеты Б.В.Линчевского показывают, что при 1600°С, давлении СО 133 Па и содержании углерода 0,1% в металле должно оставаться 3-10~5% кислорода. Такая низкая концентрация кислорода в металле не достигалась ни в одном из вакуумных металлургических процессов. Несоответствие расчетных и экспериментальных данных обусловлено кинетическими особенностями удаления СО из металла: содержание кислорода в металле определяется давлением СО в пузырьке, а не давлением СО над металлом. Давление СО в газовом пузырьке, образовавшемся в металле, значительно выше давления СО в газовой фазе над металлом. Поэтому для расчетов надо принимать давление СО в пузырьке, а не парциальное давление РСО над металлом. Ниже определенной величины Рсо раскислительная способность углерода перестает зависеть от снижения давления СО над металлом и остается постоянной величиной.
§5. Вакуумная обработка стали позволяет в лучшей степени использовать углерод как раскислитель, так как продуктами раскисления углеродом являются газообразные вещества СО и СО2, которые удаляются из сферы химического взаимодействия. Влияние разрежения (вакуума) на величину изобарно-изотермического потенциала реакции раскисления стали углеродом видно из следующего уравнения:
ΔGP.T = ΔG + RT lgP (4)
где ΔG —изменение изобарного потенциала реакции обезуглероживания при постоянной температуре; Р — остаточное давление (разрежение), атм; ΔGP.T— изменение изобарного потенциала реакции обезуглероживания при учете изменяющегося остаточного давления.
Так как величина Р меньше единицы, второй член уравнения (2) отрицательный. Чем значительнее снижение давления, тем суммарная убыль свободной энергии больше, в результате чего раскислительная способность углерода повышается. Однако такая зависимость будет правомернной до известного предела снижения давления СО над металлом, выше которого начинают оказывать влияние кинетические особенности реакции обезуглероживания металла в условиях вакуума.
Упругость диссоциации FеО в стали при 1600°С составляет 10~-6 кПа, что значительно ниже давления при вакуумной обработке стали 10~-3 кПа). Поэтому для удаления кислорода при вакуумной обработке стали необходимо использовать углерод.
Опытные данные активности растворенного в жидком железе кислорода а[О] от концентрации углерода, кремния, кальция и магния при 1600°С, при давлении окиси углерода 101,3 кПа углерод, содержащийся в стали в количестве 0,15%, снижает активность кислорода в такой же степени, как и 0,15% А1. Для давления окиси углерода 10,1 кПа рассмотренная зависимость наблюдается и для концентрации [Sі] и. [С], равной 0,003%.
Если концентрация углерода выше 0,003%,углерод при давлении ниже 10,1 кПа оказывает более сильное раскисляющее действие, чем кремний.
Раскислительная способность углерода при давлении 1 кПа раскислительной способности (при концентрациях более 0,15%). При любых давлениях окиси углерода и температуре 1600°С более сильными раскислителями, чем углерод, являются магний и кальций.
Из приведенных данных следует, что при раскислении стали углеродом в вакууме могут протекать процессы восстановления кремния и алюминия из огнеупорных материалов и неметаллических включений. Раскисление стали вакуумом позволяет значительно улучшить качество стали.
Глоссарии
Распределение– это переход одного элемента между нескольками фазами, в нашем случае распрделение растворенных элементов между шлаком и металлом.
Кислород–элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Оксид – это соединение в нашем случае кислорода с металлами.
Активность– это эффиктивная концентрация реальных растворов. Иными словами это величина которое отклоняется от условия идеальных растворов, в иеиальных растворов в котором изменения обьема и внутренней энергия не изменяется.
Раскисление – это удаление растворенного кислорода кремнием, алюминием ферросплавами.
Энергия Гиббса– характеризует и показывает направление протекании химической реакции.
Константа равновесия – показывает в каком соотношении находиться в равновесии при данной температуре между продуктами и исходнами компонентами реагентов.
Раскислитель – служат такие элементами, в котором обладает повышенной химическим сродство к кислороду по отношению к железе. Раскислители применяемые в метллургии большинство кремния, алюминия, кальция и т.д. Параметр взаимодействие– для учета влияния всех элементов на данный расматриваемый активность элемента в сложном металлическом расплаве привликает понятие параметр взаимодействия.
Блиц – тест
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
