
- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
В процессах диссоциации окислов можно выделить следующие этапы: химическую реакцию распада окисла с освобождением атомарного кислорода, адсорбированного на границе раздела фаз, молизацию атомов кислорода, десорбцию молекул кислорода, возникновение зародышей новой фазы и их рост.
Экспериментально изучать диссоциацию прочных окислов крайне затруднительно вследствие очень малых значений величин парциальных давлений компонентов паровой фазы. С помощью массспектрометрического эффузионного метода исследован состав паров над кристобалитом в интервале температур 1200-1950 К, при этом обнаружены молекулы двуокиси кремния, моноокиси кремния, молекулярный и атомарный кислород. Результаты измерений парциальных давлений (Па) компонентов пара над кристобалитом приведены ниже:
T, K |
SiO |
SiO2 |
O2 |
O |
1800 |
9,1∙10-4 |
2,1∙10-6 |
6,9∙10-6 |
- |
1900 |
4,5∙10-3 |
1,3∙10-5 |
10,9∙10-6 |
2,9∙10-5 |
Суммарное давление газообразных компонентов над кремнеземом в интервале температур 2000-3000 К определяется из уравнения
![]()
Согласно указанному уравнению давление газообразных компонентов, равное 101,3 кПа, достигается при 3048 К.
С помощью вольфрамовой эффузионной камеры изучались парциальные давления компонентов пара над А12О3(ТВ) при 1992° С. Выше приведены результаты этих исследований:
Т а б л и ц а 3. Значения упругости диссоциации окислов меди СиО и Си2О, Па
Окисел |
Температура, К |
||||
300 |
450 |
600 |
900 |
1200 |
|
СиО |
1,2∙10-35 |
2,3∙10-18 |
8,3∙10-10 |
2,4∙10-1 |
3,3∙10-3 |
Си2О |
4,4∙10-46 |
5,5∙10-27 |
1,8∙10-17 |
4,8∙10-8 |
1,9∙10-4 |
Значительно более высокие величины парциальных давлений продуктов диссоциации наблюдаются у малоустойчивых окислов и перекисей, таких как Аg2О, СаО, Fе2О3, МпО2, ВаО2, СаО2. Из приведенных в таблице данных следует, что при температурах 600 и 900 К упругость диссоциации СиО примерно в 7 раз больше, чем упругость диссоциации Си2О. Равновесная упругости диссоциации СиО была проверена экспериментальным путем. При температурах 900 и 1000° С упругость диссоциации СиО соответственно составляла 1,2-103 и 5,3-103 Па.;Установлено, что скорость диссоциации окиси меди приближенно описывается уравнением
![]() (2)
(2)
где Р0 и Р — равновесное и фактическое давления кислорода в газовой фазе;
К — коэффициент.
Изучение температурной зависимости скорости диссоциации по-казало, что она определяется по уравнению
![]() (3)
(3)
Исследована зависимость скорости диссоциации перекисей бария ВаО2 и кальция СаО2 от давления кислорода в газовой фазе. Установлено, что при постоянных температуре и содержании кислорода в твердой фазе скорость диссоциации ВаО2 и СаО2 так же, как и СиО, пропорциональна разности между равновесным давлением и давлением кислорода в газовой фазе Р. Кажущаяся энергия активации для процесса диссоциации ВаО2 и СаО2 соответственно составляет 192300 и 189000 кДж (кг-моль).
Металлы и сплавы, находящиеся в атмосфере, содержащей кислород или другие кислородсодержащие газы (СО2, Н2О, SО2), покрываются слоем окислов, окалиной, толщина которой увеличивается с течением времени. Этот процесс в области высоких температур относится к высокотемпературной коррозии, протекающей на границе фаз металл — окружающая среда, т. е. является гетерогенным процессом взаимодействия газообразной среды с металлом.
Первопричина коррозии металлов и сплавов — их термодинамическая неустойчивость в различных средах при данных внешних условиях.
Коррозия металлов — это самопроизвольный процесс разрушения металлических материалов вследствие химического или электрохимического взаимодействия их с окружающей средой.
Среди процессов высокотемпературного окисления металлов особое место занимает их окисление кислородом. Этот процесс — самый распространенный вид коррозии металлов в газовых средах при высокой температуре.
Kинетика окисления металлов определяется механизмом их взанмодействия с кислородом. В общем случае суммарный процесс окисления металла включает следующие более простые физические и химические процессы :
адсорбцию молекул кислорода из газовой фазы на поверхности окисной пленки;
диссоциацию адсорбированных молекул кислорода на атомы О2→2О;
ионизацию адсорбированных атомоів кислорода
О + 2е - → О2-
перемещение (диффузию) ионов кислорода (анионов) в пленке окисла в направлении к металлической поверхности;
ионизацию атомов металла и переход ионов
(катионов) и электронов
из металлической фазы в пленку окислов
Ме → Меn+ + ne
перемещение (диффузию) катионов и электронов в пленке окисла в
направлении к границе раздела пленка — газ;
взаимодействие катионов и анионов с образованием продукта этого взаимодействия — окисла металла
![]()
Рассмотрим схему образования окисной пленки на металле (Рис.1). После того как в процессе окисления металлов на поверхности образовалась достаточно толстая пленка окислов, химическая реакция перестает быть контролирующей стадией, эти функции переходят к диффузии тех или иных частиц (катионов, анионов илй электронов).
Зона роста окисной пленки может располагаться на границах газ — пленка, пленка—металл или во внутренних слоях пленки, она определяется скоростью перемещения катионов и анионов. Когда в пленке перемещаются катионы и электроны, зона роста будет находиться на ее внешней стороне (рис. 1, а)
Пленка растет со стороны поверхности металла, если скорость переме-щения анионов существенно выше скорости движения катионов и электронов. При соизме-римых скоростях перемещения анионов, катионов и электронов зона роста располагается внутри пленки.
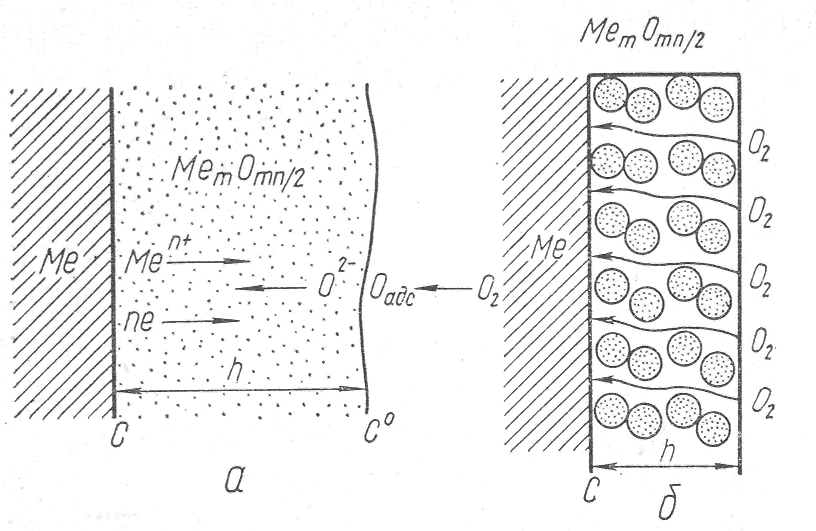
Рис. 1. Схема образования окисной пленки на металле.
Анализ экспериментальных данных показал, что окисление одного и того же металла при разных температурах подчиняется различным кинетическим закономерностям. У большинства металлов наблюдается следующая последовательность смены кинетических закономерностей: логарифмическая, параболическая в промежуточной температурной области, линейная — при высокой температуре.
6. Линейная закономерность окисления металлов наблюдается в тех случаях, когда продукты окисления не тормозят процесс взаимодействия кислорода с металлом. В частности, такой закономерности подчиняется процесс окисления металлов, образующих порис-тую пленку, или металлов, на которых пленка сильно растрескивается. Так как в последнем случае пленка не препятствует окислению металла ни на каком его этапе, то очевидно, что скорость окисления должна оставаться постоянной в течение всего процесса окисления. В этих условиях скорость химической реакции не зависит от толщины образующейся пленки и описывается уравнением.
![]() (1)
(1)
где h — толщина образующейся пленки продуктов коррозии металла;
τ - время коррозии;
Кс,—константа скорости химической реакции;
С—концентрация окислителя на поверхности металла, не зависящая от времени его взаимодействия с кислородсодержащей средой (благодаря высокой скорости адсорбции окислителя). После интегрирования уравнения (1) определяем
![]() (2)
(2)
В болыпинстве экспериментов были получены малые или равные нулю значения постоянной С1. С учетом этого уравнение (2) принимает вид
![]() (3);
(3);
Таблица 1. Отношение объемов окислов и израсходованных металлов
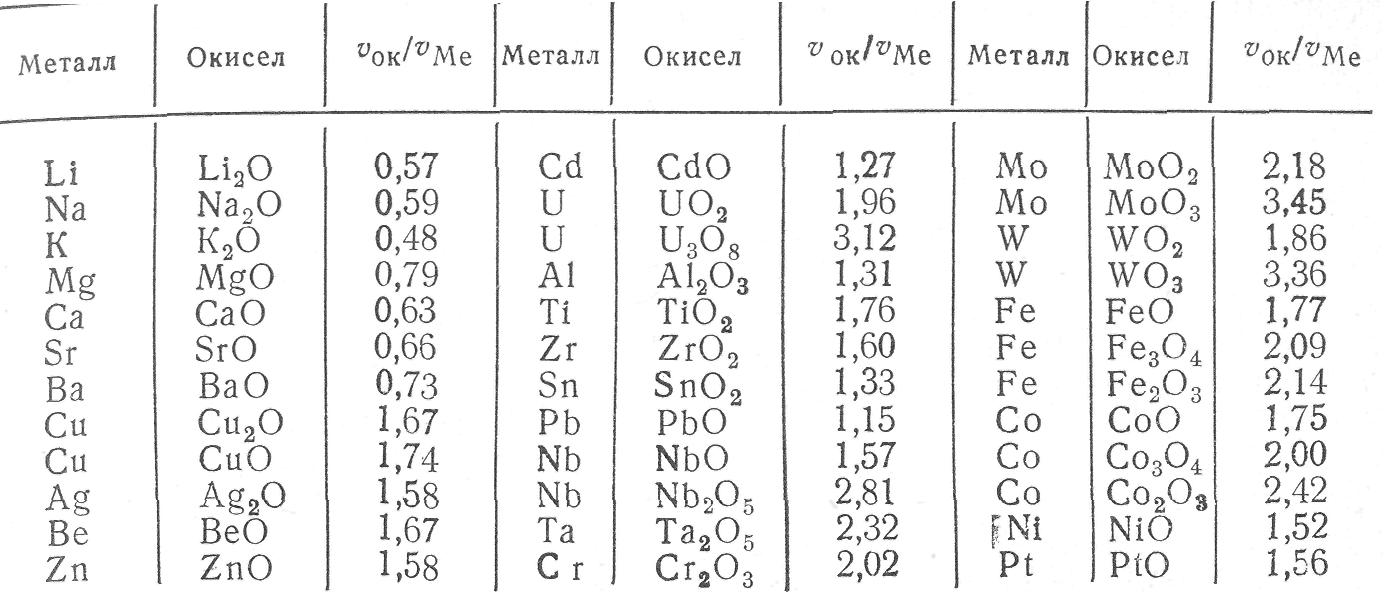
Окисные пленки, покрывающие сплошным слоем всю поверхность металла, могут обладать заметными защитными свойствами. Характер образования таких пленок определяется условием сплошности: молекулярный объем окисла Vок должен быть больше объема металла VMе, израсходованного на образование окисла. Из указанного следует, что если V0k/VMе < 1, то пленка не может быть сплошной (рис.1,б). Для расчета отношения V0k/VMе можно пользоваться формулой
![]() (4)
(4)
где Мок — молекулярная масса соединений; MMе — атомная масса металла; ρок и ρMe — плотность окисла и металла; n — число атомов металла в молекуле окисла.
Все щелочные и щелочноземельные металлы характеризуются отношением V0k/VMе < 1, т. е. не удовлетворяют условию сплошности при окислении их кислородом. В табл. 1 приведены значения отношений объемов некоторых окислов и металлов.
Сплошность пленок окислов является необходимым, но еще недостаточным условием защиты металлов от дальнейшего окисления. При Івозникновении внутренних напряжений пленка окислов может разрушаться частично или полностью. В этом случае нарушается ее сплошность и значительно уменьшаются защитные свойcтва. У пленок с V0k/VMе > 1, отсутствуют высокие защитные свойства. К числу таких окислов относятся Мо03 и VО3. Максимальное значение отношения V0k/VMе равно 2,5. Таким образом, достаточно хорошими защитными свойствами обладают пленки на металлах при 2,5 > V0k/VMе > 1.
При низких температурах (на меди в кислороде до 100° С, на тантале до 150° С, на алюминии, железе, никеле, цинке до 300°С), а также на первых стадиях окисления и при высоких температурах рост тонких окисных пленок сопровождается большим самоторможением во времени, которому отвечает логарифмический закон:
H = K lg (a F +1) (5)
где К и а — постоянные величины.
С утолщением образующихся при высокотемпературном окислении металлсю пленок перемещение через них окислителей в большинстве случаев осуществляется диффузией, которая и контролирует процесс окисления металлов. Скорость установившегося стационарного режима процесса определяется из уравнения
![]() (6)
(6)
где С — концентрация кислорода на внутренней поверхности окисной пленки.
Если на внутренней поверхности пленки не происходит накопления кислорода, т. е. С»0, то уравнение (6) принимает вид
![]() (7)
(7)
После интегрирования уравнения (7) и некоторых преобразований получаем
![]() (8)
(8)
Уравнение (8) отображает параболический закон роста пленки. На рис.2 показано увеличение массы, связанное с окислением железа, при различных температурах.
Толщина пленок продуктов коррозии может изменяться в довольно широких пределах и разделяется на три группы: тонкие (невидимые) — до 40 нм; средние (дающие цвета побежалости) — от 40 до 50 нм; толстые (видимые) — больше 500 нм (окалина на стали).
Рассмотренные выше процессы окисления металлов относятся к простейшему случаю образования на металле пленки, состоящей из одного окисла. Вместе с тем при окислении некоторых металлов образуется многослойная окисная пленка. Так, при температурах выше 570°С на железе и углеродистых сталях образуется пленка, состоящая из трех окислов (рис. 3) вюстита FеО, магнетита Fе3О4 и гематита Fе2О3. Со стороны металлической поверхности располагается окисел FеО с небольшим содержанием кислорода, а со стороны окисляющей среды — Fе2О3 с наибольшим содержанием кислорода.
Вюстит представляет собой раствор типа вычитания, когда отдельные узлы не замещены и в кристаллической решетке окисла образуются «дырки». Для сохранения электронейтральности кристалла из ячейки одновременно с ионом должны выйти два электрона, которые появляются в результате перехода двухвалентных ио нов в трехвалентные.
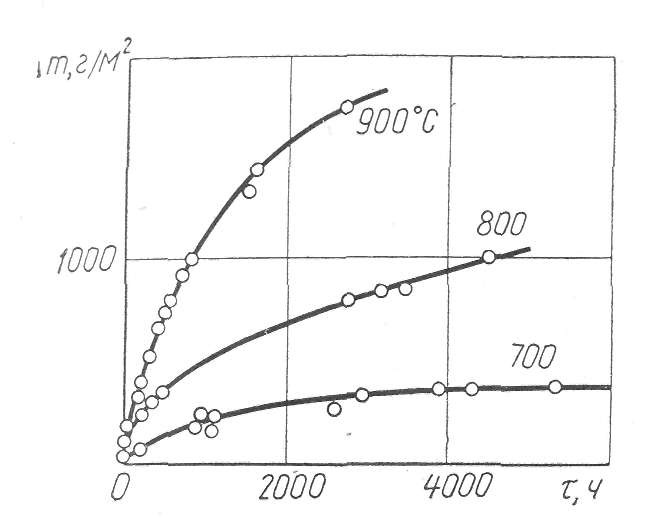
Рис. 2. Увеличение массы, связанное с окислением железа при разных температурах.

Рис. 3. Структура железной окалины и ее соответствие с диаграммой состояния железо—кислород:
I— закисная фаза; II— магнетит;
III — гематит,
Каждой образовавшейся «дырке» отвечает превращение 2Fе2+ —2Fе3++2е~, где е •— электрон.
Магнетит образует сплошную кубическую решетку типа шпинели (минерал состава Мg0-А12О3). Элементарная ячейка магнетита состоит из 8Fе2+ + 16Fе3++32О2.
Фаза α - гематит имеет сплошную ромбоэдрическую решетку типа корунда Аl2О3. Фаза γ-гематит неустойчива при высоких температурах и сравнительно легко переходит в со Fе2О3. Первая из них имеет почти такую же кристаллическую решетку, как магнетит. В табл. 2 показана схема процесса образования окалины при окислении стали .
Таблица 2. Схема процесса образования окалины при окислении
стали
Интервал температур, °С |
Стадии процесса и превращения в окалине (по В. И. Архарову) и металле |
Закон роста калины |
От комнатной до |
Образование пленки, состоящей из •үҒе203 |
Логарифмический |
200 |
||
200—400 |
Возникновение наружного слоя аРе^Оз на внешней стороне окалины |
То же |
|
|
|
400—575 |
Возникновение подслоя Ре3О4 на внутренней стороне окалины |
Степенной |
|
|
|
575—730 |
Возникновение подслоя РехО на внутренней стороне окалины |
То же |
|
|
|
730—780 |
Магнитное (аРе — *(ЗРе) и эвтектоидное (перлит — аустенит) превращение Аллотропическое превращение в стали ((ЗРе— *уре) |
Параболический То же |
730-1150
|
||
Выше 1100 |
Частная диссоциация Ре^Оз |
Сложно- параболический |
§7. Большинство химических процессов, применяющихся в различных отраслях промышленности, протекают с участием твердых фаз. К таким процессам относится получение металлов, сплавов, огнеупоров, силикатов, полупроводников, ферритов. При изучении физико-химических процессов в твердых фазах применяются методы экспериментальных исследований: термографический, рентгено-структурный, радиометрический.
При реакциях типа Л(ТВ) + S(ТВ) = С(ТВ) продукт реакции может пространственно разделить исходные вещества и тогда дальнейшее течение реакции происходит в результате диффузии одного или обоих исходных веществ через продукт реакции. Первые подробные исследования реакций в твердых фазах при взаимодействии Nа2СО3 + ВаS04 = Nа2S04 + ВаСО3 показали, что выяснить механизм подвода регулирующих веществ в зону реакции через продукт реакции трудно. Исходя из этого, многие исследователи приходили к выводу, что в действительности химические реакции- взаимодействия твердых веществ невозможны и предполагали более вероятным протекание реакций в твердых телах через гипотетическую фазу или при частичном переходе зоны реакции в расплавленное состояние .
Во всех реальных кристаллах имеются дефекты кристаллического строения и многие свойства кристаллов полупроводников вы-званы наличием дефектов в их кристаллических решетках. В соответствии с этим диффузия и химические реакции в твердых фазах возможны при наличии дефектов или вакансий в кристаллах.
Между равновесным числом вакансий Nв и числом атомов N, составляющих рассматриваемое кристаллическое вещество, существует следующая температурная зависимость:
![]() eq
eq![]() /KT
/KT
где qв — энергия образования вакансий. Так, для меди qв = 0,9 эВ, при температуре 300 К концентрация вакансии Nв/N ≈ 10-15%, а при 1250о К Nв/N≈ 0,03%.
Атомы в кристаллах и жидкостях в результате самодиффузии перемещаются из одних положений равновесия в другие. В металлах с плотной упаковкой атомов самодиффузия осуществляется в основном через вакансии. Чтобы один из ближайших атомов мог занять вакансию, он должен обладать избыточной энергией qдиф, при этом между частотой атомных переходов ν, временем «оседлой жизни» атома τ и энергией активации самодиффузии qс существует такая зависимость:
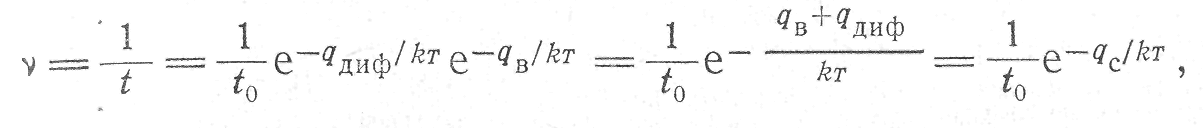 (1)
(1)
где t0 — период собственных колебаний атома
(τ0 = 10![]() );
qс = qв + qдиф — энергия
активации самодиффузии.
);
qс = qв + qдиф — энергия
активации самодиффузии.
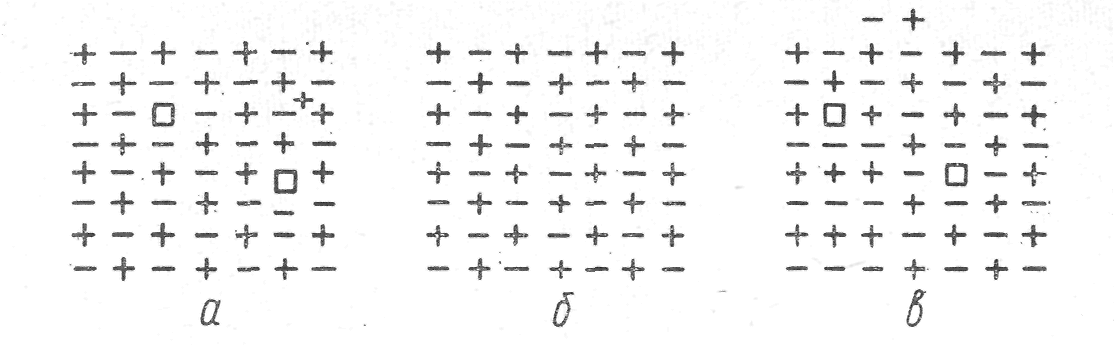
Рис.1. Образование дефектов в кристалличес-кой решетке:
а — кристалл с дефектами по Френкелю; б — идеальный кристалл; в — кристалл с дефектами по Шоттки.
Для меди qС = 2,1 эВ при 1250 К, t = 10-3 с. Эти данные свидетельствуют о том, что вакансии переходят из одного положения равновесия в другое тысячи раз в одну секунду.
Реальные кристаллы могут содержать два типа дефектов (вакансий): по Френкелю и Шоттки . По Френкелю некоторые ионы (катионы и анионы) располагаются в междоузлиях и оставляют свои обычные места в решетке незанятыми. Это приводит к образованию двух видов дефектов ионов в междоузлиях и вакансий (рис. 1). По Шоттки, эквивалентное число катионов и анионов может выходить на поверхность, оставлять свои обычные места в решетке и образовывать таким образом соединения и катионные и анионные вакансии.
Коэффициент диффузии для диффузионного процесса в твердых фазах имеет такое же значение, как и константа скорости для химической реакции. Зависимость коэффициента диффузии от температуры носит экспоненциальный характер и выражается уравне-нием
![]() (2)
(2)
где D— коэффициент диффузии; D0 — предэкспоненциальный мно-житель — постоянная величина, зависящая от физико-химических свойств веществ, участвующих в диффузии; Е •— энергия активации процесса диффузии. Для Е = сопt в интервале температур Т1 ÷ Т2 уравнение (2) принимает вид
![]() (3)
(3)
Зная величину D при двух температурах, по уравнению (3) можно вычислить величину энергии активации Е. Различают два основных механизма процесса диффузии в твердых фазах (рис. 2):
1. Диффузия внутри кристаллической решетки или диффузия по точечным дефектам, при которой происходит:
а) смещение атома (иона) в междоузлие с образованием структуры Френкеля и диффузия по междоузлиям
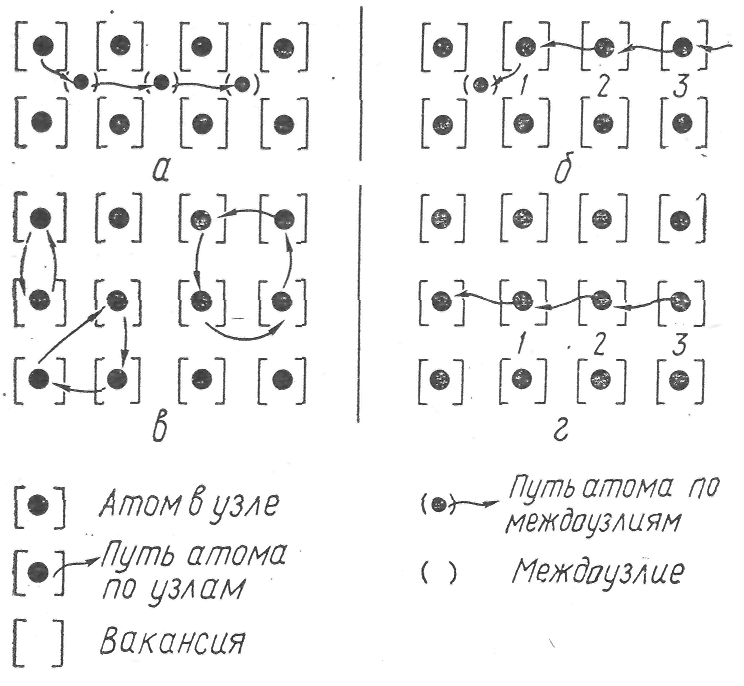
Рис. 2. Возможные механизмы диффузии в кристалле:
а-смещение атома из узла в междоузлие и диффузия по междоузлиям; б—смещение атома из узла в междоузлие и диффузия по вакансиям; в-одновременная круговая диффузия по междоузлиям и вакансиям; г-смещение атома в вакансию и диффузия по вакансиям
б) смещение зтома (иона) 1 в междоузлие с последующим перемещением атома (иона) 2 в вакансию 1, атома (иона) 3 в вакансию 2 и т. д. — диффузия по вакансиям с образованием структуры френкеля;
в) смещение одновременно двух, трех, четырех атомов ионов в междоузлие с последующим перемещением их в остальные вакансии (дуплетное, триплетное, квадруплетное) — круговая диффузия по междоузлиям и вакансиям;
г) смещение атома (иона) 1 в имеющуюся вакансию, атома (иона) 2 в вакансию 1, атома (иона) 3 в вакансию 2 и т. д. —• диффузия по вакансиям с образованием структуры Шоттки.
2. Диффузия вне кристаллической решетки, при которой происходит смещение атома предповерхностного узла на поверхность кристалла с образованием структуры Шоттки.
Схема механизма образования шпинели по реакции:
МgО + А1203 = МgА1204.
Таблица 1 Механизм образования шпинели
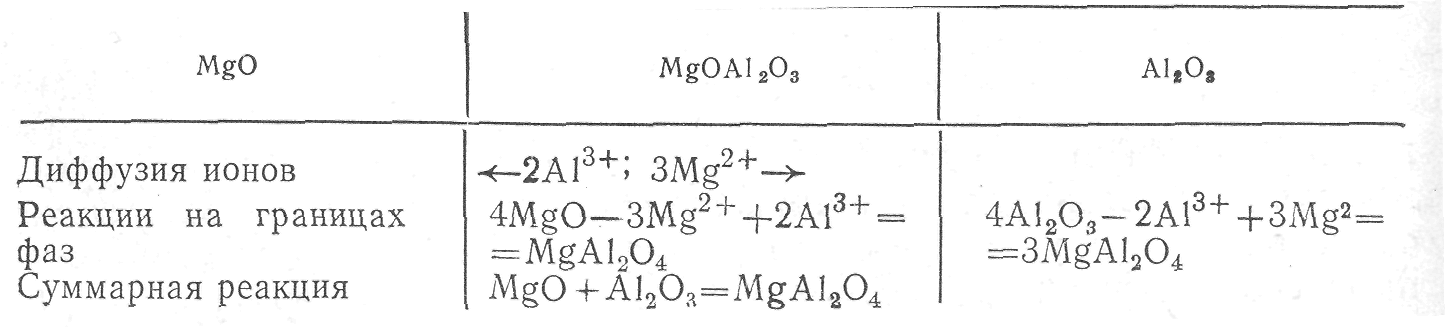
протекающей на поверхности при соприкосновении двух таблеток исходных окислов, показана в табл. 1. Как видно из схемы, образование шпинели МgАІ2О4 происходит путем диффузии ионов Мg2+ и А13+ в противоположных направлениях.
Глоссарии
Сульфиды– это соединения металлов и не металлов с серой.
Шлак – металлургический, расплав (после затвердевания — камневидное или стекловидное вещество), обычно покрывающий поверхность жидкого металла при металлургических процессах — плавке сырья, обработке расплавленных промежуточных продуктов и рафинировании металлов. Представляет собой сплав окислов переменного состава; главные компоненты
Вязкость (внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Основность шлака – это отношение основных оксидов к кислым оксидам.
Кислотность – это отношение кислых шлаков к основным оксидам.
Блиц – тест
|
|
|
|
|
|
|
|
|
|
|
|
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
