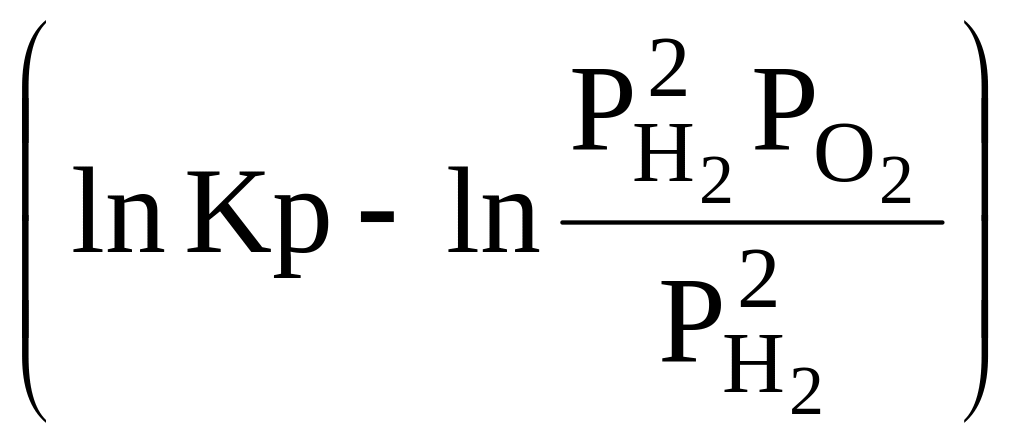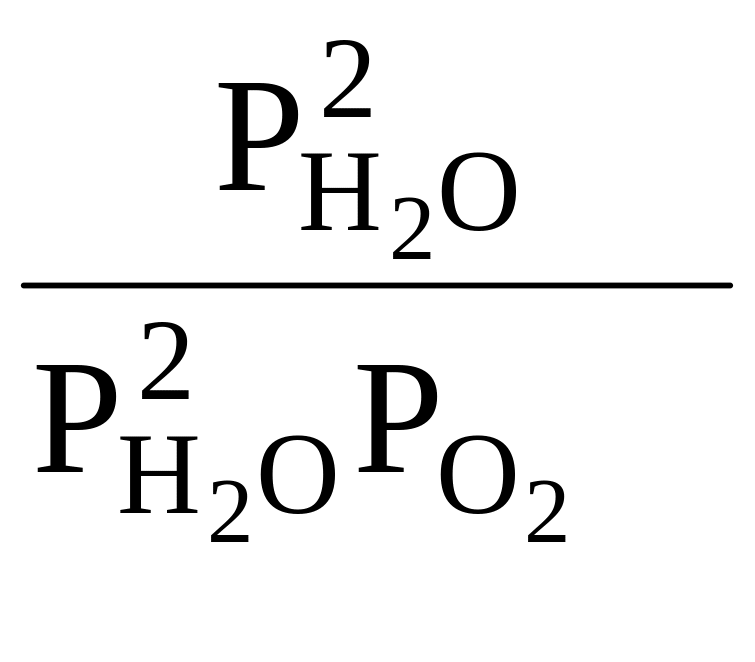- •Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
- •§2. Главные компоненты горючих газов – водород, окись углерода и метан.
- •§ 6. Реакция водяного газа является обратимой и играет большую роль в металлургических процессах:
- •Ниже приведены вычисленные значения δн реакции водяного газа для различных температур
- •Какая стадия является лимитирующей для последовательных процессов?
- •§ 4 Взаимодействие твердого углерода с двуокисью углерода и водяным паром. Эти процессы включают диффузионную, адсорбционную и собственно химическую стадии.
- •§ 3. Процесс диссоциации окислов металлов обычно рассматривается исходя из реакции
- •§ 4. Известны три окисла железа, устойчивые при повышенных температурах:
- •Термохимические данные фазовых превращений железа и его окислов.
- •§ 7.Интенсивное разложение известняка развивается выше определенной температуры, когда упругость диссоциации начинает превышать общее атмосферное давление.
- •Что называется коэффициентом массопередачи? Коэффициентом массопередачи называется:
- •§5.Процессы диссоциации окислов металлов и карбонатов обладают одной и той же физикохимической природой: они относятся к топохимическим реакциям.
- •Лекции №8 «Науглероживание железа оксидом углерода»
- •Превращение окисла в новое химическое соединение, например силикат
- •Опираясь на имеющиеся данные получаем, что
- •§ 6. Зависимость вязкости жидкостей от температуры, как указывалось выше, описывается уравнением я. И. Френкеля
- •Какова зависимость энтальпии температуры:
- •1. В термодинамике для описания химических процессов в качестве единицы количества вещества, как правило, используют:
- •2.Моль это:
- •8. Закон Кирхгофа:
- •9. Для количественной оценки степени хаотичности вводят специальный термодинамический параметр:
- •План лекции:
- •§2. В жидком железе сера обладает неограниченной растворимостью. По характеру влияния на растворимость серы в железе элементы разделяются на три группы:
- •План лекции
- •§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
Лекции №1 Введение
План лекции
Введение.
Цели и задачи дисциплины.
Основные металлургические процессы.
Их общая характеристика, научные направления.
Классификация основных металлургических процессов.
Характеристика перерабатываемого сырья и получаемой металлопродукции.
Цель лекции
Ознакомление с основными металлургическими процессами
Дидактические единицы
Сталь; чугун; ферросплавы; металлургические процессы; металлургические агрегаты.
1. Металлургические процессы являются сложным комплексом физико-химических превращений, протекающих в условиях высоких температур в твердых, жидких и газообразных фазах. Эти процессы обеспечивают получение металла высокого качества с малыми затратами времени и материалов.
Основоположником теории металлургических процессов как самостоятельной научной дисциплины является академик А.А. Байков, который впервые ввел такой курс в 1908 г. в Петербургском политехническом институте и дал классическое определение — «Металлургия есть химия высоких температур». В теории металлургических процессов начали широко применять методы и принципы физической химии. Пионерами использования законов и методов физической химии в металлургии помимо А.А. Байкова были профессора В.Е. Грум-Гржимайло, М.М. Карнаухов, И.А. Соколов, А.М. Самарин, Н.Н. Доброхотов. Курс теории металлургических процессов применительно к цветной металлургии разработал профессор А.Н. Вольский. Существенный вклад в дальнейшее развитие теории металлургических процессов внесли профессора О.А. Есин, С.Т. Ростовцев, С.И. Филиппов, Г.И. Чуфаров, И.В. Гельд, В.П. Елютин, В.И. Явойский, А.Н. Морозов, Н.М. Чуйко, С.И. Попель и др.
А.А. Байков сформулировал основные проблемы черной металлургии, решение которых является задачей металлургической науки:
определение физических свойств расплавленных металлов и сплавов (теплопроводности, вязкости, плотности, поверхностного натяжения);
нахождение новых способов борьбы с газами, растворенными в металлах и сплавах и ухудшающими их свойства;
изучение состояния неметаллических включений (окислов, сернистых соединений, силикатов и др.) в расплавленном и закристаллизовавшемся металле;
изучение механизма и кинетики химических реакций, протекающих в сталеплавильной ванне;
установление влияния различных исходных материалов на свойства, получаемого из них металла;
открытие принципов, законов и положений, которые позволили бы проектировать легированные и углеродистые стали с заданным комплексом свойств.
Эти задачи перед металлургической наукой были поставлены А.А. Байковым в 1939 г. За прошедший период времени произошли колоссальные сдвиги в научных исследованиях металлургических процессов и в разработке более совершенных технологий. Так, для улучшения служебных свойств различных марок стали широко применяют внепечные процессы — обработка металла в ковше синтетическими шлаками, продувка металла в ковше инертными и раскисляющими газами, вакуумирование его в струе, ковше, изложнице. Коренное улучшение качества легированных сталей и сплавов достигается при электропереплавных процессах: вакуумно-дуговом (ВДП), электрошлаковом (ЭШП), электронно-лучевом (ЭЛП) и плазменно-дуговом (ПДП).
Теория металлургических процессов изучает физико-химические особенности важнейших химических реакций. Курс «Теория металлургических процессов» находится на стыке курсов «Физическая химия» и «Металлургия чугуна», «Металлургия стали», «Электрометаллургия стали и ферросплавов». Курс «Теория металлургических процессов» является базовой дисциплиной, основная задача которой — научить будущих инженеров пользоваться методами физической химии для анализа превращений, происходящих в металлургических агрегатах.
В курсе лекций рассмотрены вопросы физико-химических особенностей внепечных способов улучшения качества металла, электропереплавных процессов.
2. Современная техника предъявляет все возрастающие требования к качеству металлов и сплавов. Она не могла бы успешно развиваться без самых разнообразных марок сталей и сплавов, обладающих высокими прочностными или пластическими характеристиками, жаростойкостью, большой электропроводностью или высоким электросопротивлением и рядом других особых физических свойств. По меткому выражению А. А. Байкова, «сталь должна быть прозрачной», т. е. обладать не только высокими механическими свойствами, но и быть в то же время однородной и чистой. Вместе с тем в стальном слитке и заготовках всегда имеется некоторое количество неметаллических включений. Многие свойства стали зависят не только от химического состава и микроструктуры (характера термообработки), но и в значительной степени определяются количеством, природой, величиной, характером расположения неметаллических включений. Неметаллические включения (А12О3, ТiO2, SiO2), имеющие температуру плавления выше температуры плавления металла, в твердой стали обычно располагаются внутри кристаллитов, а более легкоплавкие включения (FeO, FeS) выделяются по границам зерен металла в виде прослоек. При нагреве слитков под прокатку или ковку прослойки расплавляются, нарушается связь между зернами металла, что вызывает явление красноломкости.
Углеродистые стали не обладают необходимыми физико-механическими и служебными свойствами. Эти недостатки устраняются введением в сталь различных легирующих элементов. Для получения легированных сталей используют металлы: тяжелые — Си, Ni, Со, Мп, Сr; легкие — Mg, Ca, A1; тугоплавкие — W, Та, Mo, Nb, Zr, Ti; редкоземельные — La, Nd.
Академик Н.Т. Гудцов предложил следующую классификацию элементов в сталях:
постоянные, всегда присутствующие в стали – углерод, марганец, кремний,;
вредные – сера, фосфор, кислород, водород, азот, цветные металлы;
остаточные (случайные), случайно попавшие в плавку или содержащиеся в данном сорте шихтовых материалов – медь, хром, никель;
легирующие, специально вводимые в сталь – хром, никель, титан, цирконий, молибден, ванадий, алюминий.
К черным металлам относятся чугун, сталь и ферросплавы.
Сталь – это сплавы железа, содержащие до 2,06% углерода (максимальная растворимость углерода в аустените, находящемся в равновесии с цементитом при эвтектической температуре).
Чугун – это сплавы железа, содержащие более 2,06% углерода.
Ферросплавы – это сплавы железа с другими элементами — марганцем, кремнием, хромом, молибденом, титаном, вольфрамом.
Применяются ферросплавы для раскисления и легирования стали.
3. Чугун выплавляется в доменных печах и разделяется на передельный (в дальнейшем перерабатывается в сталь) и литейный (с повышенным содержанием кремния для чугунных отливок). Исходными шихтовыми материалами для производства чугуна являются агломерат, окатыши, железные руды и кокс. Помимо предельного и литейного чугуна в доменных печах выплавляется высокоуглеродистый ферромарганец и доменный ферросилиций.
Физико-химические процессы, протекающие в доменных печах при получении чугуна, можно разделить на три группы:
Процессы окисления (горение топлива) протекают в горне доменной печи в небольших объемах возле воздушных фурм. Конечным продуктом горения углерода кокса в горне доменной печи является окись углерода.
Процессы восстановления протекают во всем объеме доменной печи кроме окислительных зон в горне. В доменной печи восстанавливаются железо, марганец, кремний, фосфор и некоторые другие элементы. Главный процесс — восстановление железа. Восстановителями в доменной печи являются окись углерода, водород и твердый углерод.
Процессы плавления чугуна и шлака развиваются в такой последовательности. При работе доменной печи интенсивное восстановление окислов железа начинается на расстоянии 2,0—2,5 м от уровня засыпи. К середине шахты количество отнятого у окислов железа кислорода составляет 40—70%. На указанных горизонтах уже нет окиси железа, в значительной степени восстанавливаются магнитная окись и частично — закись железа, количество восстановленного губчатого железа составляет 17—37%. Последнее однако расплавиться не может, так как температура плавления чистого железа довольно высокая (1539°С). Свежевосстановленное металлическое железо постепенно науглероживается, температура плавления понижается, науглероженное железо превращается в чугун, который плавится. Последний в виде капель и струек стекает вниз и накапливается в горне.
По мере опускания материалов в доменной печи образуются первичные, промежуточные и конечные шлаки (состоящие из окислов кальция, кремния, алюминия, марганца, магния и др.), отличающиеся по составу и свойствам и имеющие разное значение для процесса. Расплавленный шлак струями стекает в горн и располагается над слоем чугуна. Восстановительные процессы и шлакообразование протекают одновременно, при этом полнота восстановления железа и марганца к началу шлакообразования и плавления определяет состав, температуру и свойства первичного шлака. При совместном стекании вниз шлака и чугуна и их взаимодействии происходит удаление серы из чугуна. После накопления достаточного количества шлак и чугун выпускают из доменной печи через шлаковые и чугунные летки.
Ферросплавы (ферромарганец, ферросилиций, ферросиликохром, феррованадий, ферровольфрам) выплавляют в специальных ферросплавных печах путем восстановления металлов из соответствующих кислородных соединений. Восстановителями являются углерод и некоторые металлы. Различают углетермический и металлотермический способы получения ферросплавов. Из металлотермических способов для получения ферросплавов используют силикотермический и алюмотермический.
Качество ферросплавов определяется содержанием и пределами колебаний основных элементов; концентрацией сопутствующих примесей (С, S, Р, цветные металлы); гранулометрическим составом, плотностью, температурой плавления; содержанием неметаллических включений, кислорода, водорода.
Получили также распространение экзотермические ферросплавы, представляющие собой смеси измельченных ферросплавов с термитными добавками. Эти смеси применяют в виде брикетов или гранул. Они характеризуются значительным экзотермическим эффектом при взаимодействии с жидкой сталью, так как тепло жидкой стали на нагрев и расплавление экзотермических брикетов не расходуется.
4. К классическим способам производства стали относятся бессемеровский, томасовский, мартеновский, кислородно-конвертерный и электросталеплавильный, которые по природе являются окислительными процессами. Такие элементы, как Мп, Si, Сг, Р, окислившиеся в первые периоды плавки, могут при определенных условиях в последующие периоды восстанавливаться из окислов или других химических соединений шлака и переходить в металл.
Все процессы выплавки стали, классическими способами протекают при участии шлаковых расплавов, выполняющих важные технологические функции. В зависимости от химического состава огнеупорной кладки сталеплавильных агрегатов и присаживаемых по ходу плавки шихтовых материалов сталеплавильные процессы и шлаки разделяются на основные (главный компонент шлака СаО) и кислые (главный компонент шлака SiО2).
─ Бессемеровский способ изготовления стали является кислым процессом. Огнеупорная кладка бессемеровских конвертеров выполняется из кислого огнеупорного материала — динаса (95% SiО2). Процесс продувки чугуна воздухом сопровождается окислением элементов чугуна Si, Mn, С, Р и образованием кислых шлаков (содержание SiО2 50—60%). Такие шлаки не позволяют удалять серу и фосфор из металла. При окислении примесей чугуна выделяется значительное количество тепла, и температура металла к концу продувки повышается до 1600—1620°С и выше.
Бессемеровская сталь отличается по технологическим и механическим свойствам от мартеновской такого же химического состава: плохо поддается электросварке (в околошовной зоне появляются трещины), обладает повышенной хрупкостью (особенно при отрицательных температурах), склонностью к старению в результате выделения нитридов железа (повышаются прочностные и понижаются пластические свойства). Это различие свойств обусловлено главным образом повышенным содержанием в бессемеровской стали фосфора (до 0,06—0,07%) и, особенно, азота (до 0,015—0,025%). Объем производства бессемеровской составляет около 0,3% от общего количества выплавляемой в стране стали.
─ Томасовский способ — основной конвертерный процесс, предназначенный для переработки (в томасовских конвертерах) в сталь чугуна с содержанием фосфора 1,5—2,0% и более. Получение достаточно основного шлака достигается в результате присадки в конвертер необходимого количества извести. Томасовским способом сталь в нашей стране не выплавляется. За рубежом она производится в относительно больших количествах. Так, в ряде стран Западной Европы (Бельгия, Франция, Люксембург, ФРГ), располагающих большими запасами фосфористых железных руд, удельный вес томасовской стали в общем производстве составляет 23—73%.
─ Мартеновский способ получения стали может быть кислым или основным. На металлургических заводах СНГ мартеновская сталь изготовляется основным скрап-рудным процессом, металлическая шихта которого состоит из 55—65% жидкого чугуна и 45—35% железостального лома. Кислым мартеновским способом сталь выплавляется лишь на некоторых машиностроительных заводах. В отличие от конвертерных процессов, тепловой баланс которых определяется суммой физического и химического тепла жидкого чугуна и тепла, аккумулированного в футеровке конвертера, мартеновский процесс не может протекать без применения внешнего источника тепла. Для отопления мартеновских печей применяется газообразное и жидкое топливо — природный, коксовый, генераторный газы и мазут.
Сущность наиболее распространенного скрап-рудного процесса состоит в том, что загруженная на подину мартеновских печей металлическая шихта подвергается воздействию окислительной атмосферы печи или вдуваемого в ванну кислорода. Происходит окисление примесей кремния, марганца, углерода, фосфора, образуется шлак, состоящий в основном из различных окислов. После расплавления металлической ванне протекают процессы рудного (когда в печь загружается железная руда) и затем чистого кипения. Назначение последнего — нагреть металл до заданной температуры, получить требуемый химический состав. Процесс плавки заканчивается раскислением стали, когда в нее вводят различные раскислители, содержащие Mn, Si, A1 и другие элементы, обладающие большим сродством к кислороду, чем железо.
Опыт показывает, что более прогрессивным способом производства стали является кислородно-конвертерный. В связи с этим в нашей стране и за рубежом прекращено строительство мартеновских цехов и печей, а новые мощности по производству стали создаются путем строительства кислородно-конвертерных и электросталеплавильных цехов с агрегатами большой единичной садки и высокой годовой производительности.
Для футеровки кислородных конвертеров применяются основные огнеупоры: обожженные (магнезитовые, магнезитохромитовые, хромомагнезитовые) и безобжиговые (смолодоломитовые, смоломагнезитовые, смолодоломитомагнезитовые). Передельный чугун и железостальной лом так же, как и в мартеновском процессе, являются главными составляющими металлической части шихты для кислородно-конвертерного процесса. В зависимости от количества расходуемого железостального лома, качества флюсующих материалов, интенсивности продувки, способа разливки и других факторов производится выбор оптимального химического состава передельного чугуна.
При продувке чугуна кислородом в конвертере образуются две зоны: зона продувки, в которой окисляется преимущественно железо и вдуваемый кислород непосредственно соприкасается с жидким металлом; зона циркуляции, в которой происходит окисление примесей за счет кислорода, поступающего в металл в результате растворения в нем закиси железа. Главным источником тепла кислородно-конвертерной плавки служит тепло, выделяемое при окислении углерода и кремния: 40—45% химического тепла вносится за счет окисления углерода и 25—30% —за счет окисления кремния. В тепловом балансе первого периода продувки (первые 5 мин) основным источником тепла является тепло, получаемое от окисления кремния (70—75%). При повышенном расходе металлолома, когда вследствие значительного переохлаждения ванны окисление углерода замедляется, роль кремния как основного теплоносителя еще больше возрастает.
Продолжительность продувки ванны в кислородных конвертерах составляет всего 12—18 мин, поэтому для успешного осуществления десульфурации и дефосфорации металла необходимо применять качественную известь, обладающую высокой реакционной способностью, то есть способностью быстро растворяться в шлаке.
В кислородных конвертерах выплавляется углеродистая и легированная сталь широкого сортамента. Механические и технологические свойства такой стали по ряду показателей выше, чем мартеновской стали аналогичных марок.
─ Электросталеплавильным способом в дуговых электропечах в нашей стране производится стали меньше, чем мартеновским и кислородно-конвертерным. В ближайшем будущем объем производства стали таким способом возрастет на столько, что он наравне с другими способами станет массовым. Это произойдет в результате удешевления электроэнергии и применения железа прямого восстановления.
Плавка в электропечах протекает, как правило, в два периода (окислительный и воостановительный). Отличительной особенностью электросталеплавильного способа производства по сравнению с мартеновским и кислородноконвертерным является наличие восстановительного периода, на протяжении которого осуществляются более глубокие раскисление и десульфурация металлической ванны, а также легирование металла. Для ускорения процесса плавки и дальнейшего снижения содержания кислорода и серы осуществляется электромагнитное перемешивание расплавленного металла.
При электроплавке шлак и металл нагреваются до более высоких температур по сравнению с мартеновским и кислородно-конвертерным процессами. Это позволяет выплавлять в электропечах высоколегированные стали и сплавы, в состав которых входят тугоплавкие элементы. Из-за пониженного содержания кислорода, серы и неметаллических включений выплавленные в электропечах стали обладают необходимыми механическими и технологическими свойствами.
5. Развитие ядерной энергетики, авиакосмической техники, газо-турбостроения требует значительного увеличения производства легированных сталей и сплавов, обладающих специальными свойствами, и создания новых металлических материалов, способных работать при очень низких и очень высоких температурах, под большим давлением и в агрессивных средах. Обычные методы производства легированных сталей и сплавов уже не могут обеспечить уровень качества металла, отвечающий требованиям новых отраслей техники.
Коренное улучшение качества легированной стали и сплавов стало возможным с появлением новых электропереплавных способов получения слитков: вакуумно-дугового (ВДП), электрошлакового (ЭШП), электронно-лучевого (ЭЛП) и плазменно-дугового (ПДП) переплавов. Источник нагрева при ВДП — электрическая дуга, горящая в вакууме, при ЭШП — электрическое сопротивление в виде ванны расплавленного шлака, при ЭЛП — электронный луч, при ПДП — электродуговая плазма.
Вакуумно-дуговой переплав. На рис. 1 показана схема установки ВДП. При ВДП расходуемый электрод расплавляется за счет тепла электрической дуги и постепенно каплями заполняет водоохлаждаемый кристаллизатор. Переплав ведется при давленнн 6,7-105—6,7 Па на постоянном токе прямой полярности. ВДП обеспечивает уменьшение содержания газов (водорода и азота) и неметаллических включений. Содержание серы и фосфора в металле практически не изменяется. Вакуумные процессы сопровождаются испарением некоторых элементов в довольно значительных количествах. Так, испарение марганца из расплавов протекает с большой скоростью и оеобенно заметно, если давление в печи ниже 2,7—9,3 Па. Давление паров молибдена, вольфрама, тантала весьма мало, поэтому они не испаряются из жидкого металла. Потеря указанных элементов наблюдается в случае повышенного содержания кислорода в металле и образования их окислов. Окислы вольфрама и молибдена весьма летучи.
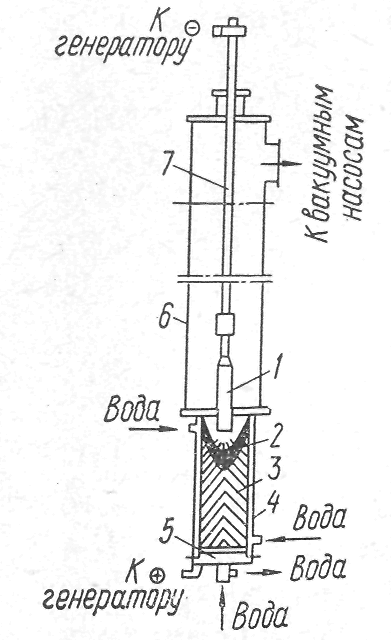
Рис 1 Схема установки ВДП;
1-расходуемый электрод; 2-ванна жидкого металла; 3-слиток;
4-водоохлаждаемый кристаллизатор;
5-водоохлаждаемый поддон; 6-вакуумная камера;
7-токоподводящий шток
Электрошлаковый переплав. Для изготовления в больших количествах стали и сплавов особо высокого качества в 1953 г. в Институте электросварки им. Е. О. Патона АН УССР был разрзботан способ электрошлакового переплава расходуемых электродов. Впервые в промышленном маштабе этот способ был применен на заводе «Днепроопецсталь». В СНГ ЭШП производятся стали и сплавы более 100 марок — конструкционные, шарикоподшипниковые, нержавеющие, кислото-стойкие, теплоустойчивые, жаропрочные. В установках ЭШП процесс осуществляется на переменном токе промышленной частоты. При этом отпадает необходимость в сложном и дорогом вакуумном оборудовании. В большинстве случаев ЭШП обеспечивает получеение металла, по качеству не уступающего более дорогому металлу, получаемому ВДП.
На рис. 2 показаны схемы установки ЭПІП на переменном токе. Сталь, подвергаемую переплаву, вначале прокатывают на заготовку круглого или квадратного сечения, которая при ЭШП применяется в качестве электрода. Последний присоединяют к одному полюсу трансформатора, а кристаллизатор — к другому (рис. 2, а). При использовании трехфазного трансформатора возможно одновременное расплавление в одном кристаллизаторе трех электродов (рис. 2, б) или подключение к одному трансформатору трех кри-сталлизаторов (рис. 2, в).
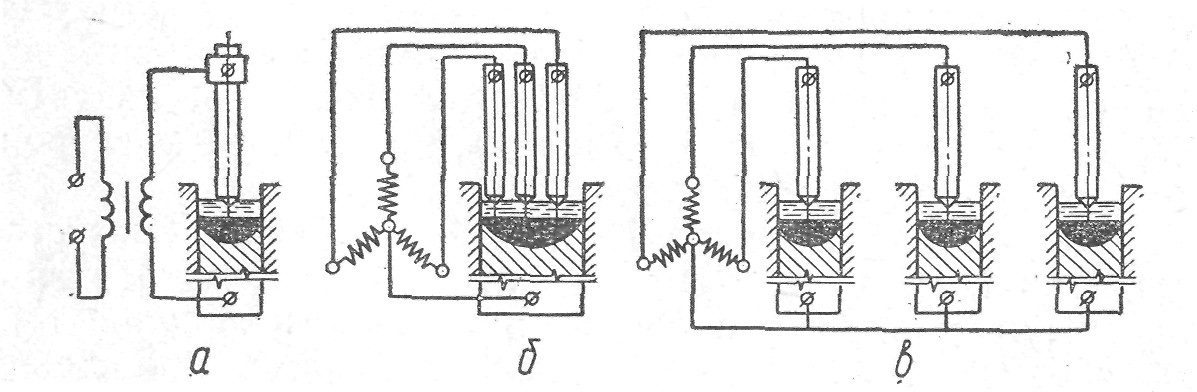
Рис. 2. Схемы ЭШП на переменном токе: а — однофазная; б, в — трехфазные.
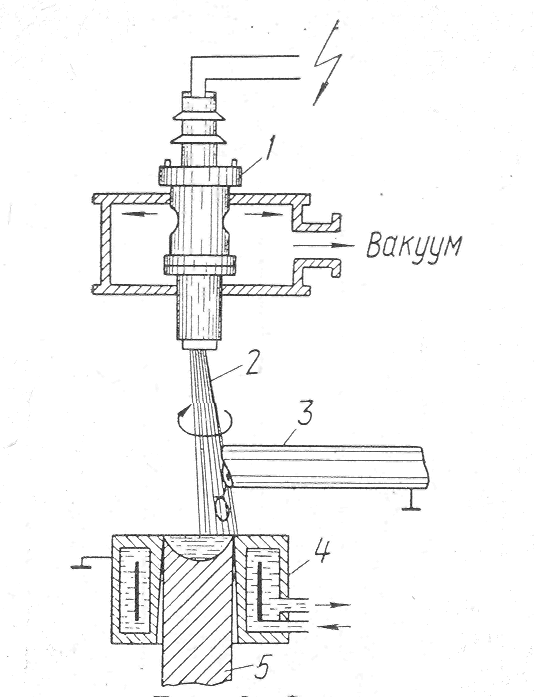
Рис 3. Схема электроннлучевого переправа,
1-пушка; 2- электронные лучи; 3- переплавляемая заготовка; 4- водоохлаждаемый кристаллизатор; 5- слиток.
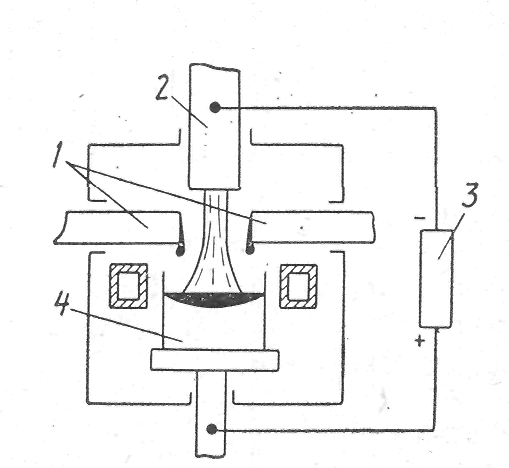
Рис. 4. Схема плазменно-дуговой печи:
1-электроды; 2-плазматроны;
3- источник тока; 4- слиток
При ЭШП рафинирование осуществляется через слой шлака специального состава, оказывающего на металл раскисляющее и десульфурирующее воздействие. В установках ЭІІІП температура шлака значительно выше, чем при других сталеплавильных процессах. Так, температура перегрева шлака составляет 425—565°С.
Электронно-лучевой переплав. На рис. 3 показана схема установки ЭЛП, который сочетает в себе возможность плавки металла в вакууме — ниже 10~2 Па с нагревом до высокой температуры. Принцип метода состоит в том, что пучок электронов высокой мощности бомбардирует шихту, которая расплавляется в медном водоохлаждаемом кристаллизаторе. Источником электронов служит накаленная пластина или спираль-катод, с которого и происходит термоэлектронная эмиссия.
Плазменно-дуговой переплав. При ПДП плазменная струя может состоять из любой необходимой смеси газов, что позволяет поддерживать в печи любую атмосферу: окислительную, восстановительную, нейтральную (рис. 4). Плавка в плазменных печах отличается от вакуумной, индукционной и электронно-лучевой плавок наличием атмосферного давления над ванной, она сопровождается меньшим испарением основных компонентов расплава.
Переплавы удорожают сталь. Стоимость 1 т стали ЭШП приблизительно на 500, а вакуумно-дугового дороже стали, вылавленной в открытой дуговой печи. Поэтому применение процессов переплавных процессов целесообразно, если уменьшается брак, увеличивается выход годного или существенно улучшаются служебные качества металла.
Представляет интерес сопоставить содержание примесных элементов (ат. ррт.) в электростали и в стали электропереплавных процессов. Сера в наибольшей степени удаляется при ЭШП, кислород и водород — при ВДП и ЭЛП. Для получения стали с более низким содержанием фосфора и примесей цветных металлов должна использоваться чистая первичная (первородная) шихта.
Примесные элементы, главным образом металлоиды, помимо отрицательного влияния на физико-механические и служебные свойства, вызывают или усугубляют многие дефекты в углеродистых и легированных сталях, к числу которых относятся горячие трещины на поверхности слитка, интеркристаллические осевые или радиальные трещины в слитке, шиферный слоистый излом, расслоения в листовой стали, волосовины при ступенчатых обточках, флокены и др.
Процессы горения топлива широко используются в металлургии при агломерации руд, получении чугуна в доменных и стали в мартеновских печах. Обычно в качестве топлива применяют горючие вещества органического происхождения, удовлетворяющие следующим требованиям: значительный тепловой эффект, распространенность в природе, невысокая стоимость, газообразное состояние продуктов горения и их относительная безвредность.
В черной металлургии потребляются такие виды топлива как: каменно-угольный кокс — основной горючий материал в доменном процессе, горючие газы (доменный, коксовый, генераторный, природный) и мазут, применяемые в доменном и мартеновском производствах и в различных нагревательных устройствах. В твердом топливе важнейшей горючей составляющей является углерод, а в газообразном — водород, окись углерода и метан.
Основной источник горючих газов — природные газы, добыча которых непрерывно возрастает. Значительная часть добываемых природных газов используется как топливо, остальная — перерабатывается в газы заданного состава. При восстановительных процессах в металлургии и химическом синтезе важную роль играет конверсия природного газа.
Физико-химический анализ металлургических реакций основан на применении данных об активностях веществ и изменениях свободной энергии или термодинамических потенциалов. При изучении фазовых равновесий и химических реакций широко используются правило Гиббса и принцип подвижного равновесия Ле-Шателье.
Большинство металлургических реакций развиваются в системах, в которых одни и те же реагирующие вещества находятся в различных фазах. Химические реакции в таких сложных системах идут до тех пор, пока существует разность химических потенциалов реагирующих веществ в различных фазах системы (µα - µβ = ∆µ). Химические реакции прекращаются после того, как потенциалы реагирующих веществ в различных фазах выравниваются (µα = µβ). Таким образом, условием равновесия системы является равенство потенциалов реагирующих веществ во всех фазах рассматриваемой системы.
µ![]() = µт
= µт![]()
При изучении химических реакций и фазовых превращений широко используется аппарат химической термодинамики и химической кинетики. Основными вопросами, которые рассматриваются химической термодинамикой, являются следующие:
—выяснение возможностей самопроизвольного протекания химических реакций или фазовых превращений при определенных условиях; ∆G < 0
—установление условий, при которых различные вещества или различные фазы одного и того же вещества могут находиться в равновесии; (Р,T,Ci, µi)
—определение термохимических эффектов (количества теплоты и работы – q, λ, W), которые сопровождают химические реакции и фазовые превращения.
В настоящее время известно более ста элементов, несколько сот тысяч неорганических и несколько миллионов органических соединений. Можно написать множество химических реакций между ними. Но могут ли в действительности взятые при данных условиях вещества вступать во взаимодействие друг с другом?
Способность различных веществ взаимодействовать между собой с образованием новых веществ была замечена давно и получила название химического сродства. Мерой химического сродства служит максимальная работа процесса Wmах (за вычетом работы против внешнего давления), т. е. изменение свободной энергии, если реакция протекает при постоянном объеме ∆G = -Wp/max, ∆F = -Wv/max и постоянном давлении Wp/max= -∆G. Максимальную работу химической реакции и химическое сродство принято характеризовать изменением изохорно-изотермического потенциала ∆Ғ (изохорный потенциал)—для систем при постоянных температуре и объеме, и изобарно-изотермического потенциала ∆G (изобарный потенциал)—для систем при постоянных температуре и давлении.
Любая величина, относящаяся к состоянию термодинамической системы (температура, давление, внутренняя энергия, энтропия, концентрация, молярный и удельный объем), характеризует термодинамические параметры состояния. Всякое изменение в системе, связанное с изменением одного или несколышх термодинамических параметров, приводит к возникновению термодинамического процесса.
При изучении термодинамических свойств веществ большое значение приобрело понятие стандартного состояния, которое относится к чистым жидким и твердым веществам, находящимся под давлением 101,3 кПа, а также к растворенньм веществам и к газам, если активность каждого компонента равна единице.
Справочные
значения термодинамических функций
различных веществ обычно относятся к
их стандартному состоянию, а параметры
реакций — к условиям, когда каждое из
веществ, участвующих в реакции, находится
в стандартном состоянии.
Все термодинамические величины,
относящиеся к этим условиям, называются
стандартными и отличаются верхним
индексом,
обозначенным нуликом. Так, S![]() означает стандартное значение энтропии,
а - ∆G
стандартное изменение изобарного
потенциала данного вещества при
температуре Т
= 298о
К.
означает стандартное значение энтропии,
а - ∆G
стандартное изменение изобарного
потенциала данного вещества при
температуре Т
= 298о
К.
Большинство металлургических процессов протекает в условиях практически неизменяющегося давления. Изменение изобарного потенциала (свободной энергии) ∆G вещества или системы при стандартной температуре (298 К) и постоянном давлении определяется из уравнения
![]() (1)
(1)
где ∆Н и ∆S — зменения энтальпии и энтропии продуктов химической реакции и исходных веществ; Т = 298о К температура, оК.
Изменения изобарного потенциала для температуры Т рассчитываются по формуле
![]() (2)
(2)
где ∆С![]() —
разность сумм теплоемкостей продуктов
реакции и исходных веществ.
—
разность сумм теплоемкостей продуктов
реакции и исходных веществ.
Величина химического сродства помимо уравнений (1) и (2) определяется по изотерме Вант – Гоффа:
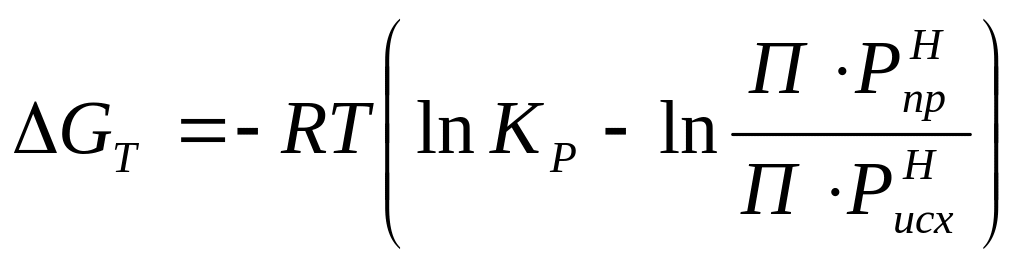 (3)
(3)
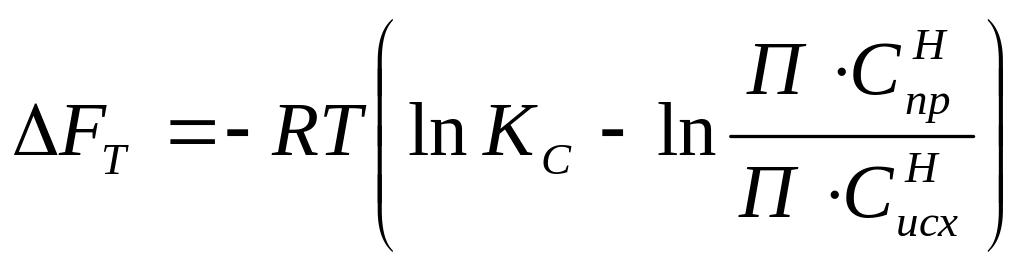 (4)
(4)
где - ПР![]() и
ПС
- произведения исходных неравновесных
давлений и концентраций исходных
реагентов химической реакции.
и
ПС
- произведения исходных неравновесных
давлений и концентраций исходных
реагентов химической реакции.
Для удобства сравнения различных
химических процессов по величине
химического сродства исходные
неравновесные давления и концентрации
реагентов химической реакций берутся
равными единице (Р![]() =1
и С
=1).
=1
и С
=1).
Химические сродство, когда исходные неравновесные концентрации и давления реагентов берутся равными единице, называется нормальным сродством. Изотерма нормального сродства Вант – Гоффа принимает вид:
![]() (5)
(5)
![]() (6)
(6)
Условием возможности протекания химический реакции (исходные вещества и продукты реакции находятся не в стандартном состоянии) в прямом направлении без затраты внешней работы является неравенство
![]()
Чем больше химическое сродство исходных веществ, т. е. чем больше отделена совокупность данных веществ от состояния равновесия для химически обратимых процессов, тем сильнее стремление системы к осуществлению процесса, тем больше убыль изобарного потенциала.
Когда изучаемая реакция прошла в прямом направлении, то в обратном направлении при данных Т и Р реакция невозможна, так как для противоположного процесса ∆GТ > 0. Это неравенство является индикатором принципиальной невозможности процесса в прямом направлении.
Когда в системе наступает химическое равновесие, изменение изобарного потенциала происходить не будет, т. е. ∆GТ = 0.
На рис. 1 показана схема изменения значений изобарного потенциала ∆GТ по мере протекания реакции. Исходные вещества характеризуются изобарным потенциалом в точке А, продукты реакции — в точке В. Положения равновесия не зависит от того, с какой стороны начат процесс .
Точка С – точка равновесия, когда ∆G = 0.
Линия АДС – линия сапроизвольного прямого процесса, где ∆G < 0.
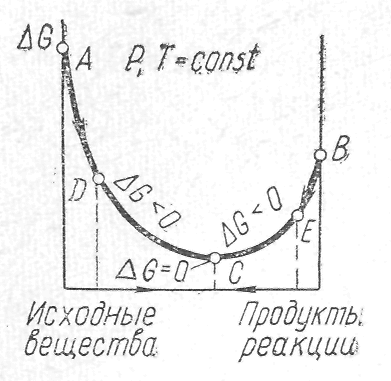
Рис 1. Схема изменения изобарного потенциала по мере
протекания реакции.
Линия ВЕС – линия сапроизвольного обратного процесса,
где ∆G < 0, если процесс начат с положения точки В.
Константа равновесия определяется из уравнений нормального сродства (5) и (6):
![]() (7)
(7)
![]() (8)
(8)
Расчет изобарных потенциалов и констант равновесия можно осуществлять приближенными и точными методами. Последними в отличие от приближенных методов учитывается влияние темпе-ратуры на изменение энтальпии и энтропии системы. Преимуществом всех приближенных методов расчета равновесий является небольшая трудоемкость, однако при этом уменьшается точность расчета.
Приближенные методы расчета равновесий следует применять для тех процессов, величина изобарного потенциала которых характеризуется большими положительными или отрицательными числами. Соответственно поэтому константы равновесия указанных реакций имеют или очень большую, или очень малую величину. Таким образом, приближенные методы расчета равновесий могут применяться для реакций, в результате протекания которых исходные вещества почти полностью исчезают или практически не расходуются.
Для расчетов
равновесий применяются стандартные
таблицы термодинамических функций. В
этих таблицах приведены величины
изменений энтальпии
![]() и изобарного потенциала
и изобарного потенциала
![]() соединений, а также абсолютные значения
соединений, а также абсолютные значения
![]() элементов и соединений. Все данные
таблиц отнесены к стандартному состоянию
— температуре 298,15 К и давлению 101,3 кПа.
Значения
и
в таблицах обычно приводятся в кДж/моль,
а
— в Дж/(моль-град).
элементов и соединений. Все данные
таблиц отнесены к стандартному состоянию
— температуре 298,15 К и давлению 101,3 кПа.
Значения
и
в таблицах обычно приводятся в кДж/моль,
а
— в Дж/(моль-град).
Для точных расчетов
констант равновесия КР
химических
реакций и значений
![]() ,
пользуются формулами М. И. Темкина и Л.
А. Шварцмана.
,
пользуются формулами М. И. Темкина и Л.
А. Шварцмана.
М. И. Темкин и Л. А. Шварцман уравнение (2) преобразовали в следующее:
![]() (9)
(9)
где и ∆ — разность стандартных значений энтальпий и энтропий продуктов реакции и исходных веществ; ∆а0, ∆аЬ ∆а2 и ∆а_2 —температурные коэффициенты теплоемкости М0, М1 М2, М-2 —температурные функции, которые даны в таблице Темкина – Шварцмана.
Рассмотрим еще один вид термодинамических функций и их изменения в результате химических реакций. Для систем, в которых отсутствует термодинамический процесс, можно написать следующее уравнение:
![]() (10)
(10)
Уравнение (10) представим в таком виде:
![]() (11)
(11)
Если из правой и
левой частей уравнения (11) вычесть
отношение
![]() ,
получим
,
получим
![]() (12)
(12)
где Т1 — температура, принимаемая в качестве базисной.
В большинстве случаев в качестве базисной температуры принимают 0 и реже 298,15 К. Для перехода от одного температурного базиса к другому пользуются уравнениями
![]() (13)
(13)
![]()
![]()
![]() (14)
(14)
где ∆Н![]() — тепловой эффект реакции при давлении
101,3 кПа и абсолютном нуле температуры.
Величину (Н
-Н
)/Т
называют
функцией энтальпии, а (
-Н
)/Т
— функцией свободной энергии (функцией
изобарного потенциала, функцией Гиббса).,
При базисной температуре 0 К часто
пользуются величиной
— тепловой эффект реакции при давлении
101,3 кПа и абсолютном нуле температуры.
Величину (Н
-Н
)/Т
называют
функцией энтальпии, а (
-Н
)/Т
— функцией свободной энергии (функцией
изобарного потенциала, функцией Гиббса).,
При базисной температуре 0 К часто
пользуются величиной
![]() (15)
(15)
называемой приведенным термодинамическим потенциалом или потенциалом Ф .
Термодинамические функции веществ можно вычислять квантово-статистическими методами. Для расчета , необходимо знать приведенные термодинамические потенциалы всех участвующих в реакции веществ и теплоту реакции при абсолютном нуле:
![]() (I6)
(I6)
где
![]() (17)
(17)
Индексы «кон» и «нач» относятся соответственно к продуктам реакции и исходным веществам.
Для расчета значений константы равновесия Кр пользуются уравнением
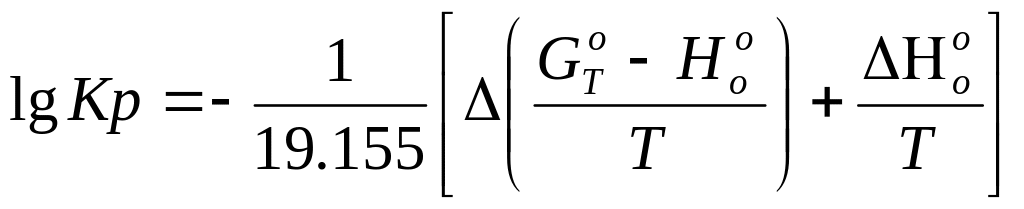 (I8)
(I8)
Вычислять энтальпию реакции при абсолютном нуле можно через приведенные энтальпии участвующих в реакции веществ и энтальпию реакции при температуре Т:
![]()
где
![]() (19)
(19)
При использовании приведенных термодинамических потенциалов на соответствующие термодинамические расчеты затрачивается меньше времени.
Глоссарии
Сталь - это сплавы железа, содержащие до 2,06% углерода (максимальная растворимость углерода в аустените, находящемся в равновесии с цементитом при эвтектической температуре).
Чугун - это сплавы железа, содержащие более 2,06% углерода.
Ферросплавы - это сплавы железа с другими элементами — марганцем, кремнием,хромом, молибденом, титаном, вольфрамом. Применяются
ферросплавы для раскисления и легирования стали.
Процессы окисления (горение топлива) протекают в горне доменной печи в неболыних объемах возле воздушных фурм. Конечным продуктом го- рения углерода кокса в горне доменной печи является окись углерода.
Процессы восстановления протекают во всем объеме доменной печи кроме окислительных зон в горне. В доменной печи восстанавливаются железо, марганец, кремний, фосфор и некоторые другие элементы. Главный гіроцесс — восстановление железа. Восстановителями в доменной печи являются окись углерода, водород и твердый углерод.
Проиессы нлавления чугуна и шлака развиваются в такой гю- следовательности. При работе доменной печи интенсивное восстановление окислов железа начинается на расстоянии 2,0—2,5 м от уровня засыпи.
Блиц – тест
|
Ростовцев. С.Т. |
Соколов. И.А. |
Павлов. М.А. |
Грум-гржимайло. В.Е. |
Байков. А.А. |
|
Рi =
|
P =
|
Р = (%i) Pi |
(%i) = Pi/Робщ |
Р =
|
|
С+О2=СО2 |
СО2+Н2=СО+Н2О |
2СО+О2=2СО2 |
2С+О2=2СО |
С+Н2О=СО2+2Н2 |
|
ΔG = -RT
|
ΔG = -RT
|
ΔG = -RT |
ΔG = -RT ln Kp |
Kp =
|
|
С = К - Ф + n |
К = Ф - n + с |
С = Ф – К + n |
С = К – n + Ф |
С = К - Ф - n |
|
MgО + СО2 = MgСО2 |
Н2 + СО = Н2О + СО2 |
FeО + СО = Fe + СО2 |
СаСО3 = СаО+СО2 |
С + О2 =СО2 |
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекции №2 «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
План лекции:
1.Физико – химические основы восстановительной переработки железорудного и комплексного сырья.
2. Физико – химические основы сталеплавильных процессов и принцип их организации.
3. Характеристика процессов в основных сталеплавильных агрегатов.
4.Физико – химические основы электросталеплавильного и ферросплавных процессов.
5.Особенности протекания окислительно – восстановительных процессов в зависимости от распределения температуры соотношения жидких и твердых фаз.
Цель лекции
ознакомление с основами восстановытелъной переработкы рудного сыръя
Дидактические единицы
Химические реакциы; диффузия; продукты химических реакций.
1. Учение о скоростях и механизме различных физико-механических процессов называется химической кинетикой. Скорости протекания химических реакций зависят от различных факторов- концентрации реагирующих веществ, давления, влияния интенсификаторов, катализаторов и др., а в случае гетерогенных превращений также от ряда других условий – состояния поверхности, условий тепло- и массообмена. В развитие учения о скоростях химических реакций и гетерогенных процессов большой вклад внесли работы Я. Вант-Гоффа, Н. А. Меншуткина, Н.А. Шилова, Н.Н. Семенова и др.
Тот факт, что химические реакции протекают с ускорением, имеет большое теоретические и прикладное значение. В черной и цветной металлургии в последние годы широко применяется кислород как интенсификатор металлургических процессов. Все большее значение для интенсификации технологических процессов приобретает температурный фактор.
2. В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных и гетерогенных химических реакций. Гомогенными называются такие химические реакции, в которых исходные вещества и продукты взаимодействия находятся в одной и той же фазе - газовой или жидкой, при этом молекулы, атомы, ионы взаимодействуют по всему занятому объему. Примером этого типа реакций могут служить реакции горения СО и Н2, входящих в состав конвертированного природного газа:
2СО+О2=2СО2; (1)
2Н2+О2=2Н2О. (2)
Гетерогенными называются такие химические реакции, когда участвующие в реакции вещества (включая и катализаторы) находятся в различных фазах, а сам процесс химического превращения протекает на границе раздела этих фаз. Примером гетерогенной химической реакции может служить реакция, протекающая в газовых регенераторах на поверхности раскаленных кусков твердого топлива:
С (углерод топлива) + О2 = СО2 (3)
СО2 + С(углерод топлива) = СО (4)

2С(углерод топлива) + О2 = 2СО (5)
К гетерогенным химическим реакциям относится реакция окисления углерода в ванне мартеновской печи. Схематически ее можно изобразить следующим образом:
(FеО) {CO}
↓ ↑
[Fe] + [C] = [Fe] + [CO] . (6)
Эта реакция происходит в три стадии:
диффузия кислорода (закиси железа) из шлака в металл;
химическая реакция между кислородом (закисью железа) углеродом в
металле;
3) выделение окиси углерода (продукт реакций) из металла.
3. Скорость сложной гетерогенной химической реакции определяется скоростью наиболее медленной стадии процесса. В рассматриваемой реакции (6) такой стадией является диффузия кислорода из шлака в металл.
Диффузией - называется процесс самопроизвольного выравнивания концентрации растворенного вещества, приводящий к установлению равномерного распределения концентраций в объеме раствора или расплава. Роль диффузии в кинетике гетерогенных процессов большая – чтобы процесс протекал с достаточной скоростью, продукты реакции должны удаляться с поверхности раздела фаз, что также происходит путем диффузии.
Движущей силой диффузии является
градиент концентрации
![]() ,
определяемой изменением концентрации
растворенного вещества dc,
приходящего на отрезок пути dx
в направлении диффузии.
,
определяемой изменением концентрации
растворенного вещества dc,
приходящего на отрезок пути dx
в направлении диффузии.
Количество переносимого путем диффузии вещества dm прямо пропорционально градиенту концентрации, площади поперечного сечения S среды, через которую происходит диффузия и времени dτ. Тогда
![]() =
=![]() ,
(7)
,
(7)
где D- коэффициент диффузии, а скорость диффузии
![]() =
=![]() .
(8)
.
(8)
I-закон Фика: Скорость молекулярной диффузии прямо пропорциональна сечению системы и градиенту концентрации.
Уравнение (8) описывает стационарную диффузию и называется первым законом Фика. Знак минус в уравнении Фика указывает на то, что вещество перемещается в направлении уменьшения концентрации, т.е. < 0.
Размерность коэффициента диффузии 1 см2/сек. Коэффициент зависит от природы диффундирующего вещества и среды, в которой происходит диффузия, от температуры и в меньшей степени от концентрации и давления. Наибольшая скорость диффузии наблюдается:
─ в газах (D ≈ 1см2/сек);
─ в жидкостях (D ≈ 10-5см2/сек);
─ в твердых телах (D ~10-8 см2/сек).
Значения коэффициента атомарной диффузии в расправленном (неподвижным) железе при 1500-16000С составляют 10-4 -10-5 см2 /сек. При окислении углерода в мартеновских печах и возникающем в результате этого перемешивании скорость массопереноса резко увеличивается – коэффициент турбулентной диффузии в зависимости от скорости окисления углерода находится пределах 25-82 см2/сек. При кислородно-конвертерном процессе, отличающемся значительно более высокими скоростями окисления углерода по сравнению с мартеновским, а также тем, что перемешивание металла и шлака происходит не только за счет образования окиси углерода, но и за счет энергии кислородной струи, значения коэффициента турбулентной диффузии могут достигать 20 000-25 000 см2 /сек. Из приведенных данных следует, что скорость массопереноса внутри ванны кислородного конвертера в миллионы раз больше атомарной диффузии и в тысячи раз выше, чем в мартеновским печи.
4. Если определяющей стадией процесса химической реакции является само химическое воздействие, то это означает, что реакция протекает в кинетической области. Если же определяющей стадией процесса является подвод реагирующего вещества в зону реакции за счет диффузии, то считается, что реакция протекает диффузионной области. В тех случаях, когда скорости химической реакции и диффузии соизмеримы, процесс является сложной функцией кинетических и диффузионных явлений и протекает в переходной области.
Основной величиной в химической кинетике является скорость реакции, под которой понимают количество вещества, реагирующего за единицу времени в единице объема. Средняя скорость химической реакции может быть определена по формуле:
![]() =
=
![]() (9)
(9)![]()
где с1 - концентрация вещества в начале реакции или в начале рассматриваемого отрезка времени;
с2 - концентрация вещества в конце реакции или в конце рассматриваемого отрезка времени;
τ - продолжительность химической реакции.
Истинная скорость реакции Vист представляет собой производную от концентрации ко времени:
Vист
=
![]() ,
(10)
,
(10)
где dc - бесконечно
малое изменение концентрации за
бесконечное малое время d![]() .
.
Различают реакции первого порядка (мономолекулярное), второго порядка (бимолекулярное) и т.д.
5. Реакцию первого порядка схематически можно представить следующем уравнением:
А → Продукт реакции. (11)
К числу таких реакций относится:
Н2→2Н; (12)
Н2О2→Н2О2+![]() О2.
(13)
О2.
(13)
В соответствии с уравнением (11) и I законом действующих масс (I ЗДМ), скорость мономолекулярной реакции, или реакции первого порядка, выражается следующем образом:
![]() ,
(14)
,
(14)
или
![]() .
(15)
.
(15)
После интегрирования уравнения (15) в пределах концентраций от Со (начальная) до С (конечная) и времени от 0 до получим
![]() (16)
(16)
Уравнение (16) можно записать в таком виде:
![]()
где а - начальная концентрация вещества;
х - изменение концентрации за время τ;
а - х - конечная концентрация вещества.
Реакции, константы скорости которых выражаются уравнениями (16) и (17), называются реакциями первого порядка.
Порядком называется показатель степени при концентрации в кинетическом уравнении скорости процесса:
![]()
Реакцию второго порядка схематически можно представить следующим образом:
А + В → Продукт реакции. (18)
Скорость химической реакции второго порядка зависит от концентрации двух участвующих в реакции веществ.
![]() (19)
(19)
В том случае, если концентрации С1 и С2 неодинаковы, константы скорости реакции второго порядка можно определить по следующему уравнению:
![]() ,
(20)
,
(20)
где а - начальная концентрация первого вещества;
b - начальная концентрация второго вещества;
х - уменьшение концентрации каждого вещества за время τ.
Если С1 = С2 (или а = b), то уравнение (19) принимает вид
![]() .
(21)
.
(21)
После интегрирование и соответствующей замены концентраций
![]() (22)
(22)
Реакции, константа скорости которых выражается уравнениями (21) и (22), называются реакция второго порядка.
Порядок реакции не всегда совпадает с ее молекулярностью. Для характеристики реакций первого порядка наряду с константой скорости часто пользуются периодом полураспада τ, равным времени, в течение которого реагирует половина взятого количества вещества.
Момент времени, отвечающей концу периода полураспада, можно определить из следующего уравнения:
lnτ= (23)
(23)
оттуда
![]() ln2
ln2![]() 0,6932,
0,6932,
или
![]() (24)
(24)
Скорость реакции третьего порядка для трех разнородных молекул пропорциональна произведению концентрацию реагирующих веществ в данный момент времени:
![]() (25)
(25)
Если две или три молекулы однородны, это уравнение принимает следующий вид:
![]() ,
(26)
,
(26)
или
![]() (27)
(27)
Примером реакции третьего порядка может быть реакция
2FeCl3+SnCl2→2FeCl2+SnCl4, (28)
Которая протекает в водном растворе. Уравнение скорости этой реакции можно записать так:
![]() (29)
(29)
где с1 - концентрация хлорного железа;
с2 - концентрация хлористого олова;
Вычислим константу скорости этой реакции. Пусть в объеме V до начала реакции было 2α молей хлористого олова и 2α молей хлористого железа. Через отрезок времени τ прореагировало α молей хлористого олова и 2α молей хлористого железа. Следовательно, концентрация в момент времени τ:
с![]() ;
с
;
с![]() и
и
![]()
Подставим значения концентраций в уравнение скорости (29), тогда
![]() (30)
(30)
где
![]()
Разделим переменные, тогда
![]() (31)
(31)
После интегрирования уравнения, полагая, что если τ = 0, то х = 0, запишем
![]() (32)
(32)
Из уравнения (32) следует, что константа скорости реакции третьего порядка зависит от квадрата объема системы.
Скорость химической реакции зависит от того, является ли она поверхностной (идущей на поверхности фаз), или объемной. Примером поверхностной реакции может служит реакция окисления марганца на границе металл - шлак.
[Mn] + (FeO) → (MnO) + [Fe], (33)
а примером объемной – раскисление стали алюминием
3[FeO] + 2[Al] → (Al2O3) + [Fe]. (34)
С повышением температуры скорость большинства реакций увеличивается. Зависимость константы скорости от температуры в области высоких температур выражается уравнением С. Аррениуса согласно правилу Аррениуса:
Логарифм константы скорости прямолинейно зависит от обратной температуры процесса.
![]() (35)
(35)
Постоянные уравнения (35) определяются графически:
 lnk
lnk
l


 n
k2
n
k2
![]() ;
;
 ∆x
∆x
l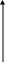
 n
kx
α
1)
n
kx
α
1)![]()

 x
2)
x
2)![]()
Из анализа уравнения (35) следует,
В=lnK0 что правила Аррениуса фактически
 0
представляет собой неопределенный
0
представляет собой неопределенный
1/T1 1/Tx 1/T интеграл изобары Вант-Гоффа:
![]() .
(36)
.
(36)
Где Кр – константа
равновесия равная
![]() определяемая
как отношение константы скоростей
прямой и обратной реакции из I
- закона ЗДМ.
определяемая
как отношение константы скоростей
прямой и обратной реакции из I
- закона ЗДМ.
∆Н - изменения энтальпии (тепловой эффект) процесса химического взаимодействия.
Тогда уравнение (36) можно вид как:
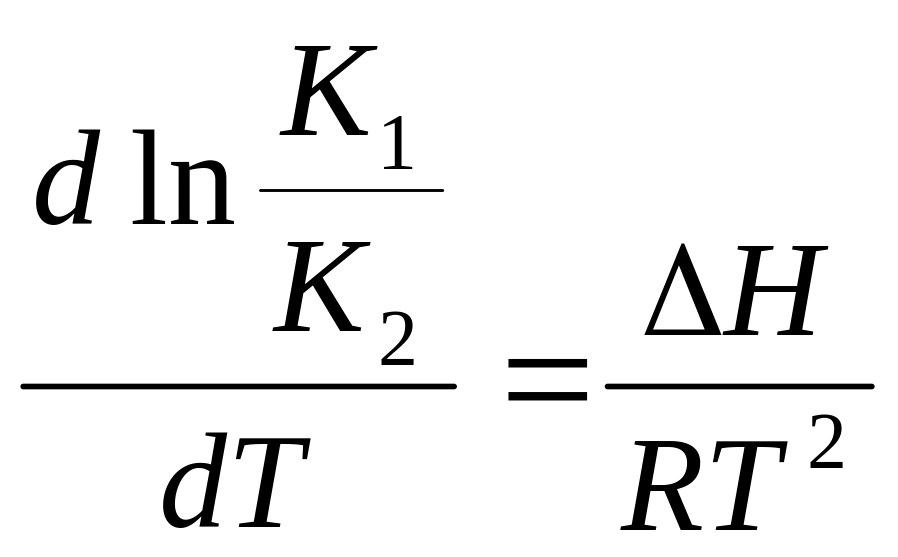 или
или
как два уравнения:
![]() и
и
![]() (36)
(36)
где Е1 и Е2 − энергия активаций прямой и обратной реакций.
Если взять определенный интеграл из уравнений (36∕) при двух температурах, получим:
![]() (37)
(37)
Из которого можно определить, если будут известны:
Ех (Т1,
Т2, К1, К2), где Ех/ап
=

Тх (Е, К1, К2, Т1)
Кх (Е,Т1, Т2, К1)
В области низких температур скорость подчиняется правилу Вант- Гоффа:
В области низких температур при повышении температуры на каждые 10 градусов возрастает скорость в кинетической области в 2÷4 раза в дифференциальной области в 1,1 ÷ 1,5 раза.
![]()
 2÷4
2÷4
![]() 1,1
÷ 1,5
1,1
÷ 1,5
![]()
![]()


Необходимым условием для протекания химической реакции являются столкновения молекул или атомов. Если все реагирующие вещества находятся в газообразном состоянии, то, число столкновений, испытываемых каждой молекул газа, очень велико и достигает десятков миллиардов в секунду. Из этого следует, что в реакциях, протекающих с определенными скоростями, а не мгновенно, химическое взаимодействие вызывает какая – то малая часть столкновений.
Только те из сталкивающихся молекул вступают в химическое взаимодействие, которые обладают избыточной энергией. Это – так называемые активные молекулы. Соотношение между активными и неактивными молекулами определяется законом распределения Максвелла – Больцмана и выражается следующим уравнением:
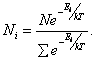
где Nакт – число активных молекул; Nобщ − общее число молекул; е − основание натурального логарифма;
Е − энергия активации, дж/моль (кал/моль); R − универсальная газовая постоянная; Т − абсолютная температура, о К
Из этого уравнения следует, чем выше температура и чем ниже энергия активации Е, тем больше число активных молекул Nакт, способных к химическому взаимодействию.
Таким образом, эффективными оказываются столкновения только между такими молекулами, которые к моменту столкновения обладают некоторыми избытками внутренней энергией по сравнению со средней для данной температуры величиной. Этот избыток энергии и характеризуется энергией активации.
На графике изменения энергии реагирующей системы. Если реакция прямая (переход из состояния 1 в состояние 2 является экзотермической реакцией), то общий запас энергии продуктов реакций меньше, чем исходных веществ, и система в результате этой реакции переходит на более низкий энергетический уровень. Разница уровней 1 и 2 численно равна тепловому эффекту реакции.
Уровень К определяет тот наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли привести к химической реакции. Разность между уровнем к и уровнем 1 представляет собой энергию активации Е1 прямой реакции, а разность между уровнем к и уровнем 2 – энергию активации Е2 обратной реакции. Таким образом, по пути от исходного состояния в конечное система должна перейти через своего рода энергетический барьер.
Очевидно, чем ниже этот барьер (уровень К ), т.е. чем меньше энергия активации, тем большая доля молекул в каждый данный момент является способной к реакции и тем более высокой будет скорость реакции.
Энергия активации основной физико – химической реакции сталеплавильных процессов – реакции окисления углерода – составляет 147 -168 кдж/моль (35-40 ккал/моль). Зависимость скорости реакции в сталеплавильной ванне от концентрации реагирующих веществ, температуры и величины энергии активации можно представить следующим уравнением:
в экспоненциальной форме согласно уравнения (35)
К = lnВ
![]() или К = Ко
или К = Ко
![]() ,
а скорость:
,
а скорость:
V = k![]() (FeO)[C]e
(FeO)[C]e![]()
где k - константа скорости окисления кислорода;
(FeO) – концентрация FeO в слое шлака, соприкасающегося с металлом, % (по массе);
[C] – концентрация углерода в металле, % (по массе);
е – основание, натурального логарифма;
R – универсальная газовая постоянная;
Т – температура, о К.
При температурах сталеплавильных процессов скорость движения атомов (ионов) углерода и кислорода составляет примерно 240 м/сек. В этих условиях частица углерода имеет возможность около 100 раз в секунду столкнуться с частицей кислорода, т.е. реакция окисления углерода в сталеплавильной ванне имеет взрывной характер.
Сравнительно малые фактические скорости окисления углерода в сталеплавильной ванне обусловлены тем, что рассматриваемая реакция является сложной и ее скорость определяется скоростью наиболее медленной стадии. Последней является поступление кислорода в зону реакции. Лимитировать эту реакцию может также выделение окиси углерода из металла.
Явление изменения скорости химической реакции под влиянием веществ не являющихся реагентами называется катализом. Наряду с катализаторами, увеличивающими скорость реакции, имеются отрицательные катализаторы, называемые ингибиторами, которые замедляют реакции.
Реакции, протекающие вначале с небольшой скоростью, а затем постепенно ускоряющиеся, называются автокаталитическими. Такое явление, получившее название автокатализа, объясняется тем, что один из образующихся продуктов играет роль катализатора.
Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор образует одну фазу с реагирующей гомогенной системой. Гетерогенный катализ характерен тем, что катализатор образует обособленную фазу (например, синтез аммиака на платиновой сетке).
Для объяснения катализа предложено несколько различных теорий: химическая (теория промежуточных соединений), физическая (различные варианты адсорбционных теорий), электронная и цепная. В гомогенном катализе наибольшее распространение получила теория промежуточных соединений, развитая в работах Н.Д. Зелинского и его учеников. Основными в этой теории являются следующие положения:
1) катализатор активно вступает в химические реакции с исходными веществами, образуя неустойчивые промежуточные соединения, последующие превращения которых приводят к образованию необходимых продуктов реакции и регенерации катализатора;
2) химическое взаимодействие катализатора с исходными веществами изменяет термохимический путь реакции, в результате чего уменьшается энергия активации и увеличивается скорость реакции в случае отрицательного катализа.
Схему гомогенного катализа можно представить следующим образом:
А + В → АВ – реакция протекает медленно;
А + К → АК – реакция протекает быстро;
АК + В → АВ + К – реакция протекает быстро.
Реакция окисления сернистой кислоты в серную протекает по такой схеме:
2Н2SО3 + О2 = 2Н2 SО4 - реакция протекает медленно;
О2 + 2NO = 2NO2 – реакция протекает быстро;
NO2 + Н2SО3 = Н2SО4 + NO – реакция протекает быстро.
Катализатором в данном случае является окись азота NO, а промежуточным соединением – двуокись азота NO2.
При изучении механизма гетерогенного катализа большое значение имеют два положения, обоснованные опытными данными:
1) Катализ связан с адсорбцией реагирующих веществ на поверхности раздела фаз;
2) В каталитической реакции принимает участие не вся поверхность катализатора, а лишь часть ее, составленная из совокупности отдельных участков, называемых активными центрами.
В настоящее время существует несколько теорий, объясняющих строение активных центров и явление гетерогенного катализа. Так, согласно мультиплетной теории А.А. Баландина, активными центрами на поверхности катализатора являются мультиплеты. Последнее представляет собой совокупность двух, трех или шести поверхностных атомов катализатора, которые участвуют в акте химического превращения, протекающего его поверхности.
Согласно теории мультиплетов, места, к которым прикрепляются превращаемые молекулы, расположены на поверхности катализатора геометрически правильно, соответственно расположению атомов в кристаллической решетке. Если около активного центра закрепляются два атома, то между ними может возникнуть химическая связь, при этом связь этих атомов с другими атомами значительно ослабевает. Таким образом, создаются предпосылки для химического превращения.
Цепная теория катализа, развитая Н.Н. Семеновым и В.В. Воеводским, основана на том, что на поверхности катализатора имеются свободные положительные и отрицательные валентности, взаимодействие которых с валентно насыщенными молекулами исходных веществ приводит к образованию радикалов. Последние активно вступают в реакции с другими адсорбированным на поверхности радикалами м с молекулами газовой или жидкой фазы.
В основе электронной теории катализа лежит представление о том, что свободная или слабосвязанная электроны катализатора делают его радикалоподобным, в результате чего обеспечивается ускорение реакции, протекающей на поверхности катализатора.
Активность катализатора зависит от многих факторов. При неизменных условиях скорость каталитической реакции пропорционально количеству катализатора (для небольших количеств). Так, скорость реакции разложения перекиси водорода в присутствии иода (гомогенный катализ), которая протекает в две стадии по термохимическим уравнениям:
Н2О2 + I2 = 2НI + О2
Н2О2 + 2НI = 2Н2О + I2
Пропорциональна количеству иода.
Активность катализатора может быть резко повышена или понижена различными добавками. Добавки. Увеличивающие активность катализатора, называются промоторами или активаторами, а сам процесс повышения активностей добавками катализаторов называется промотированием. Так, активность никелевого катализатора по отношению к реакции гидрирования СО до СН4 увеличивается в 10 раз после добавления к нему 0,5 % окиси церия (СеО) или окиси тория (ТҺ).
При гетерогенном катализе катализатор работает только своей поверхностью, которая по количеству составляет небольшую часть от всей массы катализатора. Для экономии таких катализаторов, как платина (Pt), золото (Au), серебро (Ag), осмий (Os), иридий (Ir) и другие применяются так называемые адсорбционные (наносные) катализаторы, получаемые путем нанесения их на пористые или малоактивные вещества – уголь, пемзу, силикогель, алюмогель, тальк, асбест и др.
Глоссарии
Гомогенными называются такие химические реакции, в которых исходные вещества и продукты взаимодействия находятся в одной и той же фазе - газовой или жидкой, при этом молекулы, атомы, ионы взаимодействуют по всему занятому объему.
Гетерогенным и называются такие химические реакции, когда участвующие в реакции вещества (включая и катализаторы) находятся в различных фазах, а сам процесс химического превращения протекает на границе раздела этих фаз.
Диффузией - называется процесс самопроизвольнош выравнивания концентрации растворенного вещества, приводящий к установлению равномерного распределения концентраций в объеме раствора или расплава. Роль диффузии в кинетике гетерогенных процессов большая - чтобы процесс протекал с достаточной скоростыо, продукты реакции должны удаляться с поверхности раздела фаз, что также происходит путем диффузии.
Блиц – тест
|
|
|
|
|
|
А. lnKp =
В. Kp =
С.
D. ln = E.
lnKp =
|
Литература:
Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
Лекции №3 «Термодинамика и закономерности взаимодействия газов и сложных газовых атмосфер»
План лекции:
1. Механизм взаимодействия реагентов с окислителем в газовых смесях.
2. Баланс взаимодействия и образования газов.
3. Диссоциация газов на атомы и радикалы.
4. Термодинамический анализ процессов диссоциации.
5. Состав и свойства газов и низкотемпературной плазмы. Образование и диссоциация химических соединений.
6. Термодинамический анализ процессов образования и диссоциации соединений в гетерогенных системах.
7. Газообразная и конденсатная диссоциация их особенности.
Цель лекции:
Ознакомление с закономерностями взаимодействия в газовых атмосферах
Дидактические единицы
Горение; диссоциация газов.
1. Процессы горения широко используются в промышленности, в частности в металлургии, для получения топлива и высоких температур, так как реакции горения сопровождаются значительным выделением тепла и протекают достаточно быстро.
В узком смысле под горением понимают реакции взаимодействия веществ с кислородом, источником которого чаще всего служит атмосферный воздух. Значительные перспективы имеет применение технически чистого кислорода и его смесей с воздухом.
Обычно в качестве топлива используют горючие вещества органического происхождения, т. к. они удовлетворяют основным требованиям, предъявляемым к техническому топливу:
– значительный тепловой эффект реакции окисления элементов (углерода и водорода, входящих в органическое вещество)
– распространенность в природе
– невысокая стоимость
– газообразное состояние и относительная безвредность реакции.
Газы, получающиеся при горении, обычно активно участвуют в металлургических процессах.
Из всех видов топлива в черной металлургии наибольшие значение имеют каменноугольный кокс – основное горючие в доменном производстве, а также горючие газы (доменный, коксовальный, генераторный, природный) и мазут, применяемые в мартеновском производстве и в различных нагревательных устройствах.
В твердом топливе важнейшей горючей составляющей является углерод, а в газообразном окись углерода и водород. Последней в заметных количествах содержится также в твердом и жидком топливе. В горючих газах водород находится как в свободном состоянии, так и в различных соединениях (углеводороды и т.п.)
Таким образом, химическая сторона горения топлива сводится главным образом к многочисленным реакциям взаимодействия углерода, водорода и соединений, содержащих эти элементы с кислородом.
В настоящем курсе рассмотрим наиболее важные для металлургии реакции в системах углерод – кислород и углерод – кислород – водород :
Неполное горение углерода: 2С

Полное горение углерода: С
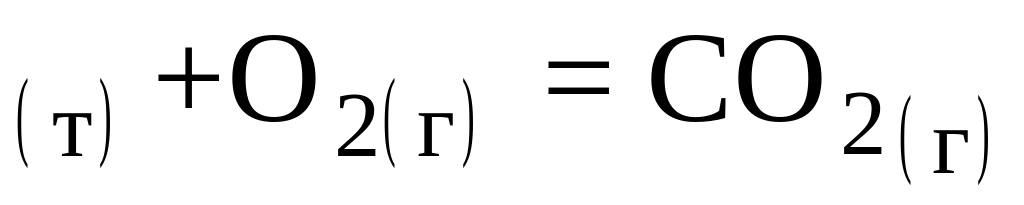
3. Горение окиси углерода СО:
2СО![]()
4. Взаимодействие двуокиси
углерода
![]() с углеродом:
с углеродом:
![]()
5. Горение водорода: 2![]()
6. Взаимодействие водяного пара
с углеродом: С![]()
7. То же: С![]()
8. Реакция водяного газа: С![]()
Среди них реакции 3, 5 и 8 гомогенные и протекают в пределах газообразной фазы. Остальные гетерогенные, в которых твердый углерод взаимодействует с кислород содержащими газами.