
- •Оглавление
- •Введение
- •1. Основные понятия и определения
- •2. Равновесная термодинамика
- •3. Отклонения от равновесия – термодинамический подход
- •4. Термодинамические основы описания неравновесных систем
- •4.1. Принцип локального равновесия
- •4.2. Линейная термодинамика – первый закон Онзагера
- •4.3. Линейная термодинамика – определение термодинамических сил, 2-ой и 3-ий законы Онзагера
- •4.4. Линейная термодинамика – диффузионные задачи
- •4.5 Линейная термодинамика – принцип Пригожина
- •5. Область нелинейных законов – универсальный критерий эволюции систем
- •6. Самоорганизация и диссипативные структуры
- •6.1. Увеличение степени порядка в неравновесных системах
- •6.2. Самоорганизация – эффект Бенара
- •6.3. Самоорганизация – эффект Бенара.
- •6.3. Самоорганизация – эффект Тейлора
- •6.4. Самоорганизация – реакция Белоусова-Жаботинского
- •6.5. Диссипативные структуры – свойства, классификация, условия существования
- •7. Нелинейная термодинамика – динамические модели процессов с одной переменной
- •7.1. Динамические уравнения
- •Динамические уравнения процессов с одной переменной
- •7.2. Эволюция систем – метод потенциала
- •7.3. Автокатализ, динамика популяций
- •7.4. Автокатализ с ветвлением, бифуркации – неравновесные фазовые переходы
- •7.5. Ангармонический осциллятор – нарушение временной симметрии
- •7.6. Эволюция систем – анализ динамической функции
- •8. Нелинейная термодинамика –динамические модели процессов с двумя переменными
- •8.1. Точечные конечные состояния, классификация, фазовые портреты, эволюция систем
- •8.2. Предельные циклы
- •9. Общие вопросы устойчивости нелинейных систем
- •9.1. Устойчивость по траектории
- •9.2. Орбитальная устойчивость
- •9.3. Структурная устойчивость
- •10. Теория катастроф – взгляд со стороны
- •10.1. Катастрофы и анализ структурной устойчивости
- •10.2. Катастрофа «складка»
- •10.3. Катастрофа «сборка»
- •11. Активные среды
- •11.1. Бистабильные среды
- •11.2. Возбудимые среды
- •Библиографический список
- •Приложение Дополнительные темы: Устойчивость систем с n переменными. Критерии устойчивости. Функция Ляпунова.
- •Критерии устойчивости. Функция Ляпунова.
7.2. Эволюция систем – метод потенциала
Будем считать, что модель градиентная и проанализируем ее с помощью потенциала. Введем понятие потенциала – функции V(q)
![]() ,
,
![]() (7.8)
(7.8)
В механике потенциал - это работа перемещения тела в поле силы F, взятая с обратным знаком. Понятие потенциала нам пригодится не только в механике. Следует учитывать, что его физическая трактовка не всегда будет столь наглядной, как в механике.
В данном разделе мы будем рассматривать только градиентные системы. Используем вначале понятие потенциала для анализа линейных механической и химической систем, а затем перейдем к нелинейным моделям.
Пример
1. Проанализируем
с помощью потенциала состояние равновесия
линейной механической системы -
гармонического осциллятора
![]() .
В соответствии с определением потенциал
в данном случае запишется следующим
образом
.
В соответствии с определением потенциал
в данном случае запишется следующим
образом
![]() .
.
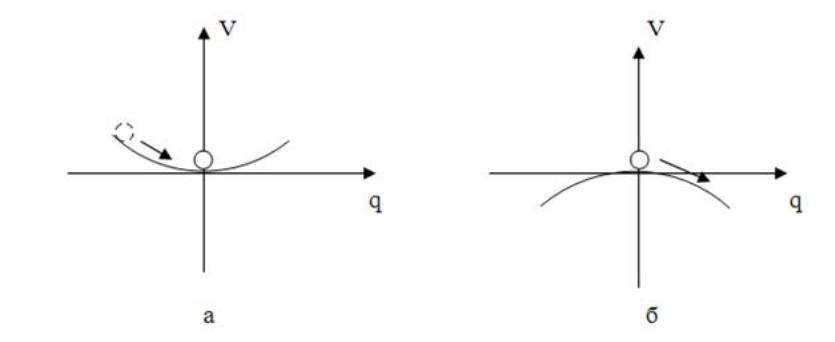
Рис.7.1. Механический потенциал гармонического осциллятора: а – k > 0; б - k < 0
Кривая потенциала представляет собой параболу, которая при k > 0 находится в положительной полуплоскости, а при к0 в отрицательной. Это представлено на рис.7.1. При k > 0 реализуется устойчивое состояние равновесия - система-шарик скатывается на дно оврага и остается там неограниченно долго.
При k 0 - неустойчивое состояние равновесия - шарик скатывается с вершины горы и уходит на бесконечность. При k = 0 происходит переход от устойчивого равновесия к неустойчивому (или наоборот). Графически зависимость равновесного значения координаты qe от константы k, показана на рис.7.2. При k > 0 устойчивому равновесию соответствует нулевое значение координаты- qe = 0 ( на рисунке в правой полуплоскости нулевое значение qe выделено двумя сплошными линиями вблизи оси абсцисс). При k < 0 - равновесие неустойчивое (qe по- прежнему равно нулю, но чтобы показать, что равновесие неустойчивое, на рисунке в левой полуплоскости оно выделено двумя пунктирными линиями).
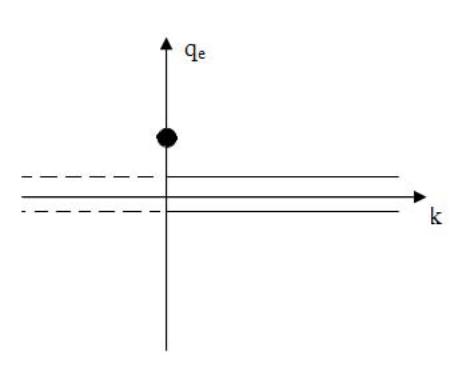
Рис.7.2. Диаграмма зависимости равновесных значений координаты от постоянного параметра k
Пример 2. Проанализируем протекание реакции разложения и производства компонента X (линейная система)
A ↔ X
Скорость изменения концентрации компонента Х - (dCx/dt) - можно определить из кинетического уравнения
![]() (7.9)
(7.9)
где СА, Сх - концентрация веществ А и Х соответственно (и в дальнейшем нижний индекс при концентрации будет указывать, о каком веществе идет речь); Ф - приток компонента Х (химическая система открыта), k1 и k-1 – константы скоростей прямой и обратной реакций.
Если Ф постоянен, то стационарное состояние находим, приравняв dCx/dt к нулю. Обозначив значение концентрации, соответствующее стационарному состоянию, через С0 и решив стационарное кинетическое уравнение получим
![]() (7.10)
(7.10)
Для исходного уравнения легко получить решение, которое будет выглядеть следующим образом
![]() ,
(7.11)
,
(7.11)
где Сх(0)- концентрация компонента Х в начальный момент времени.
Как и для гармонического осциллятора для анализа данной реакции можно построить потенциал. Так как приведенное уравнение аналогично уравнению гармоничного осциллятора, то потенциал в этом случае будет иметь тот же вид. Отличие лишь в том что поскольку k-1 всегда положительно, то случай, соответствующий рис.7.1б, не реализуется, а значит стационарное состояние С0 будет всегда устойчивым.
Таким
образом, исследование линейной системы
- химической реакции
![]() -
с помощью потенциала подтверждает вывод
термодинамики линейных процессов:
стационарное состояние в системе
единственное и устойчивое.
-
с помощью потенциала подтверждает вывод
термодинамики линейных процессов:
стационарное состояние в системе
единственное и устойчивое.
