
- •Общая патология
- •Введение
- •Стадии болезни и ее исходы.
- •Этиология, общий патогенез и роль реактивности
- •Острая недостаточность сердца
- •Роль реактивност организма в патологии
- •1. Абсолютная или естественная резистентность.
- •2. Относительная резистентность.
- •Действие на организм низких температур.
- •Отморожения.
- •Замерзание
- •Простуда
- •Действие на организм высокой температуры
- •Ожоговая болезнь
- •Перегревание
- •Действие радиации
- •Первичные эффекты ионизирующего излучения
- •Влияние ионизирующей радиации на клетки.
- •Влияние радиации на уровне тканей
- •Действие радиации на уровне организма
- •Принципы предупреждения и лечения лучевой болезни.
- •Действие на организм электрического тока.
- •Влияние физических параметров электрического тока на электротравму.
- •Влияние состояния организма и факторов внешней среды на электротравму.
- •Электрический шок
- •Профилактика и терапия электротравмы.
- •Действие на организм измененного барометрического давления гипербария.
- •Гипобария.
- •Баротравма.
- •Действия ударной волны.
- •Действие ударной волны на организм.
- •Действие на организм изменений парциального давления кислорода.
- •Влияние длительного действия линейных и радиальных ускорений. Перегрузки.
- •Кинетозы.
- •Пространственная дезориентировка
- •Жизнедеятельности организма.
- •Патофизиология наследственных болезней.
- •Этиология наследствкенных заболеваний
- •Методы изучения наследственной патологии
- •Основы популяционной генетики и экогенетики.
- •Патология клетки. Повреждение.
- •Дистрофия.
- •Паренхиматозные дистрофии.
- •Патология восприятия сигналов.
- •Патология клеточных органелл.
- •Патофизиология повреждения клетки.
- •Специфические проявления.
- •Неспецифические (или общие) проявления.
- •I. Фаза начальных изменений.
- •2. Фаза обратимых изменений.
- •3. Фаза необратимых изменений.
- •Механизмы адаптации клеток к повреждению.
- •Типовые формы повреждения клетки.
- •Патология клеточных популяций. Движение клеток и их патология.
- •Внутренние движения.
- •Перемещение всей клетки в окружающей среде
- •2. Общая характеристика структуры микроциркуляторного русла.
- •3. Регуляция микроциркуляторного кровотока.
- •6. Нарушения коагуляции и тромбоэмболизм.
- •7. Изменение скорости кровотока.
- •8. Изменение формы и местонахождения эндотелиальных клеток.
- •9. Нарушение проницаемости стенок сосудов.
- •10. Прилипание форменных элементов крови к эндотелию.
- •11. Диапедез форменных элементов
- •12. Микрокровоизлияния.
- •13. Реакция тучных клеток на патологические стимулы.
- •14. Микроциркуляция и нейродистрофический процесс (синдром регенераторно-пластической недостаточности).
- •15. Недостаточность лимфообращения.
- •16. Нарушения обмена жидкостью между кровью и тканями. Местные отеки.
- •Нарушения периферического кровообращения: Артериальная и венозная гиперемия, ишемия, стаз.
- •I.Артериальная гиперемия.
- •Изменение гемо- и лимфодинамики и клинические проявления артериальной гиперемии.
- •Значение артериальной гиперемии для организма.
- •II. Венозная гиперемия
- •Гемодинамика и клинические проявления венозной гиперемии.
- •Значение венозной гиперемии для организма.
- •III. Ишемия
- •Гемодинамика и клинические признаки ишемии.
- •Последствия и исходы ишемии.
- •Тромбоз
- •Венозный тромбоз:
- •Эмболия
- •Типы эмболии по материалу, переносимому током крови
- •При неадекватно проводимой ивл в условиях гипербарической оксигенации.
- •Жировая эмболия.
- •Острое и хроническое воспаление
- •Хронической воспаление.
- •Иммунопатологические процессы.
- •Классификация и характеристика аллергенов:
- •Центральные и периферические органы иммунной системы.
- •Клетки иммунной системы.
- •Макрофаги и дендритные клетки
- •Гипоксия
- •Классификация гипоксических состояний.
- •Нарушение функции органов и систем.
- •I. Срочная адаптация к гипоксии.
- •Гипероксия: её роль в патологии. Гипербарическая оксигенация, патофизиологические механизмы.
- •Патофизиология инфекционного процесса.
- •Опухолевый рост: общая характеристика.
- •Этиология опухолей
- •Стадии развития и общий патогенез опухолевого роста.
- •Взаимоотношение опухоли и организма
- •Системные изменения в организме при развитии опухолей
- •Антибластомная резистентность организма
- •Экстремальные состояния. Учение г. Селье о стрессе.
- •Генерализованный адаптационный синдром (гас).
- •Травматический шок
- •Патогенез травматического шока.
- •Неадекватная импульсация из поврежденных тканей.
- •Местная крово- и плазмопотеря.
- •Нарушения обмена веществ.
- •Поступление в кровь биологически активных веществ.
- •Нарушения функций поврежденных органов
- •Коллапс
- •Обоснование терапии.
- •Патофизиология энергетического обмена.
- •Основной обмен и его изменения при патологии
- •Нарушение водно-электролитного обмена
- •Принципы классификации и основные виды расстройства водного обмена.
- •Избыточное накопление воды в организме (гипергидротация, гипергидрия).
- •Обезвоживание организма.
- •Отеки, их патогенетические факторы.
- •Патофизиология некоторых клинических форм патологии обмена воды и электролитов
- •Нарушения обмена электролитов
- •Патология кислотно-основного обмена.
- •Показатели кислотно-основного равновесия и газов в крови в норме
- •Нарушения углеводного обмена
- •Нарушение усвоения углеводов в организме.
- •Общие признаки синдромов нарушения всасывания углеводов:
- •Гипогликемия.
- •1. Спонтанный сахарный диабет:
- •2. Вторичный диабет
- •3. Нарушение толерантности к глюкозе (латентный диабет)
- •4. Диабет беременных (нарушение толерантности к глюкозе во время беременности).
- •Патофизиология липидного обмена
- •6) Участие в усвоении жирорастворимых витаминов (а, д, е, к).
- •Процессы усвоения и всасывания липидов, их нарушения.
- •Алиментарная жировая недостаточность.
- •Нарушения механизмов транспорта липидов.
- •Общий патогенез атеросклероза.
- •Вторичное ожирение.
- •Стеатоз (ожирение печени).
- •Нарушения межуточного обмена липидов.
- •Патология белкового обмена
- •Потребности в белках.
- •Потребность в белках.
- •Содержание белка в некоторых пищевых продуктах г/100 г
- •Сыры 20-35
- •III. Обмен белков в организме
- •IV. Строение и классификация белков.
- •Биологические функции белков:
- •Нарушения белкового обмена.
- •Алиментарный маразм. (атрексия, кахексия, чрезмерное исхудание).
- •Квашиоркор
- •Следующий этап метаболизма белков - переваривание и всасывание в желудочно-кишечном тракте.
- •Нарушения регуляции синтеза белка (нейроэндокринной и субстратной)
- •Кортикостироиды (кортизол, кортикостерон):
- •Инсулин:
- •5.Глюкогон:
- •Увеличение синтеза белка наблюдается при:
- •Используются также и ингибиторы синтеза белка:
- •Нарушение синтеза белка, связанные с патологическими мутациями в генах.
- •Фенилкетонурия (болезнь Феллинга).
- •Наследственная тирозинемия.
- •Алкаптонурия.
- •Гистидинемия.
- •Гомоцистеинурия.
- •Аргининянтарная аминоацидурия.
- •Синдром Леша-Нихена.
- •Первичные гипопротеинемии.
- •Вторичные гипопротеинемии.
- •Патология нуклеинового обмена.
- •Патология обмена пуринов
- •Этиология подагры
- •Патогенез подагры
- •Другие нарушения пуринового обмена
- •Нарушения обмена пиримидиновых оснований
- •Патофизиология красной крови Анемии.
- •Анемии. Определение. Понятия. Принципы классификации.
- •Острая постгеморрагическая анемия.
- •Хроническая постгеморрагическая анемия.
- •Железодефицитная анемия.
- •Этиология железодефицитной анемии.
- •Этиопатогенетическая классификация железодефицитных анемий.
- •Клинико-гематологические проявления железодефицитной анемии.
- •Анемии, связанные с дефицитом витамина в12 (мегалобластические).
- •Этиология в12 – дефицитной анемии.
- •Анемии, связанные с дефицитом фолиевой кислоты.
- •Этиология фолиеводефицитной анемии.
- •Апластические анемии и синдром костномозговой недостаточности.
- •Этиопатогеническая классификация апластических анемий.
- •Конституционная апластическая анемия (анемия Фанкони).
- •Анемии, связанные с нарушением синтеза и утилизации порфиринов.
- •Наследственные анемии, связанные с нарушением синтеза порфиринов.
- •Приобретенные анемии, связанные с нарушением синтеза порфиринов.
- •Гемолитические анемии.
- •Классификация гемолитических анемий.
- •Классификация гемолитических анемий (Идельсон л.И.).
- •Наследственный микросфероцитоз (болезнь Минковского-Шоффара).
- •Наследственные гемолитические анемии, связанные с нарушением активности ферментов эритроцитов.
- •Серповидноклеточная анемия (ска).
- •Талассемии.
- •Приобретенные гемолитические анемии.
- •I. Гемолитические анемии, связанные с воздействием антител (иммунные гемолитические анемии).
- •Гемолитическая болезнь новорожденного.
- •Патофизиология белой крови Лейкоцитозы.
- •Лейкемоидные реакции.
- •Лейкопении. Основные кинетические механизмы лейкопений.
- •Агранулоцитозы.
- •Гемобластозы
- •Этиология лейкозов.
- •Общий патогенез лейкозов.
- •Классификация лейкозов.
- •Клинико-морфологическая характеристика острых лейкозов.
- •Гематологическая картина острых лейкозов.
- •Стадии острого лейкоза.
- •Хронические лейкозы.
- •Хронический миелолейкоз.
- •Хронический лимфолейкоз.
- •Патология гемостаза
- •Геморрагические диатезы, определние понятия, классификация.
- •Тромбоцитопении.
- •Тромбоцитопатии.
- •Наследственные и врожденные формы
- •Наследственные нарушения коагуляционного гемлстаза.
- •Классификация
- •Группа 1. С изолированным нарушением внутреннего механизма формирования протромбиназной активности
- •Гемофилия а
- •Вазопатии (микротромбоваскулиты).
- •Автономные формы микротромбоваскулитов.
- •Другие нарушения гемостаза сосудистого и смешанного генеза
- •Синдром диссеминированного внутрисосудистового свертывания (двс-синдром)
- •Патофизиология сердечно-сосудистой системы
- •Висцеро-кардиальные рефлексы.
- •Кардио-висцеральные рефлексы.
- •Сердечно-сосудистая система в условиях патологии.
- •Процессы компенсации при заболеваниях сердца.
- •Кардиальные приспособительные механизмы
- •II. Изменение ритма сердца
- •Экстракардиальные приспособительные механизмы
- •Процессы повреждения сердца.
- •Патология пейсмекера и проводящей системы сердца.
- •Типовые нарушения ритма.
- •Синусовые аритмии.
- •Гетеротропные аритмии.
- •Экстраситолы.
- •Пароксизмальная тахикардия.
- •Мерцание предсердий.
- •Фибрилляция предсердий.
- •Фибрилляция желудочков.
- •Нарушения проводимости миокарда.
- •Основные патологические процессы в миокарде (поражение кардиомиоцитов).
- •Ишемия миокарда.
- •Токсическое повреждение миокарда.
- •Патология фиброзного скелета сердца. Клапанные пороки сердца.
- •Поражение митральных клапанов
- •Поражение трехстворчатого клапана.
- •Аортальные пороки.
- •Пороки клапанов легочной артерии.
- •Внутрисердечные и межсосудистые шунты.
- •Шунты со сбросом крови справа налево.
- •Легочное сердце.
- •Сердечная недостаточность.
- •Патофизиология сосудов.
- •Роль сосудистой системы в механизмах адаптации организма.
- •Роль сосудистой системы в патогенезе типических патологических процессах.
- •Патология сосудов.
- •Патология сосудистого тонуса.
- •Патологическая физиология системы дыхания
- •Легочное дыхание
- •Легочное дыхание в условиях патологии Процессы компенсации при патологии внешнего дыхания
- •Процессы повреждения аппарата дыхания
- •I. Поражение бронхов и респираторных структур легких
- •II. Поражение костно-мышечного каркаса грудной клетки и плевры:
- •III. Поражение дыхательной мускулатуры:
- •IV. Нарушение кровообращения в малом круге:
- •V. Нарушение процессов альвеолярно-капиллярной диффузии.
- •VI. Нарушение регуляции дыхания:
- •Одышка.
- •Патологическая физиология пищеварения
- •Пищеварительная система и адаптивные реакции.
- •Рефлексы желудочно-кишечного такта в физиологических условиях.
- •Рефлекторные влияния на желудочно-кишечный тракт в условиях патологии.
- •Пищеварительная система в условиях патологии. Процессы компенсации при патологии системы пищеварения.
- •Пищеварение при экстремальных воздействиях на организм.
- •Общие признаки нарушений деятельности пищеварительной системы.
- •Нарушения функций желудка
- •Патология печени
- •Роль печени в регуляции обмена веществ.
- •Белковый обмен.
- •Углеводный обмен.
- •Пигментный обмен.
- •Обмен гормонов.
- •Детоксикационная функция печени.
- •Общая этиология заболеваний печени.
- •Инфекционные факторы.
- •Токсические факторы.
- •Алиментарные факторы.
- •Иммуногенные повреждения.
- •Гемодинамические расстройства.
- •Факторы, механически препятствующие оттоку желчи.
- •Общий патогенез заболеваний печени .
- •Печеночные синдромы.
- •Цитолитический синдром.
- •Мезенхимально-воспалительный синдром синдром.
- •Холестатический синдром.
- •Синдром портальной гипертензии.
- •Синдром печеночной недостаточности.
- •Желтухи.
- •Патофизиология гипербилирубинемии (желтух).
- •Патофизиология мочевыделительной системы.
- •Механизмы реабсорбции и секреции в почечных канальцах.
- •Общие механизмы нарушений канальцевой реабсорбции и секреции.
- •Транспорт электролитов в нефроне.
- •Мочевой синдром.
- •Болевой синдром.
- •Синдром артериальной гипертензии.
- •Патофизиология нейроэндокринной системы
- •Патофизиология эндокринной системы
- •Синтез гормонов
- •Механизм действия гормонов на клетки-эффекторы.
- •Механизм действия тиреоидных гормонов.
- •Строение и функция эндокринной системы
- •Эндокринная система и адаптивные реакции организма
- •Эндокринная система в условиях патологии. Процессы компенсации при патологии эндокринной системы
- •Патологии эндокринной системы
- •Патология гипофиза и гипофиззависимых желез.
- •Классификация надпочечниковой недостаточности:
- •Патологическая физиология гипофизнезависимых желез.
- •Патология тимуса
- •Патофизиология нервной системы
- •Типовые патологические процессы в нервной системе
Клетки иммунной системы.
Лимфоциты.
 Существует
два главных типа лимфоцитов. Они известны
как В-клетки
и Т-клетки.
Все они происходят из костного мозга,
но Т-клетки проходят процесс созревания
в вилочковой железе. Зрелые лимфоциты
все имеют сходный внешний вид. Это
маленькие клетки с интенсивно базофильным
ядром, с очень бедной цитоплазмой. Т- и
В-клетки циркулируют в крови и по тканям
организма. Из В-клеток развиваются
плазматические клетки, которые секретируют
иммуноглобулины (антитела). Т-клетки
также реагируют на антигены. Некоторые
из них (Т-хелперы, Т-супрессоры)
секретируют лимфокины, которые действуют
на другие клетки, принимающие участие
в иммунном ответе. Другие (Т-киллеры)
способны вызывать лизис инфицированных
клеток.
Существует
два главных типа лимфоцитов. Они известны
как В-клетки
и Т-клетки.
Все они происходят из костного мозга,
но Т-клетки проходят процесс созревания
в вилочковой железе. Зрелые лимфоциты
все имеют сходный внешний вид. Это
маленькие клетки с интенсивно базофильным
ядром, с очень бедной цитоплазмой. Т- и
В-клетки циркулируют в крови и по тканям
организма. Из В-клеток развиваются
плазматические клетки, которые секретируют
иммуноглобулины (антитела). Т-клетки
также реагируют на антигены. Некоторые
из них (Т-хелперы, Т-супрессоры)
секретируют лимфокины, которые действуют
на другие клетки, принимающие участие
в иммунном ответе. Другие (Т-киллеры)
способны вызывать лизис инфицированных
клеток.
Макрофаги и дендритные клетки
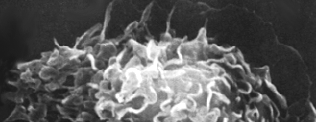
Эти клетки происходят из костного мозга и выполняют разнообразные функции в иммунной защите:
фагоцитоз
секреция цитокинов
презентирование антигенов
Клетки, выполняющие эти разнообразные функции, имеют различный микроскопический внешний вид, но они сгруппированы вместе как система мононуклеарных фагоцитов.
Эффекторами иммунного ответа являются также нейтрофилы, эозинофилы и тучные клетки.
Внешний вид клеток крови представлен на рисунке:

Виды аллергических реакций (реакций гиперчувствительности).
Как уже было сказано выше, если организм уже встречался с антигеном, то повторный контакт с ним приводит к усилению иммунного ответа. Если же антиген введен в организм в относительно большом количестве или же иммунореактивность слишком высока, то стимуляция иммунного ответа может оказаться избыточной и привести к серьезным повреждениям тканей, т.е. развивается состояние гиперсенсибилизации.
Кумбс и Джелл выделили 4 типа гиперчувствительности:
Тип I. Анафилактическая (атопическая, обусловленная реагинами) реакция, или гиперчувствительность анафилактического типа.
Тип II. Цитотоксическая реакция, или гиперчувствительность цитотоксического типа.
Тип III. Иммунокомплексная реакция, или гиперчувствительность, обусловленная иммунными комплексами.
Тип IY. Клеточная реакция, или гиперчувствительность замедленного типа.
Реакции 1, 2 и 3 типов обусловлены взаимодействием антигена с гуморальными антителами и их принято относить к реакциям "немедленного" типа. Реакции 4-го типа основаны на взаимодействии поверхностных лимфоцитарных рецепторов с антигеном, и, поскольку, для их развития требуется больше времени, они получили название "гиперчувствительность замедленного типа" (ГЗТ).
Для развития реакций гиперчувствительности необходимо введение антигена в уже сенсибилизированный организм.
Сенсибилизация, определение понятия, виды.
Под сенсибилизацией понимается процесс, который подобно иммунизации приводит к специфическому изменению реактивности организма и формированию гуморальных и клеточных иммунных механизмов. Различают активную и пассивную сенсибилизацию:
1. В случае введения здоровому организму аллергена (антигена) организм сам вырабатывает гуморальные антитела либо сенсибилизированные Т-лимфоциты. Это состояние называется активной сенсибилизацией (аналогично активному иммунитету). В таком сенсибилизированном организме отсутствуют видимые патологические расстройства, вызванные введением антигена. Правда, в 10-60% случаев развивается сывороточная болезнь.
2. Пассивная сенсибилизация (аналогично - пассивный иммунитет) возникает при переносе уже готовых антител или сенсибилизирующих Т-лимфоцитов от сенсибилизированного организма к другому. Если пассивная сенсибилизация происходит путем передачи антител, тогда это - аллергическая реакция «гиперчувствительности немедленного типа» (РГНТ). Если же пассивная сенсибилизация происходит с помощью передачи Т-лимфоцитов, то это иммунная реакция клеточного иммунитета, т.е. реакция «гиперчувствительности замедленного типа» (РГЗТ).
Механизмы активной сенсибилизации во многом схожи с механизмами формирования первичного гуморального и клеточного иммунного ответа.
Иммунные реакции принято подразделять на два типа: гуморальный и клеточный. Первый основан на наличии антител, второй - на действии активированных тимусзависимых лимфоцитов.
Аллергические реакции любого типа проходят в три фазы:
1. Распознавание антигена 2. Индукция иммунного ответа 3. Продуктивная фаза
1. Процесс распознавания антигена. При поступлении антигена в организм происходит его связывание на рецепторах макрофагов или Т-лимфоцитов, что служит необходимым, но, очевидно, не единственным сигналом, к дальнейшей пролиферации и дифференцировке.
Клетки, которые первыми взаимодействуют с антигеном, называются антигенпрезентирующими (АПК), или А-клетками. Антиген поглощается и перерабатывается преимущественно клетками, способными к фагоцитозу и пиноцитозу. Это процессы важны для фазы распознавания антигена.
2. Индукция иммунного ответа. Как и при других межклеточных взаимодействиях в кооперации А-клеток и Т-лимфоцитов участвует ряд медиаторов. Так, макрофаги вырабатывают интерлейкин-1 (IL-1), который выступает в роли дополнительного сигнала для клеток-индукторов и хелперов. С другой стороны, Т-лимфоциты вырабатывают интерферон, активирующий макрофаги. Таким образом, взаимосвязь между А-клетками и Т-лимфоцитами ни в коем случае нельзя рассматривать как "улицу с односторонним движением".
|
|
Рис. 1. Схема клеточного взаимодействия при развитии гуморального иммунного ответа. Захваченный макрофагами антиген выводится на клеточную поверхность в иммуногенной форме. В реакцию распознавания антигена вступают "ранние" Т-хелперы с фенотипом CD4,8, которые способствуют созреванию "поздних" Т-хелперов, помогающих антителопродукции. Помощь CD4 Т необходима для переключения синтеза IgM на синтез IgG. АГ - антиген, CD4,8 Т - "ранние" Т-хелперы, CD4 Т - "поздние" Т-хелперы, В - В-клетки, ПК - плазматические клетки
|
|
Иммунный ответ на Т-зависимые антигены начинается с активации определенной субпопуляции Т-клеток, получивших название "индукторы". Характерным признаком индукторных Т-лимфоцитов является выработка и секреция интерлейкина-2 (IL-2), который является универсальным стимулом для активации эффекторных Т-лимфоцитов независимо от их типа.
3. Продуктивная фаза иммунного ответа. Оптимальные иммунный ответ реализуется только при взаимодействии Т- и В-клеток. Так как антитела вырабатывают В-лимфоциты, то Т-клеткам отводится вспомогательная роль, их называют Т-хелперами. Кроме того, на В-клетку действуют растворимые медиаторы Т-хелперов, называемые в данном случае хелперными факторами. Т-индуктор активирует В-клетку, выделяя интерлейкин-2. Таким образом, интерлейкины 1 и 2, хелперный фактор способствуют превращению В-лимфоцита в плазматическую клетку, которая и вырабатывает иммуноглобулины.
Синтез Ig M во время иммунного ответа быстро достигает пика и затем быстро снижается. Образование Ig G - более длительный процесс, и антитела данного класса образуются в больших количествах, особенно при вторичном иммунном ответе.
Механизмы развития аллергических реакций.
Реакции I типа (анафилактические, атопические).
Считается, что хорошая сенсибилизация по I типу развивается при введении в организм очень маленьких доз аллергена. По данным Н.Д.Беклемишева эта доза колеблется в пределах 1 – 10 мкг белка. Дозы более высокие дают слабую сенсибилизацию. Они активируют Т-хелперы 1-го типа, и реакция развивается по пути образования IgG и других иммуноглобулинов. В этом случае антигены представляются макрофагами. На малые дозы антигена макрофаги не реагируют, и он представляется В-лимфацитам Т-хелперами 2-го типа. В ответ они увеличивают секрецию интерлейкина-4, который совместно с интерлейкинами 5 и 13 переключают В-лимфоциты на синтез IgE. Циркулирующий IgE метаболизируется довольно быстро. Фиксированный на клетках IgE сохраняется намного дольше.
Реакции I типа обусловлены взаимодействием антигена со специфическими Ig E и Ig G4, связанными с соответствующими рецепторами базофилов и тучных клеток.
В результате этого связывания происходит слияние плазматических мембран и происходит дегрануляция тучных клеток и базофилов. Кроме того, из гранул высвобождаются преобразованные медиаторы (гистамин, гепарин, хемотаксический фактор эозинофилов и нейтрофилов, фактор агрегации тромбоцитов) и вновь синтезированные лейкотриены, простагландины, тромбоксан.
В нормальных условиях перечисленные медиаторы способствуют развитию «защитной» острой воспалительной реакции. Однако в определенных условиях, например при атопиях, происходит интенсивное высвобождение этих анафилатоксинов, и тогда в первую очередь наступает сужение просвета бронхов и расширение кровеносных сосудов, что представляет опасность для жизни.
Реакции II типа (цитотоксические иммунные реакции).
В основе аллергической реакции II типа лежит образование антител к первичным или вторичным структурам клеточной поверхности. Антигеном могут быть компоненты клеточной мембраны или неклеточные структуры. Для того чтобы включился этот механизм, клетки тканей должны приобрести аутоаллергенные свойства. Большую роль в этом процессе играет действие на клетки различных химических веществ, чаще лекарств, попадающих в организм. Они могут изменять антигенную структуру клеточной мембраны за счет: а) изменения структуры, присущей клетке антигенов; б) повреждение мембраны и появление новых антигенов; в) образование комплексных аллергенов с мембраной, в которых химическое вещество играет роль гаптена.
Повреждение может быть вызвано тремя путями:
за счет активации системы комплемента – колмплементно-посредованная цитотоксичность; при этом образуются активные фрагменты комплемента, которые повреждают клеточную мембрану;
за счет активации фагоцитоза клеток, покрытых антителами;
через активацию антителозависимой цитотоксичности.
Для клиники имеют особое значение четыре группы антигенов: 1. Клетки крови (переливание несовместимых по резус-фактору или группе крови). 2. Клетки тканей (особенно при органоспецифических аутоиммунных заболеваниях). 3. Антигены вторично фиксированные на клеточной мембране. 4. Антигены в виде неклеточных структурных белков (например, к миелину).
Связывание антител с антигеном может вызвать повреждение активированными макрофагами. Антитела в этих реакциях представлены Ig G и I M. Непосредственное повреждение мембран вызывают компоненты С8 и С9, образующиеся в результате активации системы комплемента, называемые мембраноатакующим комплексом. Оказалось, что существует еще один цитотоксический механизм: клетки-мишени, нагруженные небольшим количеством Ig G, могут "неспецифически" уничтожаться лимфоретикулярными клетками. Следует отметить, что этот механизм, получивший название "АНТИТЕЛОЗАВИСИМАЯ КЛЕТОЧНАЯ ЦИТОТОКСИЧНОСТЬ", лежит в основе функционирования как фагоцитирующих, так и нефагоцитирующих миелоидных клеток (лейкоциты), а также гранулярных лимфоцитов.
Реакции III типа (иммунокомплексные аллергические реакции).
Во многих случаях организм длительное время контактирует с избытком антигена. Это - персистентная инфекция, аутоиммунореактивность к компонентам собственного организма или повторяющийся контакт с внешним антигеном. В этих случаях взаимодействие между антигеном и антителом (Ig G) может привести к образованию нерастворимых иммунных комплексов, которые способны откладываться в определенных тканях и вызывать острые воспалительные реакции. Если такими комплексами связываются компоненты комплемента, то образуются продукты расщепления С3 и С5, представляющие собой анафилатоксины. Данные медиаторы приводят к высвобождению биологически активных веществ (БАВ) тучных клеток, которые повышают проницаемость сосудов и привлекают в зону воспаления нейтрофилов, фагоцитирующие иммунные комплексы. Это в свою очередь приводит к выбросу содержимого лейкоцитарных гранул. Протеолитические ферменты, ферменты, образующие кинины и катионные белки, высвобождающиеся из гранул, вызывают локальное повреждение тканей и стимулируют развитие воспаления. В некоторых случаях происходит и агрегация тромбоцитов с двумя важными последствиями:
тромбоциты служат дополнительным источником вазоактивных аминов;
тромбоциты формируют микротромб, что приводит к развитию локальной ишемии.
Нерастворимые иммунные комплексы, поглощенные макрофагами, долго не перевариваются и служат причиной активации этих клеток.
Эффект, вызываемый образованием иммунных комплексов, зависит не только от абсолютного количества антигена и антител, которые определяют интенсивность реакции, но и от их взаимного соотношения. Последнее обуславливает структуру комплексов и их распределение в организме. При избытке антител или небольшом избытке антигена комплексы быстро преципитируют и обычно локализуются в месте проникновения антигена в организм. По мере увеличения избытка антигена образуются растворимые комплексы.
Циркулирующие иммунные комплексы (ЦИК) становятся патогенными только при определенных условиях:
комплекс должен быть образован в умеренном избытке антигена и иметь растворимую форму;
должно произойти повышение проницаемости сосудистой стенки, что будет способствовать отложению комплексов в данной области. Обычно повышение проницаемости вызывается:
а) освобождением вазоактивных аминов из тромбоцитов, базофилов и тучных клеток под влиянием анафилотоксина;
б) действием выделяющихся из фагоцитов лизосомальных ферментов;
в состав комплекса должны входить такие антитела, которые способны фиксировать и активировать комплемент;
должны быть созданы условия, способствующие длительной циркуляции комплексов.
Небольшие комплексы прикрепляются к рецепторам комплемента, расположенным на эритроцитах, и переносятся к макрофагам печени, где в норме происходит их инактивация. При недостаточности компонентов комплемента комплексы накапливаются в плазме крови и могут откладываться в почках, сосудах и коже.
Реакции IY типа (патологические иммунные реакции, обусловленные клетками).
Эта форма гиперчувствительности наблюдается при многих аллергических реакциях на бактерии, вирусы и грибы, а также при контактном дерматите, возникающем в результате сенсибилизации отдельными простыми химическими соединениями, и при отторжении трансплантированных тканей. Видимо, наиболее известный пример - это реакция Манту, развивающаяся при внутрикожном введении туберкулина человеку, у которого предшествующая микобактериальная инфекция вызвала специфическую чувствительность.
Инициация клеточного иммунного ответа |
Гиперчувствительность замедленного типа - это зависимая от Т-клеток иммунная реакция, проявляющаяся в виде воспалительной реакции в месте попадания в организм антигена - обычно в коже. Максимальная интенсивность реакции достигается через 24-48 часов после инициации. По гистологическим данным эта реакция начинается околососудистой мононуклеарной инфильтрацией, которая постепенно усиливается и дополняется полиморфноядерной. Затем полиморфноядерные лейкоциты покидают место реакции, оставляя инфильтрат, состоящий преимущественно из лимфоцитов и клеток моноцитарно-макрофагального ряда.
Следует еще раз отметить, что гиперчувствительность и связанные с нею нарушения - это слишком интенсивное взаимодействие между антигеном и нормальными клеточными механизмами. Активированные Т-клетки выделяют целый ряд растворимых факторов, которые представляют собой медиаторы клеточного иммунитета, в частности факторы привлекающие и активирующие макрофаги. Кроме того, под действием этих факторов происходит дифференцировка предшественников цитотоксических Т-лимфоцитов в киллерные клетки, что приводит к повреждению тканей.
При аллергических реакциях замедленного типа повреждающее действие может развиваться несколькими путями:
прямое цитотоксическое действие сенсибилизированных Т-лимфоцитов на клетки-мишени, которые вследствие различных причин приобрели аутоаллергенные свойства;
цитотоксическое действие Т-лимфоцитов, опосредованное через лимфотоксин;
выделение в процессе фагоцитоза лизосомальных ферментов, повреждающих тканевые структуры. Эти ферменты выделяются, в первую очередь, макрофагами.
Псевдоаллергические реакции.
Псевдоаллергия (синонимы неспецифическая, неиммунологическая аллергическая реакция; неиммунологический эквивалент аллергической реакции; анафилактоидная реакция, если она протекает по типу анафилактического шока) – патологический процесс, клинически похожий на аллергию, но не имеющий иммунной стадии своего развития. Остальные две стадии – освобождения (образования) медиаторов (патохимическая) и патофизиологическая (стадия клинических проявлений) при псевдоаллергии и истинной аллергии совпадают.
Причиной псевдоаллергии является какое-либо вещество, которое обозначают термином «псевдоаллерген». Это вещество действует непосредственно на клетки-эффекторы (тучные клетки, базофилы и др.) или биологические жидкости и вызывают освобождение из клеток или образование в жидкостях медиаторов. Практически большинство аллергенов могут приводить к развитию как аллергических, так и псевдоаллергических реакций. Это зависит от природы вещества, его дозы, частоты введения в организм и реактивности самого организма, причем эти два типа реакций могут сосуществовать. Псевдоаллергические реакции встречаются наиболее часто при лекарственной и пищевой непереносимости. Очень многие лекарственные препараты (ненаркотические анальгетики, рентгеноконтрастные вещества, плазмозамещающие растворы, плазма и др.) чаще приводят к развитию псевдоаллергии, чем аллергии. Самой частой реакцией является хроническая крапивница.
В патогенезе псевдоаллергии принимают участие три группы механизмов:
гистаминовый;
нарушение активации системы комплемента;
нарушение метаболизма арахидоновой кислоты.
В каждом конкретном случае ведущую роль обычно играет один из этих механизмов.
Стадии аллергических реакций.
В развитии аллергии обычно выделяют три СТАДИИ:
"иммуногенную" (или период сенсибилизации).
"патохимическую" (или период образования и активации медиаторов аллергии).
3) "патофизиологическую" ( или собственно аллергическая реакция, стадия функциональных и структурных повреждений).
I стадия. Иммунологическая стадия начинается с момента первой встречи организма с аллергеном и заключается в формировании иммунного ответа. При этом развивается сенсибилизация организма, т.е. состояние повышенной чувствительности организма к антигену, характеризующееся образованием антител или сенсибилизированных (активированных) лимфоцитов к данному аллергену.
II стадия. После взаимодействия образовавшихся антител или сенсибилизированных лимфоцитов с антигеном начинается вторая - "патохимическая" - стадия аллергических реакций. Образование комплекса антиген-антитело в сенсибилизированном организме вызывает ряд изменений обмена веществ. Эти изменения заключаются в активации тканевых и сывороточных протеолитических и липолитических ферментов, физико-химических изменениях плазмы крови, освобождении гистамина, серотонина, гепарина и других преобразованных медиаторов аллергии, а также в образовании ряда новых медиаторов - тромбоксанов, лейкотриенов и др.
III. стадия. Образующиеся при аллергизации организма гуморальные антитела и мононуклеары - киллеры, специфически взаимодействуют с антигеном, оказывая прямое или опосредованное (через соответствующие медиаторы аллергии) повреждающее влияние на различные клеточно-тканевые элементы. Патогенетическую основу таких расстройств при реакциях немедленного типа составляют следующие механизмы, степень выраженности которых может варьировать в широком диапозоне в зависимости от конкретной формы аллергии:
1) вазомоторные реакции (местные и системные), приводящие к различным изменениям кровяного давления, регионарного кровообращения, микроциркуляции.
2) повышение проницаемости стенок сосудов, ведущее к развитию отеков, волдырей.
3) спастические сокращения гладкомышечных клеток бронхиол, кишечника и других органов, что может проявиться в развитии асфиксии, диспептических расстройств (рвота, диарея, боли в области живота) и др.
4) дисбаланс между свертывающей, противосвертывающей и фибринолитической системами крови, носящий местный или генерализованный характер (при аллергических реакциях возможно снижение свертываемости крови или развитие тромбоза).
5) раздражение нервных рецепторов (в основном биогенными аминами и кининами), приводящее к развитию чувства боли, зуда, жжения и др.
Структурно-функциональные повреждения при аллергии замедленного типа, обусловленные в основном развитием воспалительной реакции, сопровождаются, как правило, резко выраженной эмиграцией лейкоцитов и клеточной инфильтрацией тканей.
Примеры аллергических реакций.
Анафилактический шок.
Анафилактический шок – вид аллергической реакции немедленного типа, возникшей при повторном введении аллергенов в организм. Эту аллергическую реакцию у человека может вызвать практически все применяемые в настоящее время лекарственные препараты (особенно часто антибиотики группы пенициллина, производные пиразолона, витамин В1 и др.), а также чужеродные сыворотки в минимальных дозах и полипептидные гормоны (АКТГ, инсулин и др.). Большинство лекарственных препаратов являются гаптенами и приобретают антигенные свойства после связывания с белками организма.
Термин «анафилаксия» (греч. ana – обратный, phylaxis – защита) был введен для обозначения необычной, иногда смертельной реакции у собак на повторное введение экстракта из щупалец актиний (P.Portier, C.Richet, 1902).
Анафилактический шок может развиться в ответ на парентеральное введение разрешающей дозы (примерно в 10 раз больше сенсибилизирующей) антигена спустя 5-10 дней после сенсибилизации организма сывороткой в дозе 10-6 мл. После повторного введения антигена шок развивается спустя нескольких секунд или минут.
По патогенезу анафилактический шок можно отнести к сосудисто-периферическому шоку. Это самое тяжелое и грозное проявление аллергии, все чаще встречающееся в клинической практике. Наиболее типичным проявлениям анафилактического шока:
- гемодинамические изменения (расширение артериол, капилляров и скопление крови на периферии, плазмопотеря) ведущие к уменьшению венозного возврата к сердцу, падению кровяного давления и сердечного выброса до опасного уровня;
- чувство удушья в результате бронхоспазма, ведущее к аноксии (легкое - "шоковый" орган у человека);
- рвота, непроизвольная дефекация, мочеиспускание вследствие спазма гладкой мускулатуры;
- потеря сознания.
Нарушения метаболизма при анафилактическом шоке не успевают развиться. Исход анафилактического шока часто летальный в результате остановки сердечной деятельности и дыхания.
Местные проявления аллергических реакций I типа.
Такими проявлениями является крапивница, отек Квинке. Клинически он проявляется в виде отеков на коже и слизистых, выстилающих полость тела, а также в виде отеков внутренних органов.
Этиология - развивается в ответ на действие химических веществ (пищевые антигены, лекарства) и физических факторов (холод, приводящий к образованию аутоантигенов).
Различия: при крапивнице реакция антиген-антитело протекает в коже, поэтому часто сочетаются видимым отеком и зудом; при отеке Квинке реакция антител-антитело происходит в подкожно-жировой клетчатке, поэтому для этого заболевания характерно наличие отека без зуда, так как рецепторные окончания чувствительных нервов локализуются, в основном, в коже.
Переливание крови.
Среди многочисленных мембранных антигенов эритроцитов наиболее важны антигены системы АВО. Антитела к антигенам А и В образуются лишь в том случае, если этот антиген отсутствует на собственных эритроцитах, т.е., например, у пациента с группой крови А обнаруживаются антитела к антигену В и наоборот. Данные антитела - изогемагглютинины - обычно относятся к Ig M и, как полагают, образуются в результате латентной иммунизации антигенами микрофлоры кишечника, перекрестно реагирующими с групповыми веществами крови. Если пациент имеет группу крови А, он толерантен к антигенам, сходным с А, и у него образуются антитела, перекрестно реагирующие только с антигеном В и вызывающие агглютинацию соотвествующих эритроцитов. Если ему перелить кровь любой другой группы крови, то изогемагглютинины вызовут "склеивание" введенных эритроцитов, что приводит к тяжелым последствиям.
Подобный механизм имеет место и при переливании одногруппной крови не совместимой по резус-фактору.
Лекарственная непереносимость.
Это довольно сложное явление. Лекарственные вещества могут присоединятся к различным компонентам организма и из гаптена превращаться в полноценный антиген, способный сенсибилизировать отдельных людей. Если при этом образуются Ig E, то возникают анафилактические реакции. В некоторых случаях особенно при использовании мазей, может быть индуцирована гиперчувствительность, опосредованная клетками. Если же лекарственное вещество связывается с сывороточными белками, то вероятны реакции III типа. Если какой-то препарат образует антигенные комплексы на поверхности форменных элементов крови и вызывает продукцию соответствующих цитотоксических антител, то реакция идет по II типу. Например, гемолитическая анемия после приема хлорпромазина или фенацитина, агранулоцитоз после приема амидопирина или квиндина, тромбоцитопеническая пурпура после приема седормида.
|
Рис. 1. Механизмы формирования аллергического и/или псевдоаллергического воспаления при лекарственной аллергии. |
Сывороточная болезнь.
Сывороточная болезнь - аллергическая реакция III типа. В отличие от анафилактического шока, который развивается после повторного введения антигена, сывороточная болезнь может развиваться и после первого его введения. Во время, предшествующее эре сульфаниламидов и антибиотиков, она занимала ведущее место, поскольку лечение многих инфекционных заболеваний проводилось с помощью животных сывороток. Отсюда и происхождение названия, хотя эту гиперергическую реакцию может вызвать и введение депо-пенициллина.
Причиной возникновения сывороточной болезни является введение в организм человека гетерологичных или гомологичных белковых препаратов.
Феномен был описан давно, но механизм стал понятен сейчас. У некоторых людей начинается синтез антител, направленных к чужеродному белку, как правило, лошадиному глобулину. Поскольку антиген присутствует в избытке, то образуются циркулирующие растворимые иммунные комплексы. Для того, чтобы оказать патогенный эффект, комплексы должны иметь определенные молекулярные параметры: слишком крупные молекулярные комплексы поглощаются макрофагами ретикулоэндотелиальной системы, а слишком мелкие не могут вызвать воспалительной реакции. Однако и комплексы соответствующей молекулярной массы остаются в сосудистом русле и не способны обусловить патологические реакции, пока не повысится проницаемость сосудов, которая может произойти либо в результате высвобождения серотонина из тромбоцитов после их взаимодействия с крупными комплексами, либо в результате индуцированной Ig Е или комплементом дегрануляции базофилов и тучных клеток, что сопровождается выделением гистамина, лейкотриенов и факторов активации тромбоцитов. При действии этих медиаторов на капилляры их эндотелиальные клетки отделяются друг от друга и обнажается базальная мембрана, к которой присоединяются иммунные комплексы соответствующего размера. При этом особенно часто поражаются кожа, суставы, почки и сердце. По мере продукции антител антиген постепенно элиминируется, и больной обычно выздоравливает.
Реакция Артюса.
Морис Артюс обнаружил, что внутрикожное введение растворимого антигена гипериммунизированным кроликам с высоким уровнем преципитирующих антител вызывает эритематозную реакцию и отек, достигающие максимума через 3-8 часов, а затем обычно спадающие. В месте повреждения обнаруживается инфильтрация полиморфноядерных лейкоцитов. Введенный антиген часто образует преципитат с антителами в просвете венул из-за того, что активация комплемента по классическому пути не успевает предотвратить их формирование, и связывание комплемента наступает позже.
В процессе связывания комплемента образуются анафилатоксины, которые вызывают дегрануляцию тучных клеток. Располагающиеся в просвете сосудов комплексы способствуют агрегации тромбоцитов, сопровождающейся высвобождением вазоактивных аминов, что приводит к развитию эритемы и отека. Хемотаксические факторы индуцируют приток лейкоцитов.
Повреждения тканей, вызванные реакциями IY типа.
Инфекции.
Развитие состояния клеточной гиперчувствительности к бактериальным продуктам, видимо, ответственно за те повреждения, которые возникают при бактериальной аллергии. Эти повреждения могут включать образование полостей в легких, казеозный некроз и общий токсикоз при туберкулезе у человека, или кожный грануломатоз при некоторых формах проказы. Если организму не удается справиться с инфекцией, то персистирующий антиген вызывает хроническую локальную реакцию гиперчувствительности замедленного типа. Постоянная продукция лимфокинов сенсибилизированными Т-лимфоцитами приводит к накоплению большого количества макрофагов. Ограниченное скопление в ткани размножающихся лимфоцитов и фибробластов с явлениями фиброзного некроза называется ХРОНИЧЕСКОЙ ГРАНУЛЕМОЙ.
Кожная сыпь при оспе и кори и лихорадка, вызванная вирусом простого герпеса, могут быть обусловлены аллергическими реакциями замедленного типа, причина развития которых - интенсивное уничтожение зараженных вирусами клеток цитотоксическими Т-лимфоцитами.
Контактный дерматит.
Одна из форм ГЗТ - контактная чувствительность, наблюдается при нанесении на кожу высокореактивных химических соединений, таких, как, тринитрохлорбензол или динитрофторбензол. Подобные вещества ковалентно связываются с белками кожи и образуют неоантиген. Если через 4-7 дней контакт с антигеном повторяется, то через 24-48 часов после повторного контакта возникает воспалительная реакция.
Осуществляющие ГЗТ иммунные лимфоциты захватывают антиген в непосредственной близости от места его введения. Специфическое узнавание антигена приводит к активации этих клеток, и они начинают синтезировать большое количество антиген-специфических факторов, неспецифических факторов и лимфокинов. Некоторые лимфокины привлекают и активируют клетки моноцитарно-макрофагального ряда и нейтрофилы, находящиеся вблизи от места введения антигена. Необходимо отметить, что при этом развивается очень слабый отек, поскольку при ГЗТ проницаемость сосудов обычно не меняется. Это приводит к уплотнению ткани, а не к эритематозной реакции. Во многих повреждениях ГЗТ вокруг мелких сосудов наблюдаются мононуклеарные инфильтраты. При достаточно сильной реакции могут повреждаться крупные кровеносные сосуды, в результате их содержимое может попасть в очаг воспаления.
Аутоиммунные болезни.
Аутоиммунные (аутоаллергические) болезни представляют собой группу заболеваний, основным механизмом развития которых является реакция сенсибилизированных лимфоцитов и аутоантител с тканями организма.
В основе аутоиммунных заболеваний лежит аутоиммунизация, которая характеризуется появлением в организме аутоантигенов и аутоантител. В роли аутоантигенов могут выступать:
1) естественные, первичные антигены (неизмененная ткань хрусталика глаза, щитовидной железы, яичка, нервная ткань);
2) приобретенные, вторичные (патологически измененные ткани) антигены как инфекционной, так и неинфекционной природы.
Появление естественных аутоантигенов связывают с нарушением физиологической изоляции органов и тканей, по отношению к которым отсутствует иммунологическая толерантность. Известно, что в период созревания лимфоидной ткани возникает иммунологическая толерантность к антигенам всех органов и тканей, кроме тканей глаза, щитовидной железы, семенников, надпочечников, головного мозга, нервов. Считается, что антигены этих органов и тканей отграничены от лимфоидной ткани гистогематическим барьером.
Неинфекционные аутоантигены по своему происхождению могут быть ожоговыми, лучевыми, холодовыми и др., а инфекционные – комплексными и промежуточными. В образовании этих аутоантигенов большое значение отводится гаптенному механизму, причем в роли гаптена могут выступать как продукты обмена организма, так и химические вещества, лекарственные средства.
Появление инфекционного комплексного аутоантигена (комплексы ткань-микроб, ткань-токсин) ведет к тому, что возникающие в этих условиях аутоантитела реагируют не только с микробом, но и с тканью, что и определяет возможность развития аутоагрессивного процесса.
Инфекционные промежуточные антигены (вирусиндуцирующие), которые отличаются по своим антигенным свойствам как от клетки, так и от вируса, способны индуцировать продукцию антител и тем самым вызывать аутоиммунное повреждение клеток и тканей.
Однако основной причиной аутоиммунизации считают нарушения в центральном органе иммуногенеза - тимусе, которые приводят к потере способности естественных иммунодепрессантов подавлять функцию Т-клеток, созревающих в тимусе и обладающими специфическими рецепторами по отношению к аутологичным антигенам тканей.
Классификация аутоиммунных болезней.
1-я группа. Органоспецифические аутоиммунные болезни (болезнь Хашимото, энцефаломиелит, полиневрит, рассеянный склероз, идиопатическая аддисонова болезнь, симпатическая офтальмия). Их возникновение провоцирует инфекция, особенно вирусная, хроническое воспаление и др. Аутоиммунизация развивается в связи с повреждением физиологических барьеров иммунологически обособленных органов, что позволяет иммунной системе реагировать на их антигены выработкой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются изменения, характерные преимущественно для реакций ГЗТ, ткань органов инфильтрируется лимфоцитами и макрофагами, паренхиматозные элементы погибают, в финале развивается склероз.
2-я группа. Органо-неспецифические аутоиммунные болезни (системная красная волчанка, ревматоидный артрит, системная склеродермия, дерматомиозит, вторичная гемолитическая анемия и тромбоцитопения). В этих случаях нарушения контроля иммунологического гомеостаза лимфоидной системы связаны с генетическими факторами, вирусной и бактериальной инфекцией, ионизирующим излучением. Аутоиммунизация развивается к антигенам многих органов и тканей, не обладающих органной специфичностью. В органах и тканях при этих заболеваниях наблюдаются изменения, характерные для реакций как ГЗТ, так ГНТ.
3-я группа. Это определенные формы гломерулонефрита, гепатита, хронического гастрита и энтерита, неспецифический язвенный колит, цирроз печени, ожоговая болезнь, аллергические анемии, агранулоцитоз, лекарственная болезнь. Изменение антигенных свойств тканей и органов, т.е. образование аутоантигенов при этих заболеваниях, связано прежде всего с денатурацией тканевых белков при ожоге, травме, хроническом воспалении, вирусной инфекции. Образование аутоантигена возможно при воздействии бактериального антигена, особенно перекрестно реагирующего, как это наблюдается, например, при гломерулонефрите, неспецифическом язвенном колите. Аутоиммунизация возникает при введении лекарственных препаратов; в образовании аутоантител имеет значение гаптеновый механизм. В этих случаях с аутоиммунизацией связано не возникновение заболевания, а прогрессирование характерных для него органных изменений, которые отражают реакции ГЗТ и ГНТ.
Принципы лечения аллергических заболеваний.
1. Устранение антигена, но это возможно не всегда.
Патогенетическую основу лечения аллергических форм патологии составляет гипосенсибилизация (десенсибилизация), т.е. снижение чувствительности организма к антигенному раздражителю.
Различают СПЕЦИФИЧЕСКУЮ и НЕСПЕЦИФИЧЕСКУЮ гипосенсибилизацию. СПЕЦИФИЧЕСКАЯ гипосенсибилизация проводится путем парентерального введения того аллергена, который вызвал сенсибилизацию и рассчитана на постепенное снижение антител или на выработку блокирующих (защитных) антител.
Десенсибилизационная терапия при ГНТ проводится с учетом того, что сенсибилизация - это появление и циркуляция в крови иммуноглобулинов Е, всегда сочетается с невысоким количеством антител классов G и М. При искусственном повышении количества последних они будут тоже связывать антигены, и тогда IgЕ будут иметь меньшую возможность взаимодействия с антигенами и запуска ГНТ.
Отсюда постепенная иммунизация больных антигеном, к которому у него имеется повышенная чувствительность, приводит к лечебному эффекту за счет увеличения Ig G и Ig М, конкурирующих с IgЕ за антиген.
НЕСПЕЦИФИЧЕСКАЯ гипосенсибилизация применяется в тех случаях, когда специфическая невозможна или неэффективна, либо тогда, когда не удается выявить аллерген. Ее можно достичь некоторыми лекарственными препаратами ( например, антигистаминными - при аллергии немедленного типа; иммунодепрессантами, в том числе глюкокортикоидами - при аллергиях любого типа) или используя некоторые виды физиотерапевтического воздействия.
Механизмы неспецифической гипосенсибилизации могут быть весьма сложными. Например, иммунодепрессивное действие глюкокортикоидов заключается в подавлении фагоцитоза, ингибировании синтеза ДНК и РНК, атрофии лимфоидной ткани, торможении образования антител, подавлении высвобождения гистамина из тучных клеток, уменьшение содержания компонентов С1-С3 системы комплемента и т.д.
3. Устранение иммунодефицитного состояния как возможной причины аутоаллергии.
Трансплантационный иммунитет.
Трансплантация органов и тканей благодаря первым сенсационным сообщениям об успешных пересадках и широкому освещению этих вопросов в прессе привлекла внимание как специалистов, так и заинтересованных читателей. Однако, если не учитывать юридических и этических вопросов, то следует назвать две главные проблемы трансплантации:
1. Технический аспект - включая консервацию и подготовку трансплантата.
2. Иммунологический аспект - связан главным образом с подбором совместимого донора.
Виды трансплантации. В зависимости от локализации пересаженного органа различают: 1. Ортотопическую трансплантацию - пересадка органа на место утраченного. 2. Гетеротопическую трансплантацию - пересадка органа на другое, несвойственное ему место.
С точки зрения иммунологии различают следующие разновидности:
1. Аутотрансплантация, при которой трансплантат переносят с одного участка на другой в пределах одного организма. При этом иммунная реакция на трансплантат отсутствует.
2. Алло(гомо)трансплантация - это пересадка органов и тканей между организмами одного и того же вида. При этом донор и реципиент не являются генетически идентичными. Успех или неудача трансплантации зависит главным образом от степени их гистосовместимости.
3. Ксено(гетеро)трансплантация - это пересадка органов в пределах двух разных видов.
Антигены гистосовместимости. Речь идет о генетически детерминированных антигенах клеточных мембран, которые вызывают у реципиента иммунный ответ и в конечном счете отторжение пересаженного органа. Их синтез детерминирован генами главного комплекса гистосовместимоси (МНС), структура которого представляет интерес для современной иммуногенетики.
Антигены МНС, первоначально идентифицированные по способности вызвать сильную реакцию отторжения трансплантата, обнаружены у каждого вида позвоночных. МНС содержит 3 класса генов.
Иммунный ответ организма на трансплантат детально изучен на модели пересадки кожного лоскута. Многочисленные исследования показали, что в основе реакций трансплантационного иммунитета лежат сходные механизмы. В зависимости от того, произведена ли пересадка сенсибилизированному или несенсибилизированному реципиенту, различают ПЕРВИЧНЫЙ ИЛИ ВТОРИЧНЫЙ тип иммунного ответа на трансплантат. Одна из особых форм вторичного ответа - феномен "белый трансплантат".
Первичный ответ (first-set). В 1-й день после трансплантации питание лоскута кожи поддерживается исключительно посредством диффузии. Это означает, что при пересадке крупных трансплантатов неизбежно развитие гипоксии с дегенеративными, отчасти некротическими изменениями. На 2-3 день начинается васкуляризация. Она обеспечивает функциональную способность трансплантата до 6-7 дня. При этом дегенеративные процессы приостанавливаются, начинается регенерация. После 7 дня при пересадки от несовместимого донора развиваются нарушения кровообращения, начиная с периферических капилляров, что сопровождается значительным скоплением лимфоцитов. Появляются периваскулярные инфильтраты. Наряду с лимфоцитами в процесс вовлекаются плазматические клетки и эозинофилы. Примерно через день обнаруживаются тромбозы сосудов, что довольно быстро приводит к некрозу. В том случае, если генетические различия обусловлены слабыми антигенами гистосовместимости, то указанные изменения развиваются постепенно, процесс регенерации продолжается и отторжение, как правило, заканчивается к 12 дню.
Вторичный ответ (second-set). В том случае, если спустя 2-3 недели и более реципиенту вторично пересаживают ткань или орган, это приводит к ускоренному отторжению трансплантата. В первые 3-4 дня реакция подобна таковой при первичной аллотрансплантации, однако на 5 день развиваются необратимые изменения, в результате чего регистрируют некроз ткани. Отторжение по типу вторичного иммунного ответа происходит при пересадки ткани от того же донора, или от другого, идентичного первому по сильным антигенам гистосовместимости.
Феномен «белый трансплантат». Это феномен был описан при пересадке кожного лоскута примерно на 14-й день после первичной трансплантации. В целом для него характерна картина ишемического некроза, которую некоторые авторы назвали «трансплантат без васкуляризации». Аналогичные реакции наблюдаются при пересадки почки, когда донор и реципиент были несовместимы по АВО-системе; кроме того ксеногенная трансплантация также заканчивается сверхострым отторжением. Было показано, что в этих случаях значительную роль играют реакции гуморального иммунитета. С иммунным ответом непосредственно связаны внутрисосудистые нарушения, обусловленные активным свертывание крови.
Реакция «трансплантат против хозяина». Пересадка аллогенных тканей или органов вызывает защитную реакцию организма, которая может привести к отторжению трансплантата. Ситуация осложняется, если транплантируют иммунокомпетентные клетки, которые способны активно действовать против организма реципиента. Эту реакцию называют "трансплантат против хозяина", а также "адоптивная иммуноагрессия", "гомологичная болезнь", рант-болезнь.
Эта реакция проявляется при наличии у реципиента по крайней мере одного антигена, который отсутствует у донора, при снижении иммунокомпетентности организма реципиента и при переливании иммунокомпетентных клеток:
Плоду или новорожденному животному (рант-болезнь).
Животным, у которых предварительно была выработана толерантность к антигенам донора.
Людям или животным с явным нарушением иммунной системы, например, после рентгеновского облучения (вторичная болезнь).
РТПХ характеризуется поражением органов и тканей иммунной системы реципиента (т.е. развитием своеобразного иммунодефицитного состояния), повреждением кожи, желудочно-кишечного тракта (особенно в зоне расположения пейеровых бляшек), печени.
Иммунологическая толкрантность.
Иммунологическая толерантность - это частичная или полная утрата организмом способности вступать в иммунную реакцию со специфическим антигеном. Существуют разные способы выработки иммунологической толерантности.
Различают следующие виды иммунологической толерантности: 1. Естественную. 2. Индуцированную.
Естественная толерантность - на собственные антигены (аутоантигены). Механизмы развития: элиминация из тимуса незрелых клонов Т-лимфоцитов, В-лимфоциты не способны отвечать на аутоантигены из-за отсутствия сигналов от Т-хелперов и действия ингибиторов, синтезируемых Т-супрессорами. В связи с этим отмечается иммунологическая инертность у плода и новорожденного.
Индуцированная (искусственная) толерантность - создается в клинических или лабораторных условиях. Различаю следующие виды индуцированной иммунологической толерантности:
а) иммунологический паралич (Феномен Фелтона) - введение большого количества пневмококкового полисахарида и белка. Феномен антигенной перегрузки - большие лоскуты кожи отторгаются гораздо позже ("перенасыщение иммунных клеток антигенами").
б) лекарственно-индуцированная - подавление активности иммунной системы лекарственными препаратами (6-меркаптопурин, циклофосфамид, антистафилококковая сыворотка и др.).
Иммунологическая толерантность может быть поливалентной (на большинство антигенов) и расщепленной (на часть антигенов есть иммунный ответ, на другие - нет). Кроме того, различают полную иммунологическую толерантность - нет иммунных реакций, и частичную - существенное снижение иммунного ответа.
Иммунодефицитные состояния.
Термином иммунодефициты обозначают нарушения нормального иммунологического статуса, которые обусловлены дефектом одного или нескольких механизмов иммунного ответа.
Иммунодефицитные заболевания вызывают особый интерес, поскольку им сопутствуют многочисленные патологические процессы. Наиболее тяжелые формы иммунодефицитов выявлены у детей грудного возраста: у них нарушение иммунной системы представляет собой фактор риска и обычно заканчиваются летально.
Различают первичные и вторичные иммунодефициты. В качестве первичных выделены такие состояния, при которых нарушение иммунных механизмов (продукции антител или Т-лимфоцитов) часто связано с генетическим блоком.
В зависимости от уровня нарушений и локализации дефекта различают преимущественно следующие: гуморальные, клеточные и комбинированные иммунодефициты.
Многочисленные иммунологические, клинические и морфологические данные послужили основанием для разработки классификации иммунодефицитных состояний. Как первичные, так и вторичные иммунодефицитные состояния можно подразделить:
преимущественное нарушение клеточного звена иммунной системы;
преимущественное нарушение гуморального звена иммунной системы;
комбинированные нарушения иммунной системы;
нарушения фагоцитарной системы;
нарушения системы комплемента.
Дальнейшее совершенствование наших знаний позволило классифицировать иммунодефициты с учетом следующих патогенетических и этиологических критериев:
1. Иммунодефициты, обусловленные отсутствием или резким нарушением клеточных популяций или субпопуляций (стволовые клетки, Т- и В-клетки, процессы обмена веществ).;
2. Иммунодефициты вследствие нарушений механизмов иммунорегуляции.



