
- •Скорость химической реакции.
- •Ковалентная связь. Метод валентных связей.
- •Характеристика растворов. Процесс растворения.
- •Тепловой эффект реакции - это теплота q, выделившаяся или поглощенная в химической реакции
- •Энтальпия реакции δh - это тепловой эффект реакции при постоянном давлении
- •Энтропия вещества тем выше, чем меньше упорядоченность частиц этого вещества
- •Неполярная и полярная ковалентная связь.
- •Гидролиз солей.
- •Смещение химического равновесия. Принцип Ле Шателье.
- •Строение атомных ядер. Изотопы.
- •6. Электроны движутся вокруг ядра, как планеты вокруг Солнца.
Гидролиз солей.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- => FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию).
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH =>KHSiO3 + KОН 2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S 2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 + 6Н+ + S2- рН =7
Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато. Например, гидролиз хлорида железа (II) включает две ступени:
1-ая ступень FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- =>Fe(OH)+ + 2Cl- + H+
2-ая ступень Fe(OH)Cl + HOH =>Fe(OH)2 + HCl Fe(OH)+ + Cl- + H+ + OH- =>Fe(ОН)2 + Н+ + Cl-
Гидролиз карбоната натрия включает две ступени:
1-ая ступень Nа2СО3 + HOH =>NаНСО3 + NаОН СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
2-ая ступень NаНСО3 + Н2О =>NаОН + Н2СО3 НСО3- + Na+ + H+ + OH- =>Н2СО3 + ОН- + Na+
Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al2S3 + 6H2O =>2Al(OH)3 + 3H2S
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- => FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию).
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH =>KHSiO3 + KОН 2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S 2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 + 6Н+ + S2- рН =7
Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато. Например, гидролиз хлорида железа (II) включает две ступени:
1-ая ступень FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- =>Fe(OH)+ + 2Cl- + H+
2-ая ступень Fe(OH)Cl + HOH =>Fe(OH)2 + HCl Fe(OH)+ + Cl- + H+ + OH- =>Fe(ОН)2 + Н+ + Cl-
Гидролиз карбоната натрия включает две ступени:
1-ая ступень Nа2СО3 + HOH =>NаНСО3 + NаОН СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
2-ая ступень NаНСО3 + Н2О =>NаОН + Н2СО3 НСО3- + Na+ + H+ + OH- =>Н2СО3 + ОН- + Na+
Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al2S3 + 6H2O =>2Al(OH)3 + 3H2S
Билет №12
Как протекает электролиз раствора сульфата калия. Напишите уравнения катодного и анодного процессов.
Электролиз раствора сульфата калия K2SO4.
В
водном растворе сульфата калия содержатся
ионы K+,
 ,
образующиеся при диссоциации соли и
ионы Н+ и ОН–
из воды.
,
образующиеся при диссоциации соли и
ионы Н+ и ОН–
из воды.
K2SO4
→ K+
+

H2О H+ + OH–.
Так как ионы K+ разряжаются труднее, чем ионы Н+, а ионы , чем ионы ОН–, то при пропускании электрического тока у катода будут разряжаться ионы водорода из воды, у анода – гидроксильные группы из воды, то есть, фактически, будет происходить электролиз воды.
На катоде:
2H2О + 2e = Н2 + 2ОН
На аноде:
2H2О – 4e = O2 + 4H+.
Суммарное уравнение процесса будет иметь вид:
2H2О
![]() 2Н2
+ O2.
2Н2
+ O2.
В то же время, вследствие разряда водородных и гидроксильных ионов воды и непрерывного перемещения ионов K+ к катоду, а ионов к аноду, у катода образуется раствор щелочи (КОН), а у анода – раствор серной кислоты.
Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции в растворах.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:
![]()
Если отрицательно заряженный ион (заряд -1), например Сl- , отдает 1 электрон, то он становится нейтральным атомом:
![]()
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:

Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:

Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:

или он может перейти в нейтральный атом:

Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо методэлектронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
В качестве примера составления уравнений окислительно-восстановительных реакций рассмотрим процесс окисления пирита концентрированной азотной кислотой.
Прежде всего определим продукты реакции. HNO3 является сильным окислителем, поэтому сера будет окисляться до максимальной степени окисления S6+, а железо — до Fe3+,при этом HNO3 может восстанавливаться до N0 или NO2. Мы выберем NO:
![]()
Где будет находиться H2O (в левой или правой части), мы пока не знаем.
Применим сначала метод электронно-ионного баланса (полуреакций). В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция.
При составлении уравнений процессов окисления и восстановления для уравнивания числа атомов водорода и кислорода вводят (в зависимости от среды) или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная). Соответственно и в получаемых продуктах в правой части электронно-ионного уравнения будут находиться ионы водорода и молекулы воды (кислая среда) или гидроксид-ионы и молекулы воды (щелочная среда).
Т. е. при написании электронно-ионных уравнений нужно исходить из состава ионов, действительно имеющихся в растворе. Кроме того, как и при составлении сокращенных ионных уравнений, вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
Рассмотрим для нашего случая полуреакцию окисления. Молекула FeS2 превращается в ион Fe3+ (Fе(NО3)3 полностью диссоциирует на ионы, гидролизом пренебрегаем) и два иона SO42- (диссоциация H2SO4):
![]()
Для того чтобы уравнять кислород, в левую часть добавим 8 молекул Н2О, а в правую — 16 ионов Н+ (среда кислая):
Заряд левой части равен 0, заряд правой +15, поэтому FeS2 должен отдать 15 электронов:
![]()
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
![]()
Необходимо отнять у NО3 2 атома О. Для этого к левой части добавим 4 иона Н1+ (кислая среда), а к правой — 2 молекулы Н2О:
![]()
Для уравнивания заряда к левой части (заряд +3) добавим 3 электрона:
![]()
Окончательно имеем:

![]()
Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
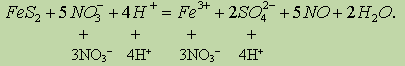
Добавив в обе части уравнения соответствующее количество ионов NO3- и Н+ находим молекулярное уравнение реакции:
![]()
Обратите внимание, что для определения количества отданных и принятых электронов вам ни разу не пришлось определять степень окисления элементов. Кроме того, мы учли влияние среды и автоматически определили, что Н2О находится в правой части уравнения. Несомненно то, что этот метод гораздо больше соответствует химическому смыслу, чем стандартный метод электронного баланса, хотя последний несколько проще для понимания.
Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается:
![]()
Сложнее составить схему окисления, поскольку окисляются сразу два элемента — Fe и S. Можно приписать железу степень окисления 2+, сере 1- и учесть, что на один атом Fe приходится два атома S:
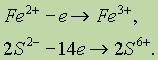
Можно, однако, обойтись без определения степеней окисления и записать схему, напоминающую схему
![]()
Правая часть имеет заряд +15, левая — 0, поэтому FeS2 должен отдать 15 электронов. Записываем общий баланс:

![]()
![]()
пять молекул НNО3 идут на окисление FeS2, и еще три молекулы HNO3 необходимы для образования Fe(NО3)3:
![]()
Чтобы уравнять водород и кислород, добавляем в правую часть две молекулы Н2О:
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности, с участием органических соединений, в которых даже процедура определения степеней окисления является очень сложной.
Рассмотрим, например, процесс окисления этилена, происходящий при пропускании его через водный раствор перманганата калия. В результате этилен окисляется до этиленгликоля НО—CH2—СН2—ОН, а перманганат восстанавливается до оксида марганца (IV), кроме того, как будет очевидно из итогового уравнения баланса, справа образуется также гидроксид калия:

![]()
После проведения необходимых сокращений подобных членов записываем уравнение в окончательном молекулярном виде
![]()
Билет №13
Какие степени окисления наиболее характерны для ванадия, ниобия и тантала? Как изменяется устойчивость высшей степени окисления в ряду V-Nb-Ta?
Элемент Степень окисления
Ванадий |
0, + II , III, IV, V |
Ниобий |
0, +IV, V |
Тантал |
0, +IV, V |
ЭЛЕМЕНТЫ VB–ГРУППЫ: V, Nb, Ta 1 Общая характеристика элементовКонфигурация валентных электронов атомов V, Nb,Ta выражается формулой: (n-1)d3ns2Под валентной оболочкой V и Nb находится остовблагородного газа, у атомов Ta валентным орбиталямпредшествует заполненная 4f14-оболочка.Наличие пяти валентных электронов способствуетпроявлению высшей степени окисления +5. А ихэнергетическая неравноценность обуславливаетпоявление низших степеней окисления +2, +3, +4,которые в большей степени проявляются у ванадия.Для Nb и Ta наиболее устойчива высшая степень окисления +5.
