
- •Объясните природу металлической связи. Какие свойства металлов обусловлены этим типом связи?
- •Скорость химической реакции.
- •Дайте определение понятиям валентность и степень окисления.
- •Ковалентная связь. Метод валентных связей.
- •Чем определяется прочность ковалентной связи?
- •Характеристика растворов. Процесс растворения.
- •Чем определяется место элемента в периоде, группе, подгруппе?
- •Ионная связь.
- •Какие процессы будут протекать при помещении цинковой или железной пластины в раствор соединения меди (II), а медной пластинки – в раствор соединений серебра (I)?
- •Водородная связь.
- •В чем отличие фтора по отношению в воде и щелочам от поведения других галогенов?
- •Гибридизация атомных электронных орбиталей.
- •Элементами какого типа начинается и заканчивается каждый период?
- •Термодинамические величины. Внутренняя энергия и энтальпия.
- •Почему группы элементов разделены на главные и побочные?
- •Термодинамические величины. Энтропия и энергия Гиббса.
- •Какой тип гибридизации атомов углерода в метане, этилене и ацетилене?
- •Неполярная и полярная ковалентная связь.
- •Приведите примеры реакций, иллюстрирующих кислотно-основные свойства дисульфидов олова и кремния.
- •С гидроксидом натрия
- •Электролиз.
- •Как протекает электролиз раствора хлорида меди. Напишите уравнения катодного и анодного процессов.
- •Гидролиз солей.
- •Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато. Например, гидролиз хлорида железа (II) включает две ступени:
- •Как протекает электролиз раствора сульфата калия. Напишите уравнения катодного и анодного процессов.
- •Окислительно-восстановительные реакции.
- •Какие степени окисления наиболее характерны для ванадия, ниобия и тантала? Как изменяется устойчивость высшей степени окисления в ряду V-Nb-Ta?
- •Смещение химического равновесия. Принцип Ле Шателье.
- •Какие степени окисления могут проявлять элементы и как изменяется характерная степень окисления в ряду Co-Rh-Ir?
- •Межмолекулярное взаимодействие.
- •Чем объяснить, что в молекуле аммиака валентный угол равен 107˚c, а в молекуле фторида азота (III) – 102˚c?
- •Строение атомных ядер. Изотопы.
Какой тип гибридизации атомов углерода в метане, этилене и ацетилене?
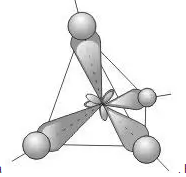
Четыре совершенно одинаковые sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода
А
 томы
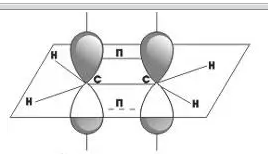
углерода находятся во втором валентном
состоянии (sр2-гибридизация). В результате,
на плоскости под углом 120° образуются
три гибридных облака, которые образуют
три сигма-связи с углеродом и двумя
атомами водорода. Р-электрон, который
не участвовал в гибридизации, образует
в перпендикулярной плоскости -связь с
р-электроном соседнего атома углерода.
Так образуется двойная связь между
атомами углерода. Молекула имеет
плоскостное строение. CH2=CH2
томы
углерода находятся во втором валентном
состоянии (sр2-гибридизация). В результате,
на плоскости под углом 120° образуются
три гибридных облака, которые образуют
три сигма-связи с углеродом и двумя
атомами водорода. Р-электрон, который
не участвовал в гибридизации, образует
в перпендикулярной плоскости -связь с
р-электроном соседнего атома углерода.
Так образуется двойная связь между
атомами углерода. Молекула имеет
плоскостное строение. CH2=CH2В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Н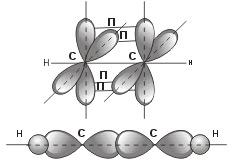 о
в молекуле ацетилена в каждом из атомов
углерода содержится еще по два р-электрона,
которые не принимают участия в образовании
σ-связей. Молекула ацетилена имеет
плоский линейный «скелет», поэтому оба
р-электронных облака в каждом из атомов
углерода выступают из плоскости молекулы
в перпендикулярном к ней направлении.
При этом происходит также некоторое
взаимодействие электронных облаков,
но менее сильное, чем при образовании
σ-связей. В итоге, в молекуле ацетилена
образуются еще две ковалентные
углерод-углеродные связи,
называемые p-связями .
о
в молекуле ацетилена в каждом из атомов
углерода содержится еще по два р-электрона,
которые не принимают участия в образовании
σ-связей. Молекула ацетилена имеет
плоский линейный «скелет», поэтому оба
р-электронных облака в каждом из атомов
углерода выступают из плоскости молекулы
в перпендикулярном к ней направлении.
При этом происходит также некоторое
взаимодействие электронных облаков,
но менее сильное, чем при образовании
σ-связей. В итоге, в молекуле ацетилена
образуются еще две ковалентные
углерод-углеродные связи,
называемые p-связями .
В общем случае p-связью можно назвать ковалентную связь, образованную при перекрывании атомных орбиталей вне линии, соединяющей атомы.
σ-cвязи являются более прочными, чем p-связи, чем объясняется большая реакционная способность непредельных углеводородов по сравнению с предельными.
Неполярная и полярная ковалентная связь.
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Химическая связь – взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. Атом на внешнем энергетическом уровне способен содержать от одного до восьми электронов. Валентные электроны – электроны предвнешнего, внешнего электронных слоев, участвующие в химической связи. Валентность – свойство атомов элемента образовывать химическую связь.
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Общая электронная пара осуществляется через обменный или донорно-акцепторный механизм. Обменный механизм образования ковалентной связи – спаривание двух неспа-ренных электронов, принадлежащих различным атомам. Донорно-акцепторный механизм образования ковалетной связи – образование связи за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Есть две основные разновидности ковалентной связи: неполярная и полярная.
Ковалентная неполярная связь возникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
Ковалентная полярная связь возникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью.
Чем сильнее перекрываются электронные облака, тем прочнее ковалентная связь.
Электроотрицательность – способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Свойства ковалентной связи: 1) энергия; 2) длина; 3) насыщаемость; 4) направленность.
Длина связи – расстояние между ядрами атомов, образующих связь.
Энергия связи – количество энергии, необходимое для разрыва связи.
Насыщаемость – способность атомов образовывать определенное число ковалентных связей.
Направленность ковалентной связи – параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Гибридизация – выравнивание орбиталей по форме и энергии.
Билет №10
