
- •1 . Предмет органическая химия, причины выделения в отдельную науку
- •2 . Теория химического строения органических соединений Бутлерова.
- •3. Изображение органических соединений с помошью структурных формул.
- •5. Гибридизация. Типы гибридизаций.
- •6. Основные типы химических связей.
- •7. Ковалентная химическая связь.
- •8 . Координационная и водородня связи.
- •9. Основные типы химических реакций.
- •10. Понятие механизм орг реакции. Гомолитический механизм.
- •11.Гетеролитический механизм.
- •12. Взаимное влияние атомов в малекуле.
- •1 3. Органические ионы. Свободные радикалы.
- •14. Классификация органических соединений.
- •1 5. Понятие функциональной группы. Осн классы.
- •16.Углеводороды алифатического ряда.
- •17.Номенклатура алканов.
- •18. Понятие изомерия.
- •19. Способы получения алканов.
- •22. Непредельные углеводороды. Номенклатура, изомерия.
- •23. Способы получения алкенов.
- •24. Механизм дегидрогалогенирования и дегидротации спиртов.
- •2 5. Физические свойства алкенов.
- •2 6. Присоединение галогенов по двойной связи, механизм.
- •27. Гидрогалогенирование алкенов.
- •2 8. Гидротация алкенов.
- •29. Алкилирование алканов алкенами.
- •3 0. Реакция окисления алкенов.
- •3 1. Диеновые углеводороды.
- •3 2.Способы получения.
- •33. Свойства диенов с изолированными и сопряженными связями.
- •34. Диеновый синтез. Реакция полимеризации.
- •3 5. Алкины
- •3 6. Способы получения алкинов.
- •3 7. 38. Химические свойства.
- •4 0. 41. Алкилгалогениды. Реакция нуклиофильного замещения.
- •43. Одноатомные спирты.
- •4 4. Химические свойства одноатомных спиртов.
- •46. Химические свойства.
- •47.Карбоновые кислоты и их производные.
- •4 8. Химические свойства карбоновых кислот.
- •51. Ароматические соединения.
- •53. Химические свойства.
- •5 5. Влияние заместителей на реакции эл фил замещения.
- •56. Вмс. Степень полимеризации.
- •57. Полимеризация, виды полимеризации.
- •5 8. Радикальная полимеризация, ее механизм.
- •5 9. Особенности ионной полимеризации.
- •60. Анионная полимеризация.
- •6 1. Поликонденсация.
- •6 3. Диструкция полимеров.
- •6 4. Стабилизация полимеров.
- •65. Полимерные материалы, применение.
60. Анионная полимеризация.
Эта полимеризация протекает через стадию образования карбаниона. Катализаторы – электронодонорные вещества – щелочные металлы, металлорганические соединения (бутиллитий, бутилнатрий) гидриды лития и натрия (LiH, NaH) амид калия (KNH2).
Рассмотрим механизм анионной полимеризации в присутствии КNH2 в среде жидкого аммиака. 1. Инициирование. Мономер внедряется по поляризованной связи металл – углерод.
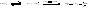
В присутствии металлорганических соединений образование активного центра происходит путем внедрения мономера по поляризованной связи металл-углерод. Например, анионная полимеризация бутадиена-1,3 в присутствии катализатора С4Н9Li начинается с нуклеофильной атаки диена алкил анионом С4Н9−:
я
Электроноакцепторные
заместители (R)
в молекуле мономера способствуют
присоединению аниона. Оттягивая
электронную плотность, они создают
дефицит электронов на конце молекулы,
к которому присоединяется отрицательно
заряженная группа, NH2−,
или другая, например С4Н9−.
2. Рост
цепи.
В процессе этой реакции мономер занимает
место между карбанионом и противоионом.
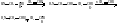
В
процессе этой реакции мономер занимает
место между карбанионом и противоионом.
3. Обрыв
цепи.
Реакции передачи цепи может остановиться
при взаимодействии с растворителем.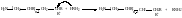 Скорость
анионной полимеризации пропорциональна
квадрату концентрации мономера и корню
квадратному из концентрации катализатора:V
= k
[V2]
√ [K],где
[М] – концентрация мономера, [K]
– концентрация катализатора. Активность
мономеров в анионной полимеризации:акрилонитрил
> стирол > бутадиен Сополимеризация.
Сополимеризация – процесс образования
сополимера совместной полимеризацией
двух или нескольких различных
по
природе мономеров. Например сополимеризация
бутадиена с акрилонитрилом с образованием
бутадиеннитрильного каучука (СКН)
устойчивого к маслам и бензинам.
Скорость
анионной полимеризации пропорциональна
квадрату концентрации мономера и корню
квадратному из концентрации катализатора:V
= k
[V2]
√ [K],где
[М] – концентрация мономера, [K]
– концентрация катализатора. Активность
мономеров в анионной полимеризации:акрилонитрил
> стирол > бутадиен Сополимеризация.
Сополимеризация – процесс образования
сополимера совместной полимеризацией
двух или нескольких различных
по
природе мономеров. Например сополимеризация
бутадиена с акрилонитрилом с образованием
бутадиеннитрильного каучука (СКН)
устойчивого к маслам и бензинам.
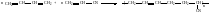
6 1. Поликонденсация.
Поликонденсация – процесс образования полимеров при химическом взаимодействии мономеров, сопровождающийся выделением низкомолекулярных веществ (воды, аммиака, спирта, хлороводорода и др.) При поликонденсации происходит взаимодействие между функциональными группами, входящими в состав мономеров (−ОН, −СООН, −NH2, галогены и др.) Пример. Реакция адипиновой кислоты с гексаметилендиамином. На первой стадии образуется устойчивое соединение с той же функциональностью:
 При
дальнейшей поликонденсации процесс
наращивания полимерной цепи может идти
различными путями: или взаимодействием
образовавшегося димера с одним или
двумя различными мономерами, или
реакцией между отдельными фрагментами
будущего полимера:
При
дальнейшей поликонденсации процесс
наращивания полимерной цепи может идти
различными путями: или взаимодействием
образовавшегося димера с одним или
двумя различными мономерами, или
реакцией между отдельными фрагментами
будущего полимера: В
результате образуется полиамид
(полиамид-6,6).Основные
закономерности и отличительные
особенности реакции поликонденсации.По
характеру функциональных групп,
взаимодействующих при поликонденсации,
мономеры делят на:1. Мономеры с
взаимодействующими
однородными
функциональными группами. Реакция
поликонденсации идет между молекулами
одного и того же мономера:
В
результате образуется полиамид
(полиамид-6,6).Основные
закономерности и отличительные
особенности реакции поликонденсации.По
характеру функциональных групп,
взаимодействующих при поликонденсации,
мономеры делят на:1. Мономеры с
взаимодействующими
однородными
функциональными группами. Реакция
поликонденсации идет между молекулами
одного и того же мономера:

2.
Мономеры, содержащие в молекуле
взаимодействующие
разнородные
функциональные группы:

3. Мономеры с невзаимодействующими однородными функциональными группами. Реакция поликонденсации протекает лишь при взаимодействии между собой мономеров, имеющих функциональные группы одного типа:
 4.
Мономеры с невзаимодействующими
разнородными
функциональными группами, например
H2N−R−OH
(аминоспирт). Такие мономеры для синтеза
полимеров применяются редко. Если в
поликонденсации участвуют однотипные
мономеры, то такой процесс называется
гомополиконденсацией.
4.
Мономеры с невзаимодействующими
разнородными
функциональными группами, например
H2N−R−OH
(аминоспирт). Такие мономеры для синтеза
полимеров применяются редко. Если в
поликонденсации участвуют однотипные
мономеры, то такой процесс называется
гомополиконденсацией.
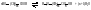
В случае разнотипных мономеров имеет место гетерополиконденсация.
Структура макромолекулярной цепи полимеров определяется функциональностью мономеров. В случае бифункциональных мономеров при поликонденсации образуются линейные полимеры (линейная поликонденсация). Если в поликонденсацию вступают мономеры с функциональностью равной трем и более, то образуются разветвленные или пространственные полимеры. Такая поликонденсация называется пространственной. Чем больше функциональных групп содержит мономер, тем больше степень поперечного сшивания. Поликонденсация протекает через три основные стадииОбразование активных центров (функциональных групп). Как правило, при поликонденсации исходные мономеры уже содержат активные функциональные группы. Однако бывает так, что эти функциональные группы образуются непосредственно в реакции поликонденсации. Например, при синтезе фенолформальдегидных полимеров активные центры (метилольные группы) образуются при взаимодействии фенола с формальдегидом:
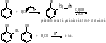
2. Рост цепи. В процессе роста цепи происходит выделение низкомолекулярных веществ. Это приводит к тому, что состав элементарных звеньев полимера не соответствует составу исходного мономера. В этом заключается одно из основных отличий реакции поликонденсации от реакции полимеризации.
3. Прекращение роста и обрыв цепи. Вторая характерная особенность реакции поликонденсации – ее обратимый характер. Для получения полимеров с большой молекулярной массой необходимо удалять выделяющиеся в процессе поликонденсации низкомолекулярные продукты, смещая равновесие в сторону образования высокомолекулярных продуктов.
