
- •1 . Предмет органическая химия, причины выделения в отдельную науку
- •2 . Теория химического строения органических соединений Бутлерова.
- •3. Изображение органических соединений с помошью структурных формул.
- •5. Гибридизация. Типы гибридизаций.
- •6. Основные типы химических связей.
- •7. Ковалентная химическая связь.
- •8 . Координационная и водородня связи.
- •9. Основные типы химических реакций.
- •10. Понятие механизм орг реакции. Гомолитический механизм.
- •11.Гетеролитический механизм.
- •12. Взаимное влияние атомов в малекуле.
- •1 3. Органические ионы. Свободные радикалы.
- •14. Классификация органических соединений.
- •1 5. Понятие функциональной группы. Осн классы.
- •16.Углеводороды алифатического ряда.
- •17.Номенклатура алканов.
- •18. Понятие изомерия.
- •19. Способы получения алканов.
- •22. Непредельные углеводороды. Номенклатура, изомерия.
- •23. Способы получения алкенов.
- •24. Механизм дегидрогалогенирования и дегидротации спиртов.
- •2 5. Физические свойства алкенов.
- •2 6. Присоединение галогенов по двойной связи, механизм.
- •27. Гидрогалогенирование алкенов.
- •2 8. Гидротация алкенов.
- •29. Алкилирование алканов алкенами.
- •3 0. Реакция окисления алкенов.
- •3 1. Диеновые углеводороды.
- •3 2.Способы получения.
- •33. Свойства диенов с изолированными и сопряженными связями.
- •34. Диеновый синтез. Реакция полимеризации.
- •3 5. Алкины
- •3 6. Способы получения алкинов.
- •3 7. 38. Химические свойства.
- •4 0. 41. Алкилгалогениды. Реакция нуклиофильного замещения.
- •43. Одноатомные спирты.
- •4 4. Химические свойства одноатомных спиртов.
- •46. Химические свойства.
- •47.Карбоновые кислоты и их производные.
- •4 8. Химические свойства карбоновых кислот.
- •51. Ароматические соединения.
- •53. Химические свойства.
- •5 5. Влияние заместителей на реакции эл фил замещения.
- •56. Вмс. Степень полимеризации.
- •57. Полимеризация, виды полимеризации.
- •5 8. Радикальная полимеризация, ее механизм.
- •5 9. Особенности ионной полимеризации.
- •60. Анионная полимеризация.
- •6 1. Поликонденсация.
- •6 3. Диструкция полимеров.
- •6 4. Стабилизация полимеров.
- •65. Полимерные материалы, применение.
5 8. Радикальная полимеризация, ее механизм.
Активным центром такой полимеризации является свободный радикал. Как и всякий цепной процесс, полимеризация протекает через три основные стадии. 1. Инициирование. Происходит образование свободного радикала (R1•), который легко взаимодействует с различными непредельными соединениями (мономерами).

В зависимости от способа образования радикала различают термическую, фотохимическую, радиационную и инициированную.
При термической полимеризации свободные радикалы образуются под действием высоких температур (700 – 1000 ˚С).

При фотохимической полимеризации возбужденная молекула взаимодействует с другой молекулой мономера с образованием бирадикала, который диспропорционирует на два радикала
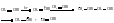
Радиационная полимеризация протекает под действием ионизирующих излучений (α- β- γ-). Наиболее распространенным и часто применяемым на практике методом является инициированная полимеризация. Инициаторами являются соединения, легко распадающиеся на радикалы. Они обычно содержат неустойчивые связи (О – О, N – N, S – S, O – N): перекись бензоила, гидроперекись кумола и др. 2. Рост цепи – многократное присоединение молекулы мономера к усложняющемуся каждый раз радикалу:
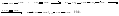
3. Обрыв цепи – рекомбинация двух радикалов, например:
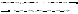
или взаимодействие радикала с растворителем или примесями.
5 9. Особенности ионной полимеризации.
. Полимеризация, при которой ее активный центр – заряд иона – передается последовательно по макромолекулярной цепи при ее росте, называется ионной полимеризацией. Ионная полимеризация – цепной процесс, растущая макромолекула представляет собой ион – катион или анион. В зависимости от этого различают катионную (карбониевую) и анионную (карбанионную). Ионная полимеризация протекает в присутствии катализаторов, способствующих образованию ионов, и называется также каталитической. Особенность ионной полимеризации – ее высокая скорость при низких температурах (от – 50 до – 70 ˚С). Скорость зависит от полярности среды, в которой протекает реакция Ионная полимеризация, как и радикальная, протекает по цепному механизму. Катионная (карбониевая) полимеризация. В качестве веществ катализирующих реакцию могут быть кислоты и катализаторы Фриделя – Крафтса ( AlCl3, BF3, TiCl4 и др.) 1. Инициирование. На этой стадии происходит взаимодействие катализатора (AlCl3) и сокатализатора (HB) с образованием комплексного соединения со свойствами сильной кислоты:AlCl3 + HB → [AlCl3B]¯ H+ Эта кислота, отдавая протон молекуле мономера, превращает его в карбокатион с комплексным противоионом:
[AlCl3B]¯ H+ + СН2 = СНR → СН3 – СНRAlCl3B¯ 2. Рост цепи. Карбокатион взаимодействует с мономером, давая цепь с комплексным противоионом:
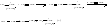
3. Обрыв цепи. Рост цепи прекращается в результате отщепления от растущего иона комплексной кислоты или катализатора.

В результате обрыва цепи катализатор снова выделяется в свободном виде.
Суммарная скорость катионной полимеризации прямо пропорциональны концентрации катализатора, а средняя степень полимеризации от концентрации катализатора не зависит, но прямо пропорциональна концентрации мономера:V = k [K], Pcр.= k’ [M];где [K] – концентрация катализатора, [M] – концентрация мономера.

