
- •1 . Предмет органическая химия, причины выделения в отдельную науку
- •2 . Теория химического строения органических соединений Бутлерова.
- •3. Изображение органических соединений с помошью структурных формул.
- •5. Гибридизация. Типы гибридизаций.
- •6. Основные типы химических связей.
- •7. Ковалентная химическая связь.
- •8 . Координационная и водородня связи.
- •9. Основные типы химических реакций.
- •10. Понятие механизм орг реакции. Гомолитический механизм.
- •11.Гетеролитический механизм.
- •12. Взаимное влияние атомов в малекуле.
- •1 3. Органические ионы. Свободные радикалы.
- •14. Классификация органических соединений.
- •1 5. Понятие функциональной группы. Осн классы.
- •16.Углеводороды алифатического ряда.
- •17.Номенклатура алканов.
- •18. Понятие изомерия.
- •19. Способы получения алканов.
- •22. Непредельные углеводороды. Номенклатура, изомерия.
- •23. Способы получения алкенов.
- •24. Механизм дегидрогалогенирования и дегидротации спиртов.
- •2 5. Физические свойства алкенов.
- •2 6. Присоединение галогенов по двойной связи, механизм.
- •27. Гидрогалогенирование алкенов.
- •2 8. Гидротация алкенов.
- •29. Алкилирование алканов алкенами.
- •3 0. Реакция окисления алкенов.
- •3 1. Диеновые углеводороды.
- •3 2.Способы получения.
- •33. Свойства диенов с изолированными и сопряженными связями.
- •34. Диеновый синтез. Реакция полимеризации.
- •3 5. Алкины
- •3 6. Способы получения алкинов.
- •3 7. 38. Химические свойства.
- •4 0. 41. Алкилгалогениды. Реакция нуклиофильного замещения.
- •43. Одноатомные спирты.
- •4 4. Химические свойства одноатомных спиртов.
- •46. Химические свойства.
- •47.Карбоновые кислоты и их производные.
- •4 8. Химические свойства карбоновых кислот.
- •51. Ароматические соединения.
- •53. Химические свойства.
- •5 5. Влияние заместителей на реакции эл фил замещения.
- •56. Вмс. Степень полимеризации.
- •57. Полимеризация, виды полимеризации.
- •5 8. Радикальная полимеризация, ее механизм.
- •5 9. Особенности ионной полимеризации.
- •60. Анионная полимеризация.
- •6 1. Поликонденсация.
- •6 3. Диструкция полимеров.
- •6 4. Стабилизация полимеров.
- •65. Полимерные материалы, применение.
51. Ароматические соединения.
Главным представителем ароматических углеводородов является бензолГлавной особенностью ароматических соединений является наличие делокализованной замкнутой системы π-электронов, подчиняющейся правилу Хюккеля: плоские циклические системы могут быть ароматическими, если они имеют сопряженную систему π-электронов и число этих электронов равно 4n+2, где n = 0, 1, 2, 3, и т.д.. Изомерия и номенклатура. Общая формула гомологов бензола СnH2n-6. Все шесть атомов водорода в бензоле совершенно одинаковы, поэтому существует только одно монометильное производное бензола – толуол.При замещении двух атомов водорода образуется три изомера (орто-, мета- и пара-), которые отличаются положением заместителей.Вместо буквенного обозначения часто применяют цифровое: 1,2-диметил-бензол, 1,3-диметилбензол, 1,4-диметилбензол соответственно. Изомеры могут отличаться и природой заместителей, которые бывают нормального и разветвленного строения.Кроме того, имея одинаковую брутто формулу, изомеры могут отличаться природой и положением заместителей. Например, углеводород состава С8Н10 имеет 4 изомера: один – этилбензол и три диметилбензола. Для некоторых гомологов бензола используют тривиальные названия: винилбензол – стирол, метилбензол – толуол, диметилбензол – ксилол, и т.д. Ароматические радикалы имеют общее название – арилы. С6Н5−фенил, С6Н5−СН2− бензил, С6Н5−СН= бензаль, С6Н5−С≡ бензо, С6Н4= фенилен.
5 2.
Методы синтеза ароматических соединений.
2.
Методы синтеза ароматических соединений.
1. Ароматизация парафинов. Например – каталитический реформинг С6 фракций нефти. Промежуточный продукт циклогексан, затем дегидрирование на Pt до бензола.

2. Реакция Вюрца – Фиттига. Эта реакция подобна реакции Вюрца, также образуется три продукта, но их легко разделить.
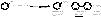 3.
Синтез тримеризацией ацетилена (см.
выше).
3.
Синтез тримеризацией ацетилена (см.
выше).
4. Реакция Фриделя – Крафтса.
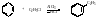
5. Восстановление по Клименсену.
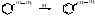
6. Синтез из солей ароматических кислот.
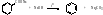

53. Химические свойства.
В основном это реакции электрофильного замещения, а также некоторые реакции присоединения1.Реакции замещения. Это реакции электрофильного замещения (SE). К ним относятся реакции галогенирования, нитрования, сульфирования, алкилирования и ацилирования (реакции Фриделя-Крафтса) и некоторые другие
а) Галогенирование
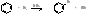
Бензол Бромбензол
б) Нитрование
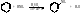
Бензол Нитробензол
в)
Сульфирование
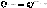
Бензол бензолсульфокислота (100%)
г) Алкилирование по Фриделю-Крафтсу.
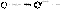
Бензол трет-бутилхлорид трет-бутилбензол (60%)
д) Ацилирование по Фриделю-Крафтсу
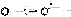
Бензол пропионилхлорид пропиофенон (90%)
В механизме электрофильного замещения есть общие закономерности. Реакции имеют ионный характер и протекают в несколько стадий.
Первой стадией электрофильного замещения является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с заряженной электрофильной частицей или нейтральным электрофильным реагентом (SO3).
X―Y → X+ + Y–
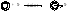
π- комплекс 1
Вторая стадия состоит в переходе π-комплекса в σ-комплекс (бензониевый ион). Это происходит в результате выведения из сопряженной системы шести электронов двух электронов для образования новой ковалентной связи С―Х. Оставшиеся четыре π-электрона распределяются между пятью углеродными атомами бензольного кольца.
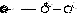
Образовавшийся σ-комплекс можно изобразить иначе, в виде пентадиенильного катиона. Граничные (крайние) структуры могут быть представлены следующим образом:
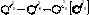
σ- комплекс (бензониевый ион)
σ-Комплекс – промежуточная частица представляет собой неустойчивый не ароматический карбокатион. Шесть его углеродных атомов находятся в разных валентных состояниях: один – насыщенный в первом валентном состоянии (sp3-гибридизация), а пять других - в обычном для бензола втором валентном состоянии (sp2-гибридизация) Атом Х (или группа) и водород при насыщенном углеродном атоме расположены в плоскости перпендикулярной плоскости бензольного кольца. Процесс образования карбокатиона подобен образованию карбокатиона в случае электрофильного присоединения НХ к алкенам, но стабилизация карбокатионов протекает различным образом. В случае алкенов – за счет присоединения аниона, в случае бензониевого иона – за счет выброса протона с восстановлением ароматичности.
σ- комплекс π- комплекс 2 замещенный бензол
