
- •1. Загальні положення
- •2. Зміст кваліфікаційної бакалаврської роботи
- •2.1. Структура та об'єм роботи
- •2.2. Зміст пояснювальної записки
- •2.3. Ілюстративний матеріал
- •2.4. Зміст пояснювальної записки до експериментальної роботи
- •3. Вимоги до структури розділів пояснювальної записки
- •Основна частина
- •3.1. Обґрунтування та вибір способу і технологічної схеми виробництва
- •3.2. Характеристика виробленої продукції, вихідної сировини та напівпродуктів, матеріалів, енергетичних ресурсів
- •3.3. Характеристика прийнятого методу виробництва, хімізм, теоретичні основи і обґрунтування норм технологічних режимів
- •3.4. Опис технологічної схеми виробництва
- •3.5. Визначення витратних коефіцієнтів з сировини, напівпродуктів, допоміжних матеріалів та енергоносіїв
- •3.5.1. Розрахунок матеріального балансу виробництва
- •3.5.2. Розрахунок енергетичного (теплового) балансу виробництва
- •3.5.3. Розрахунок витратних коефіцієнтів
- •3.6. Характеристика технологічного обладнання
- •3.6.1. Розрахунок та вибір основних реакторів
- •3.6.2. Розрахунок та вибір допоміжного технологічного обладнання
- •3.7. Програмування технологічних розрахунків на персональних комп‘ютерах
- •3.8. Екологічна безпека виробництва
- •Висновки
- •4. Захист кваліфікаційної бакалаврської роботи
- •5. Приклади оформлення деяких розділів (підрозділів) дипломної роботи на тему: „одержання бензинової фракції каталітичного крекінгу – базового компоненту товарних бензинів”
- •5.1. Характеристика сировини каталітичного крекінгу
- •5.2. Описання технологічної схеми установки каталітичного крекінгу з псевдозрідженим шаром мікросферичного каталізатора
- •6. Технологічні розрахунки установки каталітичного крекінгу з псевдозрідженим шаром мікросферичного каталізатора
- •6.1. Послідовність розрахунку реактора установки каталітичного крекінгу
- •6.2. Матеріальний баланс
- •6.3. Кількість циркулюючого каталізатора і витрати водяної пари
- •6.4. Тепловий баланс реактора
- •6.5. Розміри реактора
- •6.6. Тиск у основи зони відпарки (десорбера).
- •6.7. Вибір розподільного пристрою парокаталізаторного
- •6.8. Допоміжне обладнання–циклони реактора
- •Висновки
- •Список використаних джерел
- •Завдання на виконання кваліфікаційної бакалаврської роботи
- •1. Тема кваліфікаційної бакалаврської роботи: “Одержання бензинової фракції каталітичного крекінгу – базового компоненту товарних бензинів”
- •Продовження додатку б
- •Додаток в Приклад оформлення реферату пояснювальної записки
- •Додаток г Приклад оформлення змісту пояснювальної записки кваліфікаційної бакалаврської роботи
- •Методичні рекомендації до кваліфікаційної бакалаврської роботи спеціальності 6.051301 „хімічна технологія”
- •03058, Київ-58, просп. Космонавта Комарова, 1
6.4. Тепловий баланс реактора
Рівняння теплового балансу реактора у загальному вигляді:
Qc+Qц1+Qк1+Qп1+Qд1+Qз.к=Qг+Qб+Qл.г+Qт.г+Qк2+Qк+Qц2+Qд2+Qп2+Qр+Qв.т
Ліва частина рівняння відповідає приходу фізичного тепла (у кВт): Qc — з сировиною; Qц1— з рециркулюючим каталітичним газойлем; Qк1— з циркулюючим каталізатором; Qп1— з водяною парою, що подається в транспортну лінію; Qд1— з водяною парою, що подається на відпарку вуглеводнів з каталізатора; Qз.к. – з залишковим коксом.
Права частина рівняння відповідає витратам фізичного тепла (у кВт): Qг— з газами крекінгу, що утворилися; Qб – з парами бензину;Qл.г — з парами легкого газойлю; Qт.г. — з парами важкого газойлю; Qк2— з циркулюючим каталізатором; Qк — з коксом, що утворився при крекінгу; Qц2–з рециркулюючим газойлем; Qд2–з водяною парою, що подається на відпарку вуглеводнів з каталізатора; Qп2— з водяною парою, що подається у транспортну лінію; Qр — витратам тепла на реакції каталітичного крекінгу; Qв.т.–втрати тепла у навколишнє середовище.
З теплового балансу реактора визначимо температуру сировини при подачі його у вузол змішання з каталізатором.
Через те, що повний технологічний розрахунок установки каталітичного крекінгу ми не виконуємо, за літературними і промисловими даними приймаємо наступні температури потоків на вході в реактор: Тц1= 561 К — температура рециркулирующего каталітичного газойлю;Тк1= 873 К — температура каталізатора [19]; Тп1= 873 К — температура водяної пари, що подається у транспортну лінію (з тиском Р = 0, 46∙106 Па) [58]; Тд1 = 783 К – температура водяної пари [32], що надходить у відпарну зону реактора за тиску
0, 46∙106 Па.
Разрахуємо ентальпію потоків. Попередньо визначимо склад крекінг-газу.
При проектуванні промислових установок каталітичного крекінгу користуються даними хроматографического аналізу газу, одержаного за крекінгу сировини у лабораторії. При відсутності лабораторних даних можна користуватися літературними [19; 3; 21].
У табл. 6.3 наведений зразковий склад крекінг
Таблиця 6.3.
Зразковий склад крекінг-газу
Компоненти |
Mi |
Вихід мас. % на сировину |
Кількість |
|
кг/год |
кмоль/год |
|||
H2S |
34 |
0,85 |
2125 |
62,5 |
H2 |
2 |
0,20 |
500 |
250,0 |
СН4 |
16 |
2,31 |
5770 |
361,0 |
С2Н4 |
28 |
0,57 |
1424 |
51,0 |
С2Н6 |
30 |
1,25 |
3120 |
104,0 |
С3Н6 |
42 |
3,22 |
8050 |
191,8 |
С3Н8 |
44 |
2,43 |
6070 |
138,0 |
С4Н8 |
56 |
3,95 |
9868 |
176,4 |
С4Н10 |
58 |
2,92 |
7323 |
126,3 |
Разом |
|
17,70 |
44200 |
1461,0 |
Через низький тиск у реакторі вплив тиску на ентальпію не враховується. Знаючи склад крекінг-газу, можна знайти ентальпію компонентів і потім підрахувати ентальпію суміші за правилом змішання. У табл. 6.4 наведені ентальпії компонентів газу в інтервалі температур 673—773 К. Наприклад, ентальпія сірководню за 673 К дорівнює добутку питомої ентальпії, визначеної за довідником, на масову частку останнього у крекінг-газі:
432,2·0,048 = 20,74 кДж/кг.
Сума ентальпій компонентів дорівнює ентальпії крекінг-газу за даної температури. Шляхом інтерполяції можна визначити ентальпію газу за проміжних температур.
Ентальпія вуглеводневих парів (у кДж/кг) визначається за таблицями, наведеними у додатку, або за формулою [6]:
![]()
Для визначення ентальпії рідких вуглеводнів (у кДж/кг) також можна скористатися таблицями або формулою [6]):
![]() ,
,
Таблиця 6.4.
Ентальпії компонентів газу в інтервалі температур 673—773 К
-
Компоненти
Склад
хi,
мac. %
Ентальпія, кДж/кг
673 К
773 К
q

q

q
q
H2S
4,80
432,2
20,74
548,3
26,3
H2
1,13
5798,0
65,50
7255,0
82,0
СН4
13,07
1127,0
147,20
1495,0
195,4
С2Н4
3,22
858,6
27,66
1143,0
36,8
С2Н6
7,07
988,0
69,82
1323,0
93,5
С3Н6
18,22
853,8
155,60
1139,0
207,4
С3Н8
13,76
967,3
133,00
1293,5
177,8
С4Н8
22,28
896,0
199,70
1193,0
266,2
С4Н10
16,45
967,3
159,20
1290,0
212,2
Разом
100,00
–
978,4
1297,6
де
![]() — відносна густина рідкого вуглеводню;
Т
—
температура
потоку, К.
— відносна густина рідкого вуглеводню;
Т
—
температура
потоку, К.
Ентальпії вуглеводневих парів і рідин, а також каталізатора і коксу підраховані і наведені у табл. 6.5.
Таблиця 6.5.
Ентальпії вуглеводневих парів, рідин, каталізатора і коксу
Позначення потоку |
Стан |
Темпе- ратура, К |
Кількість, кг/год |
Ентальпія, кДж/кг |
Кількість тепла, кВт |
Прихід |
|
|
|
|
|
Qс |
Р |
Тс |
250 000 |
qс |
Qс |
Qц1 |
Р |
561 |
71 000 |
648,0 |
12 790 |
Qк1 |
Т |
873 |
1 750 000 |
678,4 |
329 500 |
Qп1 |
П |
873 |
10 000 |
3708,0 |
10 300 |
Qд1 |
П |
783 |
12 430 |
3510,0 |
12 130 |
Qз.к |
Т |
873 |
7 000 |
1506,0 |
2930 |
Разом |
— |
— |
— |
— |
Qс+367550 |
Витрати |
|
|
|
|
|
Qг |
Г |
758 |
44 250 |
1252,0 |
15 380 |
Qб |
П |
758 |
112 750 |
1162,0 |
36 330 |
Qл.г |
П |
758 |
39 250 |
1102,5 |
12 020 |
Qв.г |
П |
758 |
32 000 |
1097,0 |
9 755 |
Qк2 |
Т |
758 |
1 750 000 |
548,8 |
26 650 |
Qк |
Т |
758 |
28 750 |
1219,0 |
9 720 |
Qц2 |
П |
758 |
71000 |
1102,5 |
21 720 |
Qп2 |
П |
758 |
10 000 |
3455,0 |
9 600 |
Qд2 |
П |
758 |
12 430 |
3455,0 |
11920 |
Qр |
— |
— |
250 000 |
205,2 |
14 250 |
Qп |
Приймається |
— |
— |
815 |
|
Разом |
– |
— |
— |
— |
409 160 |
Ентальпія каталізатора і коксу підрахована за формулою:
![]() ,
,
де
![]() —
ентальпія каталізатора або коксу,
кДж/кг; с
—
теплоємність каталізатора або коксу,
кДж/(кг.К);
Т—
температура каталізатора або коксу, К.
—
ентальпія каталізатора або коксу,
кДж/кг; с
—
теплоємність каталізатора або коксу,
кДж/(кг.К);
Т—
температура каталізатора або коксу, К.
Теплоємність каталізатора дорівнює 1.05–1.13 кДж/(кг∙К) [32, 33], теплоємність коксу 1,65–2,51 кДж/(кг∙К) [6].
Теплоємність каталізатора і коксу прийнята відповідно рівною 1,13 і 2,51 кДж/( кг-К).
Ентальпія водяної пари визначається з діаграми t — S [35] для водяної пари або з таблиць ВТИ залежно від температури і тиску. Температуру пари приймають, виходячи з діапазону зміни температур у реакторі і охолоджуючих змійовиках регенератора.
Реакція каталітичного крекінгу супроводжується поглинанням тепла. На рис. 6.3 [15] наведені зразкові дані про тепловий ефект реакції каталітичного крекінгу залежно від глибини перетворення у масових відсотках.
Глибина перетворення визначається з табл. 6.1:
100 – (15,7 + 12,8) = 71,5 мас.%.
При глибині перетворення 71,5 мас. % величина теплового ефекту становить 205,2 кДж на 1 кг сировини.
З теплового балансу (табл. 6.5) маємо:
Qc = 409140 – 367550 = 41590 кВт.
Ентальпія сировини:
![]() кДж/кг.
кДж/кг.
Щоб за найденою ентальпією визначити температуру сировини, необхідно знати іі фазовий стан.
Інтервал температури, за якого сировина буде випаровуватися, у низу реактора:
![]() .
.
Величину
інтервалу температури
![]() можна
визначити за формулою [32]:
можна
визначити за формулою [32]:
![]() ,
,
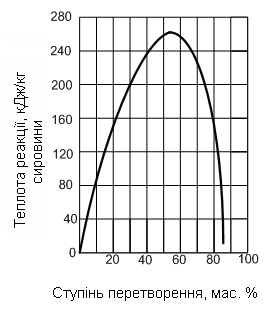
Рис. 6.3. Графік для визначення теплового ефекту реакції каталітичного крекінгу.
де
![]() —
масова частка рідкого залишку за
однократного випаровування сировини.
—
масова частка рідкого залишку за
однократного випаровування сировини.
Допустимо, що сировина подається у вузол змішання у рідкому стані, тоді частка відгону е = 0 і з двох дійсних коренів квадратного відносно ДГ рівняння до уваги приймемо найменше числове значення, рівне ΔТ = 91 К. При цьому граничне значення температури, за якої сировина практично перебуває ще у рідкому стані, виявиться рівним:
Тр.с = 758 – 91 = 667 К.
Якщо температура сировини буде вище 667 К, то відбудеться часткове її випаровування.
Відповідно до ентальпії сировини температура Тс = 540 К. [6]. Отже, сировина подається у вузол змішання у рідкому стані.
Температура сировини у промислових установках знаходиться у межах 473 – 633 К [19].
