
- •1)Химия – это наука о веществах, их строении , свойствах и превращения одних веществ в другие.
- •Закон эквивалентов.
- •4) Строение многоэлектронных атомов. Принцип Паули. Правило Хунда. Правило Клечковского
- •5)"Свойства химических элементов (т.Е. Свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
- •Физический смысл химической периодичности
- •Структуры короткопериодного и длиннопериодного вариантов периодической системы элементов
- •10) Химическое сродство (сродство реакции), параметр термодинамическое системы, характеризующий отклонение от состояния химический равновесия. Если реакцию записать в виде уравнения:
- •13) Растворы-это гомогенные системы, состоящие из двух и более компонентов, количественное соотношение которых могут меняться.
- •Энтальпия.
- •Энтропия.
- •Вывод значения ионного произведения воды
Структуры короткопериодного и длиннопериодного вариантов периодической системы элементов
Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную).
В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют сходное строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Электронные аналоги
Полными электронными аналогами называются элементы, которые будут иметь одинаковое строение внешнего электронного слоя во всех степенях окисления.
Неполные электронные аналоги имеют одинаковое строение внешнего слоя, только при определенной степени окисления.
6)Энергией ионизации (количественная характеристика металличности) - количество энергии которое необходимо для отрыва электрона от атома. Iион кДж/моль. I1 для отрыва 1е. Э0 + Iион= Э+ + е
Сродством атома к электрону (количественная характеристика неметалличности)- это энергия которая выделяется при присоединении 1е к атому. Еср=кДж/моль. Э0 + е = Э- + Еср
Электроотрицательность
- это способность атомов притягивать
электроны, которые участвуют в образовании
химических связей с другими атомами.
ЭО =

Энергия ионизации в периоде восстановительные свойства слева направо увеличивается, в группе сверху вниз уменьшается. Энергия сродство электрона в периоде слева направо уменьшается, в группе сверху вниз увеличивается. Электроотрицательность в периоде слева направо увеличивается, в группе сверху вниз уменьшается.
Энергия ионизации и сродство к электрону зависят от радиуса атома и поэтому характер их изменения по периодам и подгруппам таблицы ПС близок к характеру изменения радиуса. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а восстановительные свойства ослабевают. Восстановительная активность атомов вдоль по периоду уменьшается, а окислительная – увеличивается. Самым сильными восстановителями являются элементы, находящиеся в начале каждого периода и в конце первой главной подгруппы( элементы цезий Cs, фраций Fr). Их атомы имеют самые низкие значения энергии ионизации. Самым сильными окислителями являются элементы, располагающиеся в правом верхнем углу таблицы периодической системы ( фтор, кислород, хлор). Атомы этих элементов обладают наивысшими значениями сродства к электрону. Кислотно-основные свойства. Чем стабильнее анион, образующийся из кислоты, тем сильнее кислота. Устойчивость аниона определяется электроотрицательностью элемента в кислотном центре. Чем больше электроотрицательность, тем сильнее кислотные свойства.
10) Химическое сродство (сродство реакции), параметр термодинамическое системы, характеризующий отклонение от состояния химический равновесия. Если реакцию записать в виде уравнения:
где L1, ..., Lk - исходные реагенты, Lk+1, ..., Lk+m - продукты реакции, v1, ..., vk и vk+1 , ..., vk+m - стехиометрич. коэффициент, то химическое сродство А равно:
где - химический потенциалы соответственно исходных реагентов и продуктов. В состоянии равновесия
При A > 0 неравновесное состояние системы характеризуется избытком исходных реагентов и для достижения равновесия реакция должна идти слева направо; при А < 0, наоборот, система содержит избыток продуктов и реакция должна идти в противоположном направлении. Химическое сродство равно макс. полезной работе реакции, взятой со знаком минус. химическое сродство определяет собственно химический процесс, связанный лишь с изменением состава системы и не связанный с работой по преодолению сил внешний давления.
Единица измерения химическое сродство - Дж/моль.
Направление химических реакций.
Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0 вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH.
Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в заданном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
ΔG° = -RTlnK = -RT•2.3lgK
где R - универсальная газовая постоянная: 8.31441 Дж/(моль•K).
Для обратимых реакций можно найти такое значение температуры, при которой K = 1 и ΔG° = 0. При этой температуре (она обозначается так: T↔) протекание прямой и обратной реакции равновероятно; эта температура называется температурой равновесия протекания реакции.
Между энергией Гиббса реакции и константой равновесия существует соответствие:
ΔGT > 0 K < 1
ΔGT = 0 K = 1
ΔGT < 0 K > 1
Таким образом, преобладающее направление протекания обратимой реакции определяется знаком энергии Гиббса; практически важное прямое направление реакции, т.е. сдвиг равновесия в сторону образования продуктов преобладает при условии ΔGT << 0 K >> 1.
Энергия Гиббса (G) учитывает влияние двух факторов: энтальпия и энтропия на возможность протекания реакции
Если ∆G<0, реакция протекает самопроизвольно
Если ∆G>0, реакция не может самопроизвольно протекать
Если ∆G=0, устанавливается равновесие
∆G для простых веществ = 0
 I.
I.
II. ∆G =∆H-T*∆S
∆G=[кДж/моль]
Энтропия (S) – мера беспорядка в системе
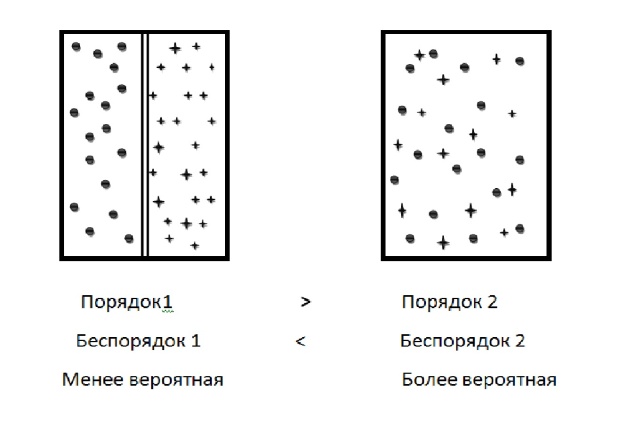
Самопроизвольно протекают процессы при котором система переходит из менее вероятного в более вероятное (в направление большего «>»)
S=k*ln(w), где R – постоянная Больцмана, w – термодинамическая вероятность
Энтропия характеризуют число микросостояний, которые осуществляется данное микросостояние
При t=-273 К (абсолютный 0) S=0
S – табличная величина
11) - Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений. Кинетика химическая устанавливает временные закономерности протекания хим. р-ций, связь между скоростью р-ции и условиями ее проведения, выявляет факторы, влияющие на скорость и направление хим. р-ций.
- Скорость химической реакции определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
-Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции
- Влияние температуры на скорость химической реакции- повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее правило: При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 — 4 раза.
![]()
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
![]()
-Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
-Катализатор — это вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на товар и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Виды катализаторов
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Механизм действия катализаторов
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение: А + К = АК
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается: АК + В = АВ + К
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение быстро протекающей реакции: А + В = АВ
