
Вопрос №30
Фенолы. Классификация. Номенклатура. Физические свойства. Кислотные свойства, получение фенолятов. Нуклеофильные свойства фенола: получение простых и сложных эфиров. Окисление фенолов. Реакции электрофильного замещения в фенолах: галогенирование, нитрование, сульфирование, нитрозирование, карбоксилирование. Фенол; 2,4,6-тринитрофенол (пикриновая кислота); a- и b-нафтолы. Идентификация фенольных соединений. Спектральные характеристики фенолов. Многоатомные фенолы. Строение, свойства. Пирокатехин, резорцин, гидрохинон, флороглюцин.
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.

Номенклатура.
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.

Химические свойства.
Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na
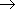
2C6H5ONa
+ H2
фенолят натрия
C6H5OH + NaOH C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной
 -системе
бензольного кольца, при этом увеличивается
электронная плотность у 2-го, 4-го и 6-го
атомов углерода (орто-
и пара-положения)
и уменьшается у 3-го и 5-го атомов углерода
(мета-положение).
а)
Реакция с бромной водой (качественная
реакция):
-системе
бензольного кольца, при этом увеличивается
электронная плотность у 2-го, 4-го и 6-го
атомов углерода (орто-
и пара-положения)
и уменьшается у 3-го и 5-го атомов углерода
(мета-положение).
а)
Реакция с бромной водой (качественная
реакция):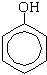
+ 3Br2
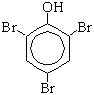
+ 3HBr
Образуется 2,4,6-трибромфенол - осадок белого цвета. б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.) H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров)
-
+ 3HNO3(конц.) 3H2O +
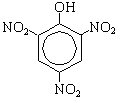
По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
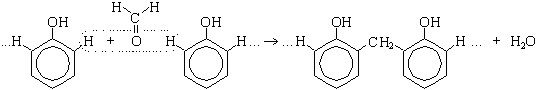
Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
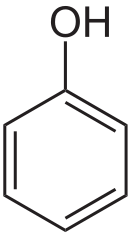
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол).
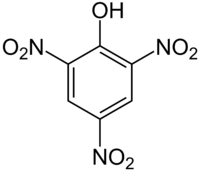
2,4,6-Тринитрофенол (пикриновая кислота) — химическое соединение C6H2(NO2)3OH, нитропроизводное фенола.
Нафтолы — оксипроизводные нафтена (нафталина) C10H(8-n)(ОН)n, где n = 1, 2, 3 и более. По свойствам нафтолы близки к фенолам бензольного ряда. В больших количествах нафтолы и их производные применяют в производстве красителей и органических полупродуктов.

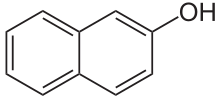
1-Нафтол (α-нафтол) 2-Нафтол (β-нафтол)
Идентификация фенольных соединений. Спектральные характеристики фенолов. (см учебник том 1 стр 387).
Многоатомные фенолы – это двух- или трехатомные фенолы.
Существует три простейших двухатомных фенола: о-диоксибензол, или пирокатехин, м-диоксибензол, или резорцин, п-диоксибензол, или гидрохинон.
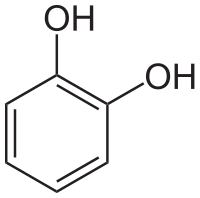
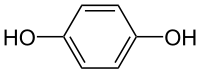
Пи
Пирокатехин гидрохинон
Двухатомные фенолы гораздо легче растворимы в воде, чем одноатомные. Одноатомные фенолы сравнительно легко окисляются; у двухатомных фенолов эта способность выражена сильнее: некоторые двухатомные фенолы окисляются настолько легко, что применяются в качестве восстановителей (проявителей) в фотографии (гидрохинон). Двухатомные фенолы менее ядовиты, чем одноатомные. С FeСl8 двухатомные фенолы дают характерное окрашивание, что позволяет различать их по цвету.
Трехатомные фенолы (трифенолы).
Представителем триоксибензолов является флороглюцин (1,3,5-триоксибензол), в свободном виде он обнаружен в шишках секвойи и чешуе лука, а в виде гликозида флорина – в околоплоднике плодов разных видов цитрусов.

Более сложные соединения - флороглюциды (гликозиды флороглюцина), они могут содержать одно кольцо флороглюцина (аспидинол) или представляют собой димеры или тримеры (кислоты флаваспидиновая и филиксовая).
Значительные количества флороглюцидов накапливается в корневищах мужского папоротника.

аспидинол
