
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •22 Вопрос
- •23 Вопрос
- •26 Вопрос
- •27 Вопрос
- •33 Вопрос
- •34 Вопрос
- •36 Вопрос
- •37 Вопрос
- •39 Вопрос
- •40 Вопрос
- •46 Вопрос
- •48 Вопрос
- •50 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •Получение этанола сернокислотной гидратацией этилена.
- •2. Прямая гидратация этилена в этанол.
- •59 Вопрос
- •58 Вопрос
40 Вопрос
Реакторы с различным тепловым режимом.
В зависимости от теплового режима реакторы подразделяются на адиабатические, изотермиечкие и политермические. Адиабатические и изотермические реакции не существуют, но уравнения этих моделей используются для рассчёта реакторов действующих в промышленности.
Исходным уравнением для рассчёта с учётом тепла, является уравнение теплового балланса, которое составляют по одному из компонентов реакционной смеси.
Тепловой балланс в общем виде можно представить уравнением.
Qприх = Qрасх
Qприх — это количество тепла поступающее в реактор в единицу времени.
Qрасх — это количество тепла удаляющееся из реакции в единицу времяни.
А прверащается в R + Q, где Q — это тепло вделившееся при химической реакции.
Qприх =Qхр + Qреа, где
Qхр — количество тепла выделяющееся в результате химической реакции в единицу времени;
Qреаг — это количество тепла вносимого вместе с реагентами в единицу времени.
Qрасх=Qпрод+Qнак+Qт, где
Qпрод — это количество тепла уносимого из реактора продуктами реакции в единицу времени;
Qнак — это количество тепла накапливающееся в реакторе в единицу времени;
Qт — это количество тепла расходуемое в единицу времени в результате теплообмена с окружающей средой.
Qхр+Qреакг=Qпрод+Qнак+Qт
Qнак=-(Qпрод-Qреаг)-Qт+Qхр.
(Qпрод-Qреаг), разность между теплом уносимым продуктами и теплом вносимым в реактор исходными реагентами — конвективный поток тепла, Qконв = Qпрод — Qреаг.
Qнак=-Qконв-Qт+Qхр — уравнение теплового балланса (1).
Уравнение теплового балланса принимает различную форму в зависимости от типа реактора и теплового режима процесса. В общем случае имеет место изменение параметров процесса по объёму или по времени, по этому тепловой баланс составляют в дифференциальной форме.
Для этой цели используют дифференциально уравнение конвективного теплообмена, с учётом тепла химической реакции и отвда тепла в результате теплообмена.
роСp dT/dt=-роСp(wх(dT/dx+wydT/dy+wzdT/dz)+лямбда(d^2 T/dx^2 + d^2 T/dy^2 + d^2 T/dz^2)- Fуд К дельтаТ + wа дельтаH. (2)
w - скороть движения потока.
Лямбда — коээфициент теплопроводности смеси.
ДельтаТ = Т-Тт, где
Т — температура смеси; Тт — температура в теплообменнике.
Произведение в левой части уравнения (2) выражает скорость накопления тепла в элементарном объёме, для которого составляется тепловой балланс. В првой части, первая сумма отражает конвективный пернос тепла по соответстующим координатам вторая сумма отражает изменение тепла связанное с тпеловроводностью реакционной среды, в сумме правая часть до разности = Qконв, дальнейшие слагаемые это Qт и Qхр соответсвенно. В общем виде это уравнение не решают.
Уравнения (1) и (2) представляют описание потоков тепла в неустановившемся режиме, когда происходит накопление тепла и температура меняется во времени.
Для непрерывного реактора характерен установившийся режим, неустановившийся наблюдается только в пусковой период и в период остановки реактора. В реактора периодического действия режим всегда не стационарен, происходит накопление тепла в результате химической реакции и температура в любой точке реактора меняется во времени.
Адиабатический непрерывный реактор идеального смешения.























Реактор стеники которого имеют теплоизоляцию для поддержания адиабатического режима.
При протекании экзотермической реакции, температура увеличивается у меньшением концентрации компонента А, по этому знаки у тепловых потоках разные в различных частях уравнения.
Qт=0
Qконв=0
Qнак=Qхр
роСp dT/dt = -wa дельта Н
wa = dCa/dt
роСp dT/dt = - dCa/dt дельта Н
роСp dT = -дельтаН dCa
Са = Са0(1-ха)
роСpdT = -дельтаНd(1-ха)Са0 = дельтаНCа0dxa
роCp/Ca0 dT = дельтаН dxa
ро Cp/Ca0 = Cp
дельтаНdx=CpdT.
Это уравнение теплового балланся для адиабатического реактора периодического действия.
Адиабатические реакторы непрерывного действия.
В адиабатических проточных реакторах отсутствует теплообмен с окружающей средой.
Qт=0. В стационарных условиях отсутствует накопление тепла Qнак = 0
Qхр = Qконв.
Р ассмотрим
адиабатический реактор идеального
вытеснеия А-РИВ — это трубчатый реактор
снабжённый теплоизоляцией.
ассмотрим
адиабатический реактор идеального
вытеснеия А-РИВ — это трубчатый реактор
снабжённый теплоизоляцией.
















Конвективный перенос тепла так же как и вещества происходит только в направлении перемещения основного потока реагентов, тоесть по длине реактора.
Изменением температуры за счёт теплопроводности можно пренебречь.
dt/dx = dt/dl
dt/dy=o
dt/dz = 0
лямбда(d^2 T/dx^2 + d^2 T/dy^2 + d^2 T/dz^2)=0
-wa дельтаН = wроСp dt/dl = -Ca0d(1-xa)/dt = Ca0dxa/dt
-wa=-dca/dt
Ca0dxa/dt дельтаН = wроСp dT/dl
dl = wdT
Ca0 дельтаН dxa = роСp dT
дельта Н dxa - = Cp dT
ро Сp/Ca0 = Cp
Уравнение теплового балланся составляется на 1 кмоль компонента А.
Уравнение теплового балланса для А-РИСП и для РИВ по форме одинаковы, но в случее РИВ, правая часть характеризует тепло уносимое из элемента объёма конвективным потоком реагентов а для А-РИСП — это накопление тепла.
При стационарном режиме работы РИВ, скорость тепловыделения и скорость уноса тепла конвективным потоком равны между собой, что обеспечивает неизменность температуры во времени для любой точки реактора. Но температура меняется по длине реактора.
Адиабатический реактор идеального смешения непрерывного действия.
В реакторах идеального смешения непрерывного действия, отстутствуют градиенты параметров как во времени, то и по объёму реактора, по этому уравнение теплового балланса составляют в конечных величинах для всего реактора. Благодаря интенсивному перемешиванию, все параметры на входе (имеющие индекс 0) мнгновенно изменяются до выходных параметров Ca; xa; T.
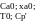



















Cp'' и cp' — теплоёмкости смеси на выходе и на входе, в рассчёте на 1 кмоль вещества А.
Qнак = 0
Qт = 0
Qконв = Qпрод — Qреакг
Qпрод = Cp''T
Qреаг = Cp'T0
Qконв = Cp''T-Cp'T0
Cp''=Cp'=Cp
Qконв = Cp(T-T0)
Qхр = дельтаН(ха — ха0)
ха0 = 0
Qхр = дельтаН ха
дельтаН ха = Cp(T-T0)
Уравнение теплового балланса показывает, что в А-РИС-Н, всё тепло химической реакции расходуется на нагрев реагента от Т0 до Т, и уносится конвективным потоком из реактора. Уравнение составлено для всего реактора в рассчёте на 1 кмоль вещества А. Из уравнения следует, что между степенью превращения и температурой существует линейная зависимость. При полном превращении исходного вещества А, тоесть при ха =1, T – T0 максимальна и называется адиабатической разностью температур.
ДельтаН = Cp дельтаТад
дельтаТад = дельтН/Cp
Для любого вещества, температура в реакторе может быть рассчитана по уравнению адиабаты
T = T0 +/- дельтаТад * ха = Т0 +/- дельтаН / Cp * ха, где + соответствует экзотермической реакции, а — эндотермической реакции.
Решение уравнения теплового балланса заключается в нахождении оптимальных параметров, при которых наблюдается равенство между приходом и расходом тепла. Для решения используется графический метод.
Для решения уравнения теплового балланся, необходимо найти функциональную зависимость частей уравнения от температуры.
Qприх = Qхр = дельта H * xa = f(x)
Qрасх
= Qконв = Cp(T-T0) = фи(Т)





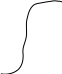











Если
совмести обе кривые, то точки пересечения
будут отвечать стационарным
состояниям,когдаUприх
= Uрасх.

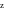


В точке z — система устойчива, но степено превращения вещества А мала; в точке м — система не устойчива; в точке к степень превращения наибольшая при устойчивой системе.
Система называется устойчивой, если после наложения какого либо возмущения, она возвращается в прежнее состояние после снятия этого возмущения.
Неустойчивая сисьема имеет место в тех точках пересечения, где Uтеплоотвда< Uтепловыделения.
Эндотермическая реакция.
А превращается в R — Q




альфа > 90.
44-45 вопрос
Производство серной кислоты.
Способы получения серной кислоты.
Серная кислота называется : моногитрат. Это тяжёлая маслянистая жидкость. Смешивается с водой в любых соотношения с выделением тепла. Растворы SO3 в моногидрате, называются олеумом. Раствор моногидрата содержит пиросерную кислоту H2S2O7. Температура плавления безводной серной кислоты tпл = - 10,37 грю цельс. Температура кимения безводной серной кислоты tкип = 296 гр . Цельс.
H2SO4 при высоких температурах обратимо превращается в H2O + SO3.
t>400 гр. Цельс. 2SO3 обратимо превращается в 2SO2 + O2.
Серная кислота — довольно сильный окислитель, особенно при нагревании. Она растворяет оксиды металлов и большинство чистых металлов. Она вытесняет при повышенной температуре все другие кислоты из их солей. Ростительные материалы содержащие целлюлозу, крахмал и сахар, разрушаются в концентрирвоанной серной кислоте. При попадании на кожу человека, концентрированная кислота вызывает ожоги. Крупнейшим потребителем серной кислоты является производство минеральных удобрений — порядка 40% получаемой серной кислоты расходуется на производство удобрений (особенно производство суперфосфата и (NH4)2SO4. Такие кислоты, как фосфорная, уксусная, соляная, получают при действии серной кслоты. Серную кислоту применяют в производстве цветных и редких металлов; в металлообработке при травлении изделий; используют в производстве лаков, лекарственных препаратов; при помощи серной кислоты производятся различные спирты, пластмассы, моющие средства, ядохимикаты. Она применяетс я в текстильной, кожевенной промышленности, при произвдостве взрывчатых веществ; используется в свинцовых аккумуляторах; а так же для осушки газов.
В настоящее время серная кислота производится в основном контактным способом, и в небольших масштабах нитрозным или башенным способом.
Первой стадией сернокислотного производства по любому способу является получение диоксида серы, при окислении сернистого сырья. После очистки диоксида серы, его окисляют до триоксида, который соединяется с водой образуя серную кислоту.
Физико — химические основы производства серной кислоты.
Сырьём для производства может служить любое вещество содержащее серу. Во первых это природные материалы:
Элементная самородная сера.
Сульфиды металлов, на пример FeS2 – пирит; FeCuS2 — медный колчедан; Cu2S — медный блеск; ZnS — цинковая обманка; PbS, CoS, NiS.
Сульфаты, на пример CaSO4*2H2O — гипс; CaSO4 — ангидрит; Na2SO4, MgSO4.
Производственные отходы. Более 40% серной кислоты получают из серного колчадана, свыше 25% из отходящих газов цветной металлургии; порядка 20% из самородной серы.
Рассмотрим производство SO2 из серного колчадана путём обжига. Главной составной частьтю колчадана является FeS2, а остальное примеси — соли других металлов и мышьяка. Содержание серы в колчадане колеблется в диапозоне от 30 до 52 процентов. 52% имеет пирит. Обжиг колчедана в воздушном потоке проводится в печах различной конструкции при атмосферном давлении. Суммарное уравнение реакции обжига
4
 FeS2
+ 11O2 2Fe2O3 + 8SO2 + 3400кДж.
FeS2
+ 11O2 2Fe2O3 + 8SO2 + 3400кДж.
Фактически процесс состоит из нескольких стадий.
2 FeS2 (t>500 гр. Цельс) S(пар) + О2(газ) = SO2
4FeS + 7O2 = 2Fe2O3 + 4SO2.
Для обжига колчедана применяют печи трёх типов.
Тип печи |
tобжига, гр. Цельс |
% SO3 в газе |
Содержание S в огарке, % |
1 Механические полочные |
850 — 900 |
9 |
До 2 |
2 Печи пылевидного обжига |
1100 |
13 |
1 — 1,5 |
3 Печи со взвешенным слоем |
800 |
15 |
До 0,5 |
Недостатки печей.
Механические полочные печи сложны в устройстве; мало интенсивны, дороги в эксплуатации; не обеспечивают достаточного выжигания серы из колчедана; не дают высокой концентрации SO2 в газе.
Печи пылевидного обжига, в них необходимо применять сухой флотационный колчедан; запылённость газа до 100 гр/ м^3.
В печах кипящего слоя (печи со взвешенным слоем), нельзя сжигать материал сильно различающийся по размеру частиц; запылённость ещё больше, чем в печах пылевидного обжига.
Вторая стадия — это очистка обжигового газа. Газ очищается от пыли, соединений мышьяка, фтора, паров воды. Грубая очистка от пыли производится в циклонах и инерционных уловителях пыли. Более полная очистка до содержания в нём пыли 0,1 г/м^3 производится в электрофильтрах. Тонкая очистка газа производится при промывке его разбавленной серной кислотой в промывных башнях или в башнях с насадкой.
Третья стадия — контактное окисления SO2 до SO3.
Реакция контактного окисления является обратимой, экзотермической.
2SO2 + O2 = 2SO3 + 2*93,7 кДж. Равновесие смещается вправо при понижении температуры и повышении давления.








В качестве катализатора можно использовать Fe2O3, платину, пятиоксид ванадия и активатором из К2О и алюмосиликатом.
S O3 + H2O H2SO4 + 9200 кДж, проводят в башнях с насадкой, можно применять барботажные или пенные абсорберы. Абсорбцию производят концентрированными кислотами. SO3 с водой образует мельчайшие капельки сернокислотного тумана, которые очень тяжело улавливаются. Наибольшей по абсорбционной способности является килсота содержащая 98,3 H2SO4. Кислоту поступающую на абсорбцию предварительно охлаждают.
Нитрозный способ получения серной кислоты.
Газ полученный при сжигании сернистого сырья, содержащий 9 % SO2 и 9% - 10% О2, очищается от частиц колчеданного огарка, и поступает в башенную систему, которая состоит из 4-х — 7-ми башен с насадкой. Температура газа на входе = 350 гр. Цельса. В первых двух — трёх башнях, насадка оршается нитрозой, тоесть нитрозилсерной кислотой. Кислота нейтрализуется по уравнению
2NOHSO4 + H2O = 2H2SO4 + N2O3.
SO2 + H2O = H2SO3.
Сернистая кислота реагирует с оксидами азота в жидкой фазе.
H2SO3 + N2O3 = H2SO4 + 2NO.
SO2 + N2O3 = SO3 + 2NO
SO3 + H2O = H2SO4.
Монооксид азота в газовой фазе поглащается
2NO + )2 = 2NO2
NO2 + NO = N2O3.
N2O3 + H2SO4 = 2NOHSO4 + Н2О.
