
- •4.3. Метод пептизации.
- •Устойчивость и коагуляции коллоидных систем.
- •5.1 Кинетическая и агрегативная устойчивость.
- •5.2. Коагуляция
- •6.Оптические свойства в коллоидных растворах.
- •6.1 Рассеяние света.
- •Опалесценция.
- •6.2 Оптические методы исследования коллоидных систем.
- •Лекция №7. Молекулярно-кинетические свойства коллоидных растворов.
- •7.1 Броуновское движение.
- •7.2. Диффузия в коллоидных системах.
- •7.3 Седиментация.
- •7.4. Осмос. Осмотическое давление.
- •8. Грубодисперсные системы. Эмульсия.
- •8.1. Классификация и агрегативная устойчивость эмульсии.
- •9. Высокомолекулярные вещества и методы их получения.
- •10. Строение и свойства полимеров.
- •10.1 Форма и строение макромолекул полимера.
- •10.2. Три физических состояния линейных полимеров.
- •10.3. Кристаллическое состояние полимеров.
Коллоидные системы и предмет коллоидной химии
Коллоидная химия первоначально была лишь главой физической химии. Со временем она стала самостоятельной наукой.
Особенности коллоидных растворов:
Все коллоидные растворы способны рассеивать свет
Диффузия в коллоидных растворах протекает весьма медленно
Осмос. Коллоидные растворы имеют очень малое осмотическое давление, которое трудно определить, Pосм=CRT , Pосм= (m/M*V)*RT
При постоянстве m масса дисперсной частицы М велика, отсюда и осмотич. Давление низкое.
Коллоидные растворы способны диализу, т.е. с помощью полупроницаемой мембраны могут быть отделены от растворенных в них примесей низкомолекулярных в-в.
Способность к диализу указывает, что размер содержащих в коллоидных р-рах частиц значительно больше размера молекул в истинных р-рах, а также уазывает на то, что коллоидные частицы имеют определенный заряд.
В отличии от истинных р-ров, являющихся стабильными системами, коллоидные р-ры агрегативно неустойчивы.
Коллоидные системы могут быть газообразны ( пыль, туман), жидкими (Эмульсия, суспензия) и твердые (пенза, хлеб, пенобетон).
Коллоидные растворы-это состояние в-ва, которое характеризуется как высокодисперсное ( высокораздробленное) состояние, в котором отдельные частицы являются н молекулами, а агрегатами, состоящими из множества молекул, а также молекул среды, в которой диспергированы коллоидные частицы, и образуют другую фазу.
Коллоидный раствор является гетерогенной, многофазной ( в простейшем случае двухфазной) системы в отличии от истинных растворов, которые являются гомогенными. Всякий коллоидный раствор представляет гетерогенную систему, условием ее образования является нерастворимость ( очень малая растворимость) в-ва одной фазы в в-ве другой фазы.
Совокупность измельченных частиц образует дисперсную фазу, а окружающее их в-во наз. Дисперсионной средой.
Коллоидная химия – наука о свойствах гетерогенных высокодисперсных систем и о протекающих в них процессах.
Дисперсные системы и их классификация.
Дисперсные системы состоят из раздробленных частиц того или иного в-ва (точнее, среды), в котором распределена дисперсная фаза, называемая дисперсионной средой.
D=1/a , где а-размер частицы, D- степень дисперсности.
Количественной характеристикой дисперсности является степень дисперсности (D) – величина, обратная размеру а дисперсных частиц, где а-поперечный размер частицы. Для сферических и волокнистых частиц а равно диаметру, для кубических-длине ребра куба.
Чем больше степень дисперсности, тем меньше размер частиц, и наоборот.
Дисперсные системы классифицируют:
По дисперсности
По агрегатному состоянию дисперсной фазы
По взаимодействию дисперсной фазы с дисперсионной средой
По
дисперсности, т.е. по величине частиц
дисперсности, можно разделить на
следующие виды: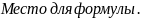
Грубодисперсные а>
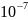 м
(
м
(
 см) – суспензии ( взвесь глины в воде,
крахмал в воде), эмульсии ( масло в воде,
молоко, майонез), пены ( мыльная пена,
пенза, пенопласт). Эти системы являются
термодинамическими и кинетически
неустойчивыми и под действием силы
тяжести расслаиваются на 2 фазы: на
дисперсную фазу и дисперсионную среду.
Частицы дисперсной фазы видимы в обычный
микроскоп и даже невооруженным глазом.
Они могут задерживаться обычным бумажным
фильтром.
см) – суспензии ( взвесь глины в воде,
крахмал в воде), эмульсии ( масло в воде,
молоко, майонез), пены ( мыльная пена,
пенза, пенопласт). Эти системы являются
термодинамическими и кинетически
неустойчивыми и под действием силы
тяжести расслаиваются на 2 фазы: на
дисперсную фазу и дисперсионную среду.
Частицы дисперсной фазы видимы в обычный
микроскоп и даже невооруженным глазом.
Они могут задерживаться обычным бумажным
фильтром.Коллоидные системы (коллоидные растворы(золи)) Размеры: –
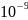 м (
–
см). Частицы находятся в непрерывном
движении, что обуславливает их
кинетическую устойчивость. Такие
частицы длительное время не оседают
под действием силы тяжести; проходят
через бумажный фильтр, но задерживаются
порами ультрафильтра. Невидимы в обычный
микроскоп, но наблюдаются в ультрамикроскопе
и электромикроскопе.
м (
–
см). Частицы находятся в непрерывном
движении, что обуславливает их
кинетическую устойчивость. Такие
частицы длительное время не оседают
под действием силы тяжести; проходят
через бумажный фильтр, но задерживаются
порами ультрафильтра. Невидимы в обычный
микроскоп, но наблюдаются в ультрамикроскопе
и электромикроскопе.Молекулярные и ионные ( истинные) растворы. а< м ( см ). Частицы представляют собой молекулы и ионы. Истинные растворы термодинамически и кинетически устойчивы.
Отличаются коллоидные растворы от истинных тем, что они гетерогенные. Истинные растворы гомогенные, т.е. частицы растворимого в-ва (молекулы, ионы) не образуют отдельную фазу. Дисперсные системы классифицируются по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Классификация Оствальда:
-
Дисперсионная среда
Дисперсная фаза
Газ
Жидкость
Твердое тело
газ
- (дисперсная система невозможна)
Аэрозоль (туман, облака)
Аэрозоль (дым, пыль)
Жидкость
Жидкие пены(взбитые сливки, мыльная пена)
Эмульсии (сливочное масло, мази, кремы)
Суспензии, коллоидные растворы(золи) (краски)
Твердые тела
Твердые пены (пенза, пенобетон, сибит)
Хлеб, твердоэмульсии (жемчуг)
Сплавы, поликристаллы
Существует классификация коллоидных систем по взаимодействию дисперсной фазы и дисперсионной среды. Различают лиофобные и лиофильные коллоидные системы. Лиофильными принято называть системы, частицы которых взаимодействуют с молекулами дисперсионнной среды, образуют сольватные оболочки.
В лиофобных коллоидных системах частицы дисперсной фазы слабо взаимодействуют с молекулами дисперсионной среды. Эта классификация пригодная только для систем с жидкой дисперсионной средой.
Поверхностные явления.
В системах с очень развитой поверхностью раздела фаз большое значение имеют поверхностные явления.
Поверхностный слой коллоидной частицы отличается от частиц внутри слоя. Каждая частица ( молекула) притягивает к себе окружающие молекулы и одновременно с такой же силой притягивается равномерно во все стороны окружающими ее молекулами. Силовое поле каждой молекулы внутри частицы симметрично насыщенно. Равнодействующая сил притяжения равна 0.
В поверхностном слое на частицу действуют силы, находящиеся в нижней полусфере.
Действие
молекулы газа, находящейся на поверхности
коллоидной частицы, можно пренебречь,
т.к. их концентрация несравнимо меньше,
чем в частице. Равнодействующая
молекулярных сила направлена вовнутрь
частицы. Таким образом поверхностные
молекулы в частице находятся действием
силы, стремящейся втянуть их, образуя
поверхностное натяжение. В результате
чего возникает свободная поверхностная
энергия Гиббса ∆ s.
Величина свободной энергии любой
поверхности определяется поверхностным
натяжением σ
и суммарной величиной поверхности
раздела фаз ∆S.
s.
Величина свободной энергии любой
поверхности определяется поверхностным
натяжением σ
и суммарной величиной поверхности
раздела фаз ∆S.
∆
s=σ*∆S,
где ∆
s
– свободная поверхностная энергия, σ
– поверхностное натяжение [эрг/ ]
[ Дж/
]
[ Дж/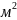 ],
∆S
– площадь
],
∆S
– площадь
В системах, обладающих избытком свободной энергии ∆ s, могут самопроизвольно протекать процессы, понижающие запасы этой энергии ( ∆ s<0)
Уменьшение поверхностной энергии возможно, благодаря:
Уменьшению поверхностного натяжения σ.
Для изменения ∆ s необходимо провести работу А=σ*∆S, .т.е. σ=А/∆S
σ-величина поверхностного натяжения, численно равная работе, которую необх. Совершить молекулярными силами, при изменении свободной площади поверхности жидкости на единицу раздела фаз ∆S. Поверхностное натяжение можно уменьшить за счет притяжения поверхности молекул, атомов или ионов из окружающей среды, т.е. за счет адсорбции.
Уменьшениювеличины поверхности ∆S
Уменьшение суммарной поверхностидля коллоид. Частиц прявляется в самоукрупнении частиц – коагуляции.
Адсорбция.
Поглощение поверностью жидкости или твердого тела молекул, атомов или ионов окружающей среды называется адсорбцией. Адсорбция может быть обусловлена наличием свободных сил на пов-ти частиц. Вещество, способное поглощать ( адсорбировать другое вещество на своей пов-ти) наз. адсорбентом. Адсорбируемое вещество наз. адсорбтивом.
На поверхности растворов адсорбируются молекулы, растворимые в жидкости, как правило, вещества содержат: гидрофобную группировку и гидрофильную группировку.
Молекулы, обладающие одновременно обоими видами группировок, называются дифильными.
На поверхности раздела фаз молекулы определенно ориентируются, причем их полярная часть обращена к более полярной, а неполярная – к менее полярной.
Вещества, понижающие поверхностное натяжение и адсорбирующиеся на данной поверхности, наз. поверхностно-активными веществами (ПАВ). К ним относятся: жирные кислоты, мыла спирты. Вещества, вызывающие повышение поверхностного натяжения и не сорбирующиеся на данной поверхности, называются поверхностно-неактивными. В случае воды к ним принадлежат неорганические соли, кислоты, кислот. орг. вещества.
В качестве адсорбентов выступают разнообразные материалы с высокой удельной поверхностью – аткивированные угли, циалиты. Причиной адсорбции является не специфические ваидервальсевые силы: ориентационные, индукционные, дисперсионные. Такую адсорбцию часто называют физической адсорбцией. Адсорбция, осложненная химическим взаимодействием между адсорбентом и адсорбтивом наз. химадсорбцией или химической адсорбцией.
При любой адсорбции происходит умеьшение энергии системы, т.е. выделяется теплота (∆Hадс<0) – экзотермический процесс.
Процесс химадсорбции характеризуется величинами:
- ∆Hа.х.≈25-450 кДж/моль
- ∆Hа.ф.≈10-25 кДж/моль
Адсорбция зависит не только от сорбента, но и от природы поглощаемого вещества (адсорбтив).
Если в растворе несколько веществ, то они будут адсорбироваться адсорбентом в соответствии с их адсорбционной способностью. Если адсорбция какого-либо вещества значительно превосходит адсорбцию других веществ, то говорят о его избирательности ( силлитивности) сорбции данным сорбентом.
Правило Ребнидера:
Предложил правило выравнивания полярности, согласно которому на полярных адсорбентах лучше всего адсорбируются полярные адсорбтивы (вещества):
Не на полярных адсорбентах неполярные вещества из полярных растворителей.
Количество вещества, выраженное в молях, и поглощенное 1 поверхности, называется удельной адсорбцией
r= , [моль/
]
, [моль/
]
х-число молей адсорбируемого вещества
S-поверхность адсорбента
r-удельная адсорбция
Из-за трудности определения поверхности твердого адсорбента величину удельной адсорбции рассчитывают на 1 г адсорбента и выражается в [ моль/г].
r= [моль/г]
[моль/г]
m-количество г. Адсорбента.
Адсорбция вещества зависит от концентрации его содержания в растворе.
Коллоидные растворы(золи), их состав и структура.
Коллоидный раствор ( золь) образован мицелами и интермицелярной жидкостью, мицела явл. сруктурной коллоидной единицей золи.
ПО характеристике перемещения коллоид. в электрич. поле удлось доказать, что частицы золи обладают одноименным электрическим зарядом.
Наличие одноименного заряда препятствует слипанию, укрупнению частиц и выпадению их в осадок. Это свойство системы противодействовать укрупнению частиц называется агрегативной устойчивостью. Было установлено, что кристаллы нерастворившейся в воде соли адсорбируют из окруж. Раствора ионы, входящие в состав нерастворившегося в воде соединения.
Правило Пескова-Фанса:
На всякой твердой поверхности адсорируются ионы, которые входят в состав агрегатов и в растворе находятся в избытке.
KIизб+Ag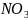 = AgI(осадок)+
= AgI(осадок)+
Молекулы иодистого серебра образуют агрегат коллоидной частицы. Агрегат представляет собой совокупность нейтральных молекул(или атомов). Вещество агрегата должно быть нерастворимо в дисперионной среде ( в воде).
Достройка
кристаллов AgI
ионами йона I
(или ионами
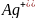 )
происходит потому, что ионы идентичны
по размерам и свойствам с ионами,
имеющимися в кристалле.
)
происходит потому, что ионы идентичны
по размерам и свойствам с ионами,
имеющимися в кристалле.
Ионы, адсорбирующиеся на поверхности агрегата, называются потенциально определяющими ионами, т.е. ионами, определяющими заряд
[(mAgI)n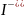 x
x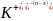 (n-x)
(n-x)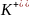
Агрегат вместе с адсорбционными на нем ПОИ, составляет ядро мицелы.
В непосредственной близости от ядра находится часть противоионов, которые образуют адсорбционный слой. Противоионы в адсорбционном слое прочно связаны электроостатическими и адсорбционными силами.
Ядро вместе с частью противосвязанных с или противоионами называется коллоидной частицей или кгранулой. Указанная частица имеет заряд, знак которого определяется зарядом ПОИ. Заряд коллоидной частицы равен алгебраической разности зарядов ПОИ и противоионов в адсорбционном слое.
Остальные противоионы, находящиеся в перефирийной части, образуют диффузный слой мицелы. Дифузный слой подвижен и способен перемещаться относительно коллоидной частицы (гранулы).
Колоидные частицы в сочетании с противоионами диффузного слоя оразуют мицелу. Диффузный слой подвижен и способен перемещаться относительно коллоидной частицы(гранулы).
Т.о. мицела-лектрически нейтральная коллоидная единица. При пропускании постоянного тока через коллоидный раствор к электродам движется не мицела, которая электронейтральна, а коллоидная частица (гранула.
Строение мицелы в случае золи йодистого серебра.
[(mAgI)n
x (n-x)
(n-x)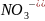
Числа m,n,x-в зависимости от приготовления золи могут изменяться в широких пределах, но не всегда n>x.
Условия существования и стабилизации коллоидных систем.
Стабильность (агрегативная устойчивость коллоидных частиц объясняется тем, что на поверхности агрегата адсорбируются потенциал-определяющие ионы. Те электролиты, ионы которого являются ПОИ, следует считать стабилизаторами, а ионы, которые сорбируются на поверхности (т.е. ПОИ) – стабилизирующие ионы.
В результаты все ультрамикрокристаллы агрегата приобретают одноименный заряд, что препятствует их соединению и укрупнению. Стабилизаторами могут быть как реагенты, из которых получился золь, так и посторонние ионы, молекулы, примеси, которые могут сорбироватсья на поверхности частиц и придавать им устойчивость.
Схема построения мицелл:
Частица золя, схему которой строят след. Образом:
Составляем уравнение реакции, подчеркиваем малорастворимое вещество, которое образует агрегат мицелы.
Mn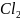 +Na
+Na =Mn
(осадок)
+ 2NaCl
=Mn
(осадок)
+ 2NaCl
Пишут уравнение диссоциации вещества, взятую в избытке, т.к. это вещество содержит потенциал-определяющие ионы(ПОИ) и противоионы, которые сорбируются на ядре.
Mn
= +
+
Устанавливаем потенциал-определяющие ионы, используя правило Пескова-Фаянса-на всякой поверхности агрегата в 1-ую очередь сорбируются ионы, которые входят в состав агрегата, и находятся в избытке.
[(mMn
)n
x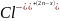 (2n-x)
(2n-x)
Т.к. гранула полученного золя имеет положительный заряд, то в электрическом поле она перемещается к катоду.
Методы получения коллоидных систем.
Коллоидные растворы могут быть получены в результате диспергирования (дробления) сравнительно больших частиц либо путем соединения отдельных молекул или ионов растворенного вещества в крупные агрегаты. Особо от этих методов стоит метод пептизации. Для получения коллоидных растворов необходимым условием является:
Нерастворимость веществ в дисперсионной среде
Наличие в системе стабилизаторов
Такими веществами могут быть как чужеродные вещества, так и соединения, участвующие в образовании коллоидных частиц.
4.1. Метод диспергирования.
1) Механическое измельчение.
Способ заключается в энергичном продолжительном размалывании вещества дисперсной фазы и смешивание его с жидкостью – дисперсионной средой.
Дробят крупные частицы с помощью шаровых мельниц, вальцами, и т.д.
2) Электрическое диспергирование
Два электрода из металла, золь которого хотят получить, погружают в жидкость.
Затем эектроды сближают и пропускают ток I=5-10 A и напряжение U=100В, образуется дуга, в сфере дуги происходит расплавление и отрыв частиц металла от электрода, которые поступают в среду и образуют золь. Т.о. получают золь золота, платины, серебра.
Диспергирование ультразвуком.
Диспергирование при помощи ультразвуковых колебаний, т.е. колебания частотой выше 20000 в.с., неуловимых человеческим ухом, является эффективным лишь для веществ с малой прочностью: смолы, сера, графит, крахмал, каучук.
Ультразвуковые колебания обычно получают с помощью пьезоэлектрических асцилляторов, принцип действий которых заключается в превращении электрических колебаний в механические. Под влиянием звуковых волн система подвергается быстросменяющимися сжатию и расширению, что сопровождается появлением рзрыхляющихся сил.
Методы конденсации.
Кондеционные методы включают:
Метод прямой конденсации
Метод замены растворителя
Метод химической конденсации
Метод прямой конденсации: образование коллоидных систем при переходе из пара в жидкость.
Напр.: пропуская пары ртути через слой воды получается высокодисперсная жмульсия ртути в воде. Таким образом получают золи серы, и т.д.
Метод замены растворителя: Вещество, из которого хотят получить золь, растворяют в соответствующем растворителе в присутствии стабилизатора, а затем смешивают с другой жидкостью, в котором вещество нерастворимо. В результате чего вещество выделяется из раствора в виду присутствия стабилизатора не в виде осадка, а образует золь.
Истинный раствор NaCl в абс. спирте. Добавление эфира образует соль NaCl.
Эфирные масла духов образуют истинные растворы со спиртами. Добавив воды образует золь эфирных масел, которые нерастворимы в воде. При этом спирт и вода смешиваются в любых соотношениях.
Метод химических конденсаций:
Сводится к образованию молекул нерастворимого вещества в результате хим. реакции с последующей конденсацией их до разсмера коллоидных частиц. Золи образуются лишь при определенных концентрациях исходных веществ, проядке их смещения и температуре. Коллоидные системы можно получать с помощью химических растворов всех известных тинов.
4.3. Метод пептизации.
Пептизацией называют переход в коллоидый раствор осадков, образовавшихся при коагуляции. Пептизация может происходить:
В результате промывки осадка от коалугянта и дальнейшем встряхивании осадка.
Под действием специальных веществ-пептидов.
В первом случае из осадка удаляют коагулирующие ионы. Во втором случае пептизатор адсорбируется, что ведет к образованию сальватных оболочек вокруг коллоидных частиц и преодоению сил суспензии между частицами.
На пептизацию веществ влияет механическое воздействие. При орошем перемешивании ускоряется проникновение пептизатора вовнутрь гранулы. Скорость пептизации увеличивается с повышением температуры.
Устойчивость и коагуляции коллоидных систем.
5.1 Кинетическая и агрегативная устойчивость.
Проблема устойчивости коллоидных систем является центральной проблемой коллоидной химии, а коагуляция составляет важный механизм перехода к более устойчивому состоянию для всех типичных систем.
Существуют 2 рода процессов приводящих к разрушению коллоидных систем:
Процессы обусловлены тем, что частицы дисперсной фазы могут выделяться путем оседания.
Принцип коагуляции – заключается в укрупнении частиц дисперсной фазы в результате их взаиного слипания или слияния.
В связи с этим были введены понятия о химической и об агрегативной устойчивости коллоидных систем.
Кинетическая устойчивость состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы и не изменяется во времени. Влению седиментации ( осаждению) противодействует тепловое движение частиц дисперсной фазы – Броуновское движение.
Агрегативная устойчивость выражает собой способность коллоидных систем сохранить свою степень дисперсности (т.е. размер). Сохранение степени дисперсности обусловлено наличием одноименного электрического заряда коллоидных частиц, вызывающее их взаимное отталкивание.
Агрегативная устойчивость обусловлена наличием у коллоидных частиц дисперсной фазы сольватной ( в случае воды-гидратной) оболочки.
Гидратная (сольватная) оболочка заметно снижает поверхностную энергию дисперсной фазы, тем самым уменьшая стремление частиц к укрупнению.
Гидратная (сольватная) оболочка также приводит к разобщению частиц в коллоидном растворе.
Стабилизация дисперсных систем усиливается при добавлении ПАВ и высокомолекулярных соединений.
5.2. Коагуляция
Устойчивость золи можно нарушить устранив одноименный заряд и защитную гидратную (сольватную) оболочку. Наиболее важное теоретическое и практическое значение имеет коагуляции при добавлении электролита.
[m(AgI)n
x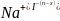 +(n-x)
+(n-x) *z(
*z(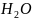 )+
)+ +3
=[m(AgI)n
n
+3
=[m(AgI)n
n +3
*z(
)
+3
*z(
)
Введенный в коллоидный раствор электролит дегредатирует ионы диффузного слоя ((n-x) n *z( )), способствуя переходу их в адсорбционный слой. Это вызывает уменьшение заряда коллоидных частиц, силл отталкивания, все это способствует слипанию и укрупнению частиц.
Коагулирующей частью электролита является один из его ионов-тот, который несет противоположный по знаку заряд коллоидной частицы. Т.о. для золи отрицательно заряженных частиц коагулирующим ионов являются катионы ,а для золи с положительными частицами-анионы. При добавлении малой концентрации электролита начальная стадия процесса коагуляции протекает незаметно для невооруженного глаза, и называется потому скрытой(неявной) коагуляцией.
Для начала явной ( заметной) коагуляции необходимо, чтобы концентрация электролита превысила некоторую минимальную величину, называемую порогом коагуляции 𝛾 [моль/литр]
Коагулирующая способность электролита (иона) неодинакова и может быть определена, как величина, обратная порогу коагуляци
К.С.=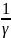
В настоящее время общепризнанной является теория коагуляции электролита, теория ДЛФО-Б.В. Дерянин, Л.Д. Лондау, Феервей, Овербек.
Физическая
теория коагуляции электролитами строится
на рассмотрении баланса минимолекулярных
сил притяжения и сил ионноэлектростатического
отталкивания. Отсюда, общая энергия
взаимодействия складывается из энергии
приземления и энергии отталкивания
U=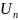 -
-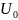
-потенциальная энергия дисперсного взаимодействиям
– потенциальная энергия дисперсного отталкивания
Если > – коллоидные частицы, сталкивающиеся при броуновском движении, слипаются.
Если < – коллоидные частицы отталкиваются, дисперсная система устойчива.
Из теории ДЛФО было получено соотношение порога коагуляции и заряда коагулируемого иона – порог коагуляции обратнопропорционален степени заряда коагулирующего иона.
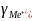 +
+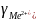 +
+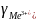 =1:
=1: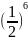 :
: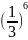
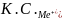 :
: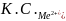 :
: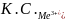 =1:64:729
=1:64:729
Этот ряд согласуется с опытными данными, получившими свое выражение в правиле Шульца-Гарди:
Чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность и тем ниже порог коагуляции.
На практике было получено для некоторых металлов: 1:20:350
Зависимость получается другой, однако основная закономерность и порядок величин, характеризующих коагуляцию сохраняется.
Коагулирующая спсобность ионов одного и того же заряда зависит и от природы иона.
При коагуляции отрицательно заряженных золей однозарядные ионы образуют последовательный ряд в порядке уменьшения их коагулирующей способрости:
 ;Rb;K;Na
;Rb;K;Na
При коагуляции положительных золей, одновалентные ионы образуют следующий ряд:
Cl; Br; ; I
Такие ряды называются лиотропными.
Взаимная коагуляция.
Коогулирующего золя можно наблюдать, если к одному золю прибавить другой золь с противоположным зарядом. В этом случае каждый золь по отношению к другому выполняет роль коагулятора. При взаимной коагуляции в осадок выпадает частица обоих золей. Взаимная коагуляция используется как метод определения знака заряда золи.
Напр.:глина, фильтровальная бумага, проявляет себя как отрицательно заряженным сорбентом. Нанеся каплю исследоваемого золя на фильтровальную бумагу, можно определить заряд золя. Когда капля положительно заряженного золя коагулирует с бумагой, образуется в центре окрашенное петно и бесцветный ореол воды.
Отрицательно заряженные золи дают равномерно окрашенное тело.
