
- •1.Тепловое движение молекул.Молекулярное взаимодействие.Агрегатные состояния в-ва.Идеальный газ.
- •3.Температура и внутренняя энергия.
- •7.Идеальный газ во внешнем поле(?).Барометрическая формула.Распределение Больцмана.
- •8.Распределение Максвела.
- •5.Теплоемкость идеальных газов.Отношение Cр/Сv.(в конце ф-ла Майера.?)
- •6.Адиабатический процесс.Уравнение адеабаты.Работа при адеабатическом процессеЯ(?).
- •9.Реальные газы.Изотермы Ван-дер-Вальса(?).Критическое состояие газа(?).
- •10. Первое начало термодинамики.
- •11.Циклические процессы(?).Цикл Карно.Второе начало термодинамики.
- •12.Физический смысл энтропии.Энтропия и Вероятность.
- •13.Явление переноса.Длина свободного пробега.Диффузия.Теплопроводность.Вязкость(про вязкость я написала в жидкости которая).
8.Распределение Максвела.
МА́КСВЕЛЛА РАСПРЕДЕЛЕ́НИЕ, распределение по скоростям частиц (молекул) макроскопической физической системы, находящейся в состоянии термодинамического равновесия, (в отсутствии внешнего поля, при условии, что движение частиц подчиняется законам классической механики)
5.Теплоемкость идеальных газов.Отношение Cр/Сv.(в конце ф-ла Майера.?)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества С
В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества.
При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса.
Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
|
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
pV = RT, |
где R – универсальная газовая постоянная. При p = const
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Cp = CV + R.
|
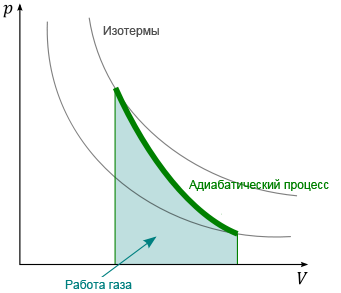
6.Адиабатический процесс.Уравнение адеабаты.Работа при адеабатическом процессеЯ(?).
Адиабатический процесс-процесс,протекающий без теплообмена с внешней средой.
В общем случае адиабатический процесс необратим. Адиабатические процессы обратимы, если их проводить достаточно медленно (квазистатически). В общем случае адиабатический процесс необратим.
Линия, изображающая адиабатный процесс на какой-либо термодинамической диаграмме, называется адиабатой.
 - ΔU
= A
- ΔU
= A
где:
ΔU - изменение внутренней энергии тела,
A - работа, совершаемая системой.
Адиабатический процесс в идеальных газах
pVk = const,
где:
p — давление газа, V — объём газа, k = Cp / Cv — показатель адиабаты, Cp – теплоемкость газа при постоянном давлении
Cv — теплоёмкости газа при постоянном объёме.
Адиабатический
процесс:![]()
Вследствие
первого закона темодинамики: ![]()
Для идеального
газа при адеабатическом процессе
давление и объем связаны уравнением
Пуассона:
![]()
где:
— давление газа,
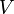 —
его объём,
—
его объём,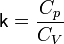 — показатель
адиабаты,
— показатель
адиабаты,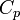 и
и 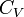 — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
