
Доброкачественность
NaHCO3: 1) допускаются: Cl–, K+, Ca2+, Fe, As.
2) недопускаются: соли NH4+ и тяжелые металлы.
Количественное определение
Ацидиметрия, прямое титрование, навеску растворяют в свежепрокипяченной и охлажденной воде для удаления CO2, титруют 0,5 н HCl, индикатор метиловый оранжевый. Э = М.
NaHCO3 + HC1 --- NaC1 + CO2 + H2O Э=М
Применение. Хранение.
Хранят в хорошо укупоренной таре. Вещество устойчиво в сухом воздухе, но во влажном медленно теряет CO2 и образует Na2CO3.
Применяют как антацидное средство внутрь, а также наружно в виде полосканий, промываний, ингаляций 0,5 – 2 % растворы.
3.
|
Натрия бензоат Natrii benzoas |
Описание. Растворимость. Белый кристаллический порошок без запаха сладковато-соленого вкуса. Легко растворим в воде, трудно растворим в спирте.
ОН |
Салициловая кислота Acidum salicylicum о-оксибензойная кислота |
Описание. Растворимость. Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Мало растворим в холодной воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе. Летуч с водяным паром. Возгоняется при нагревании
Получение
Натрия бензоат. Раствор бензойной кислоты выпаривают досуха и нейтрализуют эквивалентным количеством Na2CO3 или NaHCO3. Полученную соль перекристаллизовывают из спирта.
Салициловая кислота.


 COONa
COONa
ОН + NaOH → ONa + CO2 → OH + HCl →
-H2O
фенол фенолят салицилат салициловая кислота
натрия натрия
Салицилат-ион и бензоат-ион
1) Реакции комплексообразования с солями тяжелых металлов.
· Например, с FeCl3 образуется осадок розовато-желтого основного бензоата железа или сине-фиолетовое окрашивание с салицилат-ионом.
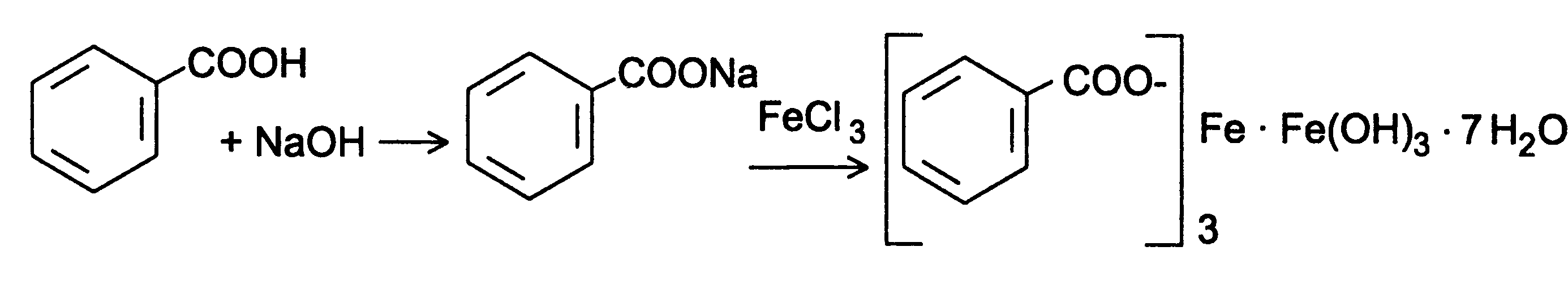
· С раствором CuSO4 бензоат-ион образует бирюзовое окрашивание, а салицилат - зеленое.

 -
-
-
-
2 + CuSO4 → Cu + Na2SO4
_ _ 2
бензоат натрия бирюзовый цвет
После прибавления хлороформа наблюдается голубой хлороформный слой и бесцветный водный.
>Cu + NaHSO4


+ CuSO4 →
салицилат натрия зеленый цвет
После прибавления хлороформа окраска водного слоя сохраняется.
· С раствором AgNO3 образуется белый осадок.
Салицилат-ион (отличается наличием –ОН фенольного)
2) Реакция
бромирования.
При бромировании салицилат-иона идет
процесс декарбоксилирования и образуется
трибромфенол виде белого осадка.
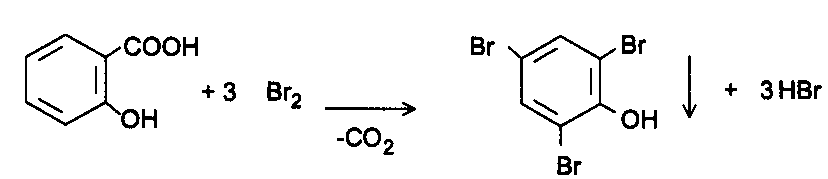
3) Декарбоксилирование проводят так же при сплавлении с CH3COONa или цитратом натрия в присутствии H2SO4к. При этом образуется фенол, который определяют по запаху.
4) Реакция образования азокрасителя.
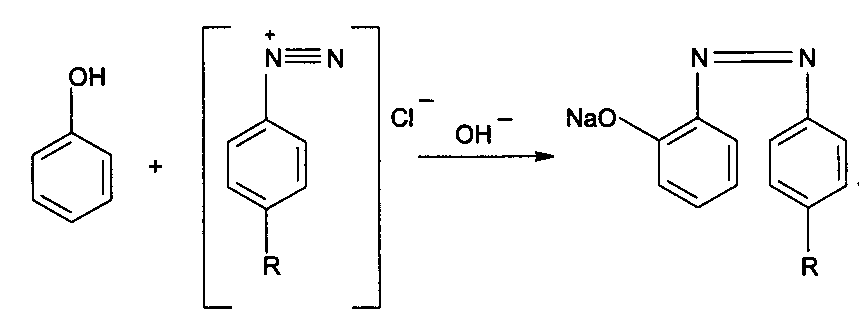 вишнево-красного
цвета
вишнево-красного
цвета
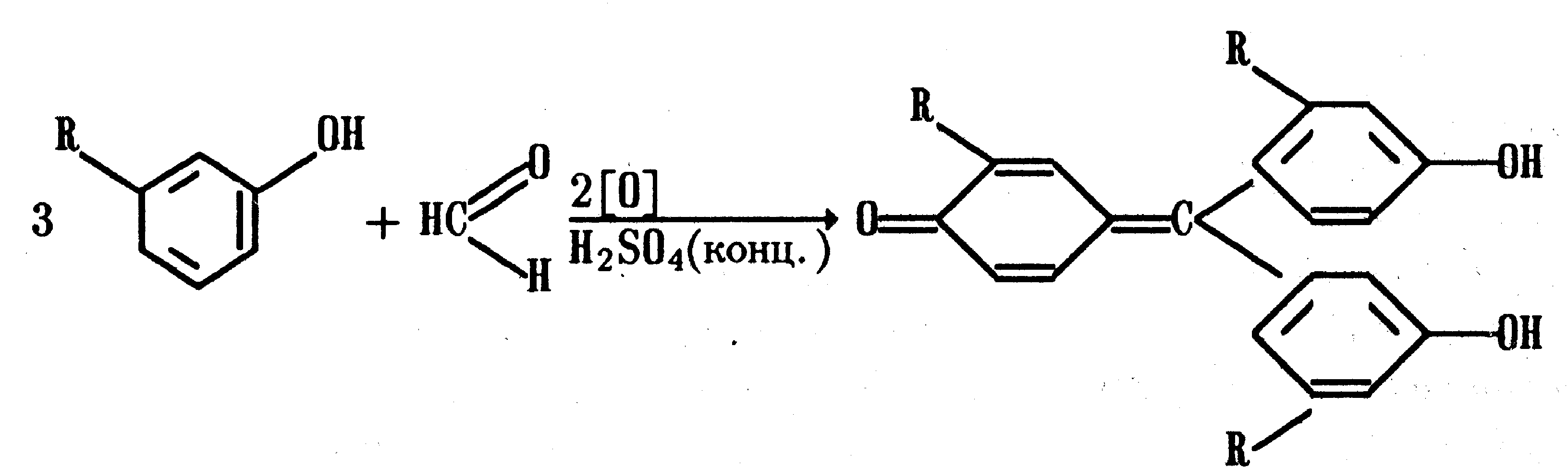
5) Реакция с реактивом Марки.
С формальдегидом в присутствии концентрированной серной кислоты салициловая кислота образует ауриновый краситель красного цвета:
Реакции на ион-натрия
1) Бесцветное пламя горелки окрашивается в желтый цвет.
2) NaC1 + Zn(UO2)3(CHCOO)8 + CH3COOH ---NaZn(UO2)3(CH3COO)9*9H2O (желтый кристал осадок) + НС1
Натрия бензоат. Не допускается:
· кислотность и щелочность; по ф/ф раствор должен быть бесцветным.
Салициловая кислота. 1) Допускаются:
· оксидифенил;
· органические примеси;
2) Не допускается:
· фенол и красящие вещества; открывают добавлением спирта, выпаривают его; остаток должен быть белого цвета.
Количественное определение
По карбоксильной группе.
1) Алкалиметрия для кислот ( салициловая). Вариант нейтрализации, прямое титрование. Метод основан на кислых свойствах бензойной и салициловой кислот. Титруют в среде смешанных растворителей, в частности в присутствии спирта. Его добавляют для растворения кислот и предотвращения гидролиза
натриевой соли. Индикатор – фенолфталеин. Э= М.

+ NaOH → + H2O
бензойная кислота
7
2) Ацидиметрия для солей (натрия бензоат и салицилат). Вариант нейтрализации, прямое титрование. Метод основан на вытеснении слабой кислоты из ее соли сильной минеральной кислотой. Титруют при добавлении эфира, так как при титровании выделяется бензойная кислота и изменяется pH водного раствора до 2,5 – 3,0 и индикатор изменяет окраску до точки эквивалентности. Эфир извлекает образовавшуюся кислоту. Индикатор – метилоранж или смешанный: метилоранж с метиленовой синью. Титруют от зеленой до сиреневой окраски водного слоя. Э= М.

+ HCl → ↓ + NaCl
натрия бензоат
По фенольному –ОН (салициловая кислота).
1) Методы, основанные на электрофильном замещении атомов водорода ароматического кольца на галогены.
Броматометрия. Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде:
KBrO3 + 5 KBr + 6 HCl → 3 Br2 + 6 KCl + 3 H2O
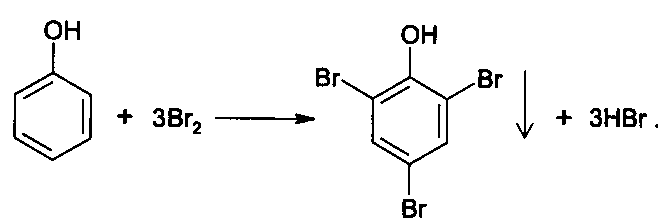 Э=М/6
Э=М/6
Йодометрия.
Йодхлорметрия.
2) Окислительно-восстановительный метод:
· Цериметрия.
Обратное титрование. Метод основан на
окислении фенола - салициловой кислоты
до хинона в кислой среде. Избыток сульфата
церия определяют йодометрически.
Индикатор крахмал.
Цериметрия.
Обратное титрование. Метод основан на
окислении фенола - салициловой кислоты
до хинона в кислой среде. Избыток сульфата
церия определяют йодометрически.
Индикатор крахмал.
+ Cе(SO4)2 + Н2SO4р. →
изб.

+ Cе2(SO4)3 + Na2SO4
салициловая
кислота
2 Cе(SO4)2 + 2 KI → I2 + K2SO4 + Cе2(SO4)3
I2 + 2 Na2S2O3 → Na2S4O6 + 2 NaI

 COONa
COONa СООН
СООН