
Количественный анализ
1. Йодометрия
Метод основан на окислении глюкозы йодом в щелочной среде.
0,1 г (точная навеска) глюкозы растворяют в 5 мл воды, прибавляют 25 мл 0,1 н раствора йода, 10 мл 1 % раствора гидроксида натрия (или 40 мл 0,1 н раствора; или 1 н раствор безводного карбоната натрия) и оставляют на 15 минут. Затем раствор подкисляют 10 мл разведенной серной кислоты и титруют избыток йода 0,1 н раствором тиосульфата натрия (индикатор - крахмал). Параллельно проводят контрольный опыт.
J2 + 2NaOH → NaJO + NaJ + Н2О
R―CОН + NaJO + NaOH → R ― CООNa + NaJ
NaJO + NaJ + H2SO4 → J2 + Na2SO4 + H2O
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Процентное содержание глюкозы вычисляется по формуле:
(Vк.о.. К – Vоп. . К) . T . 100
Х% = ——————————— ,
a
Nт.н. Эглюкозы
Т = —————— ,
1000
2. Поляриметрия
Глюкоза и сахароза содержат асимметрические атомы углерода и потому обладают оптической активностью. Метод основан на свойстве раствора глюкозы вращать плоскость поляризованного луча. По величине угла вращения можно вычислить содержание глюкозы или сахарозы в растворе
3. Рефрактометрия
Метод анализа, основанный на измерении показателя преломления света исследуемым веществом.
БИЛЕТ 7
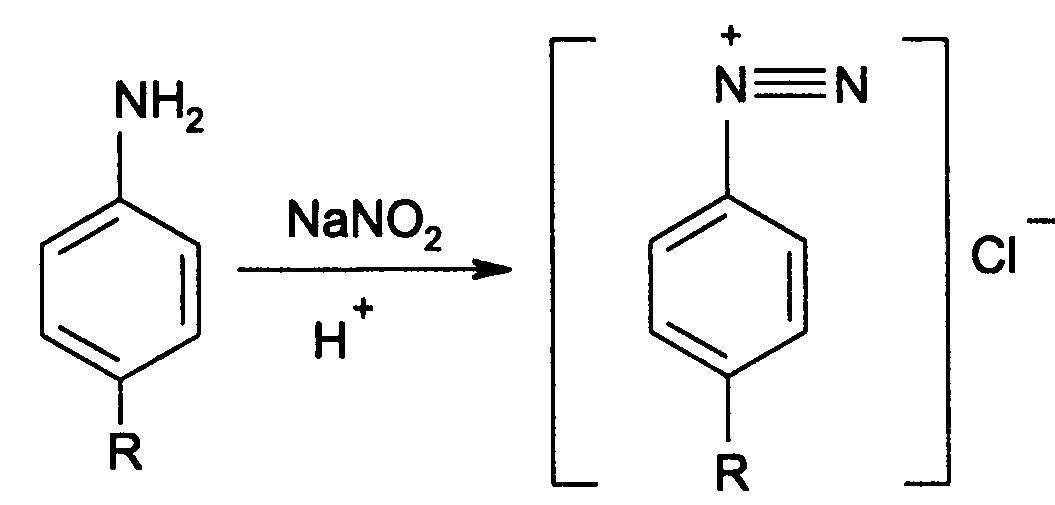
1. Нитритометрия. Метод основан на свойстве веществ, содержащих Ar—NH2 диазотироваться натрия нитритом в кислой среде. Титруют в присутствии калия бромида (катализатора) при пониженной температуре и медленном добавлении титранта:
 Э=М
Э=М
Индикация точки эквивалентности:
- с помощью внутренних индикаторов: тропеолина 00, смешанного индикатора (тропеолин 00 с метиленовым синим), нейтрального красного. Избыток титранта окисляет индикатор и его окраска изменяется;
- с использованием внешнего индикатора – йодкрахмальной бумаги. Это фильтровальная бумага, пропитанная растворами крахмала и калия йодида. В точке эквивалентности при вынесении капли титруемого раствора на бумагу появляется синее пятно от выделившегося йода:
2 NaNO2 + 2 KI + 4 HCl → I2 + 2 NO↑ + 2 KCl + 2 NaCl + 2 H2O
- потенциометрически.
2.
NaHCO3 |
Натрия гидрокабонат Natrii hydrocarbonas |
Описание. Растворимость. Белый кристаллический порошок без запаха, солено-щелочного вкуса, растворим в воде, практически нерастворим в спирте. Водные растворы имеют слабо-щелочную реакцию. При взбалтывании и нагревании до 70о С водных растворов NaHCO3 образуется двойная соль Na2CO3 · NaHCO3 .
Получение
Получают препарат насыщением очищенной кальцинированной соды диоксидом углерода:
Na2CO3 · 10 H2O + CO2 → 2 NaHCO3 + 9 H2O
Далее проводят перекристаллизацию из воды, насыщенной CO2 при 60о С.
Подлинность
Общие реакции на CO32- и HCO3- - ионы:
При действии сильной минеральной кислоты наблюдается бурное выделение CO2:
NaHCO3 + HCl → NaCl + H2O + CO2 ↑
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
диоксид известковая белый
углерода вода
Отличительные реакции:
1) Карбонаты от гидрокарбонатов можно отличить по окраске индикатора – фенолфталеина. При растворении в воде карбоната натрия реакция среды слабощелочная и поэтому окраска индикатора - розовая: Na2CO3 + H2O → NaHCO3 + NaOH
При растворении гидрокарбоната натрия реакция среды кислая, а индикатор бесцветный или слабо-розового цвета: NaHCO3 + H2O → H2CO3 + NaOH
H2CO3 → CO2↑ + H2O
2) С насыщенным раствором сульфата магния карбонаты образуют белый осадок при комнатной температуре, а гидрокарбонаты – только при кипячении:
4 Na2CO3 + 4 MgSO4 + 4 H2O → 3 MgCO3· Mg(OH)2 · 3 H2O↓ + 4 Na2SO4 + CO2↑
белый
to
2 NaHCO3 → Na2CO3 + CO2↑ + H2O
На ион Na: NaC1 + Zn(UO2)3(CHCOO)8 + CH3COOH ---NaZn(UO2)3(CH3COO)9*9H2O (желтый кристал осадок) + НС1
