
БИЛЕТ 5
1. Меркуриметрия
Метод основан на образовании слабодиссоциированных соединений ртути (II). Точку эквивалентности устанавливают потенциометрически или с помощью индикаторов – дифенилкарбазида или дифенилкарбазона, которые образуют с избытком ионов ртути (II) окрашенные в красно-фиолетовый цвет соединения.
При анализе йодидов возможен безиндикаторный метод.
2KI + Hg(NO3)2 → HgI2 ↓ + 2KNO3 (красный осадок)
HgI2 + 2 KI → K2HgI4 (бесцветный)
K2HgI4 + Hg(NO3)2 → 2HgI2↓ + 2KNO3 (красный осадок)
Э= 2М
Титруют до устойчивой красной мути.
2.
MgO2 . MgO
|
Магния перекись Magnesii peroxydum |
Описание. Растворимость. Белый мелкий порошок, без запаха, почти не растворим в воде и спирте. Содержит 25 % перекиси магния. При растворении в минеральных кислотах выделяется H2O2.
Получение
Магния перекись получают при взаимодействии оксида магния и перекиси водорода при температуре 7 – 8 0 С: MgO + H2O2 → MgO2 · MgO + H2O
Промывают спиртом и сушат в вакууме при 45 – 50 0 С.
Подлинность магния пероксида доказывают реакциями на ион магния и на пероксид водорода: MgO2 + HCl → MgCl2 + H2O2
MgCl2 + NaHPO4 + NH4OH + NH4Cl → NH4MgPO4 ↓ + 2NaCl
белый
Доброкачественность
MgO2: допустимы : Cl-, SO42-, Fe, Ca2+, As, тяжелые металлы.
Количественное определение
H2O2: 1) Перманганатометрия. Метод основан на восстанавливающих свойствах водорода пероксида. Содержание H2O2 в препарате 2,7 – 3,3 %.
2) Йодометрия основана на окислительных свойствах водорода пероксида.
MgO2: MgO2·MgO + H2SO4 → MgSO4 + H2O2 , далее определяют водорода пероксид. Должно быть не более 25 % магния пероксида.
Хранение. твердые вещества в сухом месте в хорошо укупоренной таре, при комнатной температуре.
Применени. Магния пероксид применяют как антисептик ЖКТ по 0,25-0,5 г.
3.
║ O O– C–CH3
|
Кислота ацетилсалициловая Acidum acethylsalicylicum салициловый эфир уксусной кислоты |
Описание. Растворимость. Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом слабо-кислого вкуса. Мало растворим в воде, легко растворим в спирте, растворим в эфире и хлороформе. Гидролизуется во влажном воздухе.
П
COOН
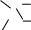
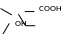 олучение.Ацетилсалициловая
кислота. Получают
ацетилированием салициловой кислоты
в присутствии H2SO4к.:
олучение.Ацетилсалициловая
кислота. Получают
ацетилированием салициловой кислоты
в присутствии H2SO4к.:
O–C–CH3
║
O
+ (СН3СО)2О → + СН3СООН
салициловая уксусный
кислота ангидрид
Качественный анализ
Ацетилсалициловая кислота.
Химические свойства обусловлены сложно-эфирной группой:
1) Гидролитическое разложение. Реакция основана на разложении в присутствии NaOH или кислоты при нагревании. Ацетилсалициловая кислота гидролизуется легко, даже нагревании в воде.
· Щелочной гидролиз:
5
+ 2 NaOH
+ CH3 COONa + H2O
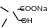
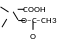
→
Затем при подкислении выпадает белый осадок салициловой кислоты, можно определить его Тпл. и ощущается запах уксусной кислоты.
·
COOH
+ CH3COOH
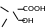 Кислотный
гидролиз:
Кислотный
гидролиз:
║
O
O–C–CH3
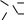 + Н2О
+ [H+]
→ ↓
+ Н2О
+ [H+]
→ ↓
2) Гидроксамовая проба. При взаимодействии сложно-эфирной группы и NH2OH∙HCl в щелочной среде образуются гидроксамовые кислоты, которые после подкисления образуют окрашенные гидроксаматы с солями Fe(III) или Cu(II).
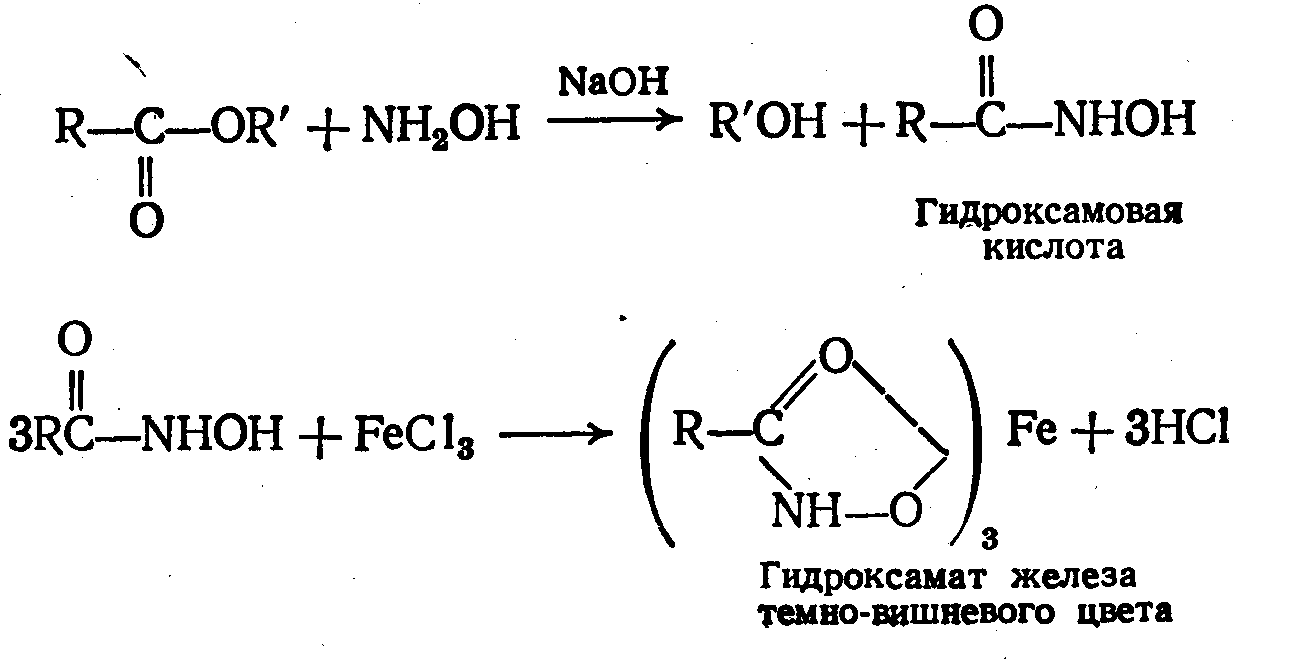
Доброкач-ть.
Ацетилсалициловая кислота. Допускается:
· салициловая кислота;
Количественное определение
По карбоксильной группе.
1) Алкалиметрия для кислот (бензойная, салициловая, ацетилсалициловая кислоты). Вариант нейтрализации, прямое титрование. Метод основан на кислых свойствах бензойной и салициловой кислот. Титруют в среде смешанных растворителей, в частности в присутствии спирта. Его добавляют для растворения кислот и предотвращения гидролиза
натриевой соли. Индикатор – фенолфталеин. Э= М.
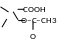

+ NaOH → + H2O
OH
По сложно-эфирной группе (ацетилсалициловая кислота).
Алкалиметрия вариант гидролиза, способ обратного титрования. Проводят гидролиз избытком раствора щелочи при нагревании. Затем избыток щелочи оттитровывают кислотой по индикатору метилоранжу. Э = М.

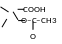
+ NaOH → + H2O
OH
NaOH + HCl → NaCl + H2O Э=М
избыток
Хранят препараты в ХУТ, в сухом и защищенном от света месте. От влаги сложный эфир и амид могут гидролизоваться.
Ацетилсалициловую кислоту применяют как противоревматическое, противовоспалительное, болеутоляющее и жаропонижающее
БИЛЕТ 6
1. Стандартизация - это процесс установления и применения стандартов. Стандарт – это эталон или образец, принимаемый за исходный, для сопоставления с ним других аналогичных объектов.
фармакопейный анализ - это совокупность способов исследования лекарственных препаратов и лекарственных форм, изложенных в НД. На основании результатов фармакопейного анализа, делается заключение о соответствии лекарственного средства требованиям НД. При отклонении от этих требований лекарство к применению не допускается.
ОФС – это статьи, включающие в себя перечень нормируемых показателей и методов контроля качества конкретной лекарственной формы, описание всех методов анализа лекарственных средств, требования к реактивам, титрованным растворам, индикаторам.
ФС – это статья, которая содержит обязательный перечень показателей и методов контроля качества лекарственного вещества или его лекарственной формы.
ОФС и ФС составляют ГФ – это основной документ, нормирующий качество выпускаемых в нашей стране лекарств и представляет собой сборник обязательных общегосударственных стандартов и положений.
ГФ Х издания содержит и ОФС, и ФС на лекарственные средства. ГФ ХI состоит только из ОФС, а на каждое лекарственное вещество или лекарственную форму, разрешенную к применению МЗ РФ утверждается ФС, которая имеет одинаковую юридическую силу с ГФ.
ФСП – это стандарт качества лекарственного средства под торговым названием, содержащий перечень показателей и методов контроля качества лекарственного средства, произведенного на конкретном предприятии, с учётом конкретной технологии данного предприятия и прошедшей экспертизу и регистрацию в установленном порядке.
Срок действия ФСП не более 5 лет.
Количественное определение – это заключительный этап фармацевтического анализа. Выбор оптимального метода количественного определения зависит от возможности оценить лекарственное средство по фармакологически активной части молекулы.
Классификация методов количественного определения лекарственных веществ
Физические методы |
Химические методы |
Физико-химические методы |
Биологические методы |
1. Определение плотности. 2. Температуры кипения. |
1. Гравиметрия. 2. Титриметрические методы: - осадительное титрование; - кислотно-основное; - окислительно – восстано-вительное титрование; - комплексонометрия; - нитритометрия. 3. Элементный анализ. 4. Газометрические методы.
|
1. Абсорбционные методы. 2. Оптические методы. 3. Методы, основанные на испускании излучения. 4. Методы, основанные на использовании магнитного поля. 5. Электрохимические методы. 6. Методы разделения. 7. Термические методы.
|
1. Испытания на токсичность. 2. Испытания на пирогенность. 3. На содержание гистаминоподобных веществ. 4. Микробиологическая чистота. |
2.
NaCl KCl |
Натрия хлорид Natrii chloridum Калия хлорид Kalii chloridum |
Описание. Растворимость. Белые кристаллы или белые кристаллические порошки без запаха, соленого вкуса. Растворимы в 3 ч воды, мало растворимы в спирте. Реакция раствора нейтральная. Так как это соли сильной кислоты и сильного основания не подвергаются гидролизу.

 COOH
COOH