- •Лекарственные вещества
- •Получение
- •I. Природные источники
- •II. Синтез
- •Подлинность
- •Доброкачественность
- •Количественное определение
- •Применение, хранение
- •Производные угольной кислоты
- •Получение
- •Подлинность
- •Доброкачественность
- •Количественное определение
- •Применение. Хранение.
- •Особенность приготовления инъекционных растворов NaHco3
- •Получение
- •Подлинность
- •Количественное определение
- •Применение, хранение
1 фенольный гидроксил. правило бромирования
2 терпингидрат и натрия гидрокарбонат
3 витамин д, получение холекальциферола и эргокальциферола
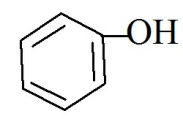
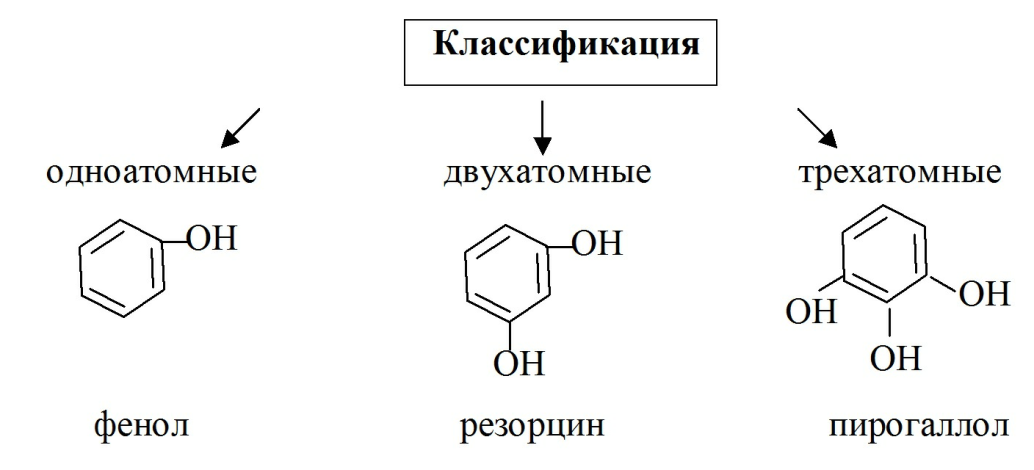
Фенольный гидроксил содержат лекарственные вещества группы фенолов ( фенол, резорцин, тимол)
Фенолы – это производные ароматических углеводородов, которые содержат в молекуле одну или несколько гидроксильных групп, непосредственно связанных с ароматическим ядром.
Лекарственные вещества
|
Фенол Phenolum purum оксибензол |
Описание. Растворимость. Бесцветные, слабо-розовые или желтоватые кристаллы или кристаллическая масса со своеобразным запахом. Растворим в 20 частях воды, легко растворим в спирте, эфире, хлороформе, глицерине.
|
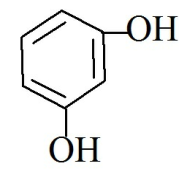
Резорцин Resorcinum м-диоксибензол
|
Описание. Растворимость. Белый или белый со слабым желтоватым оттенком кристаллический порошок со слабым характерным запахом. Очень легко растворим в воде и спирте, легко растворим в эфире, мало растворим в хлороформе. Под влиянием света и кислорода воздуха окрашивается в розовый цвет.
|
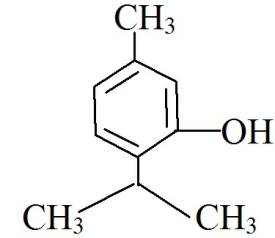
Тимол Thymolum 2-изопропил-5-метилфенол |
Описание. Растворимость. Крупные бесцветные кристаллы или кристаллический поро-
2
шок с характерным запахом, пряно-жгучего вкуса. Очень мало растворим в воде, легко растворим в спирте, эфире, хлороформе.
Фенолы летучи и перегоняются с водяным паром. Тимол в холодной воде погружается, а при 45 0С плавится и поднимается на поверхность. У одноатомных фенолов запах более сильно выражен, а у многоатомных в меньшей степени.
Получение
I. Природные источники
Фенол: получают из каменноугольной смолы (или древесной) путем фракционной перегонки при 170-210 0С. При этом при добавлении раствора NaOH, в водном слое будут находиться феноляты. Водный слой отделяют и кипятят с кислотой, при этом образуются фенолы, их перегоняют при 200 0С. Затем обрабатывают хромовой смесью, кристаллизуют и выделяют фракцию с Тпл. = 178-182 0С.
Резорцин: содержится в смолах и таннинах.
Тимол: содержится в эфирном масле чабреца. Оно содержит до 50 % фенолов, которые омыляют при нагревании с раствором NaOH, отделяют феноляты, подкисляют, кристаллизуют и очищают.
II. Синтез
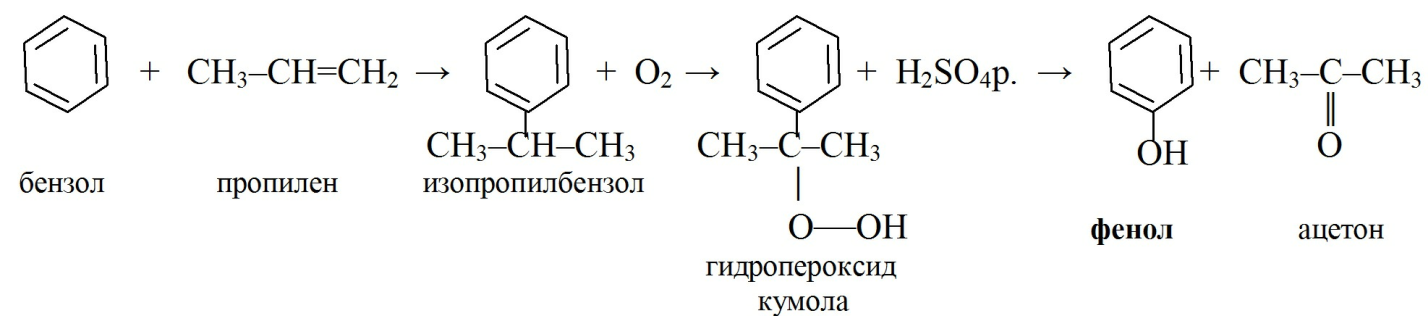
Фенол: получают алкилированием бензола фракцией крекинга нефти, содержащей пропилен. Образовавшийся изопропилбензол подвергают каталитическому окислению до образования гидропероксида кумола, который разлагают серной кислотой.
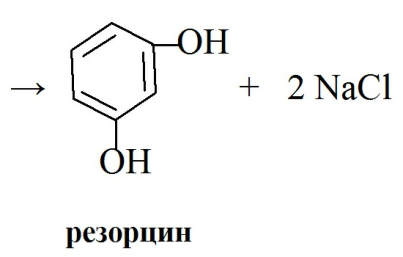
Резорцин: получают сульфированием бензола, образующуюся м-бензолдисульфокислоту сплавляют с гидроксидом натрия при 270 0С и нейтрализуют хлористоводородной кислотой. Полученный резорцин извлекают органическими растоврителями и очищают
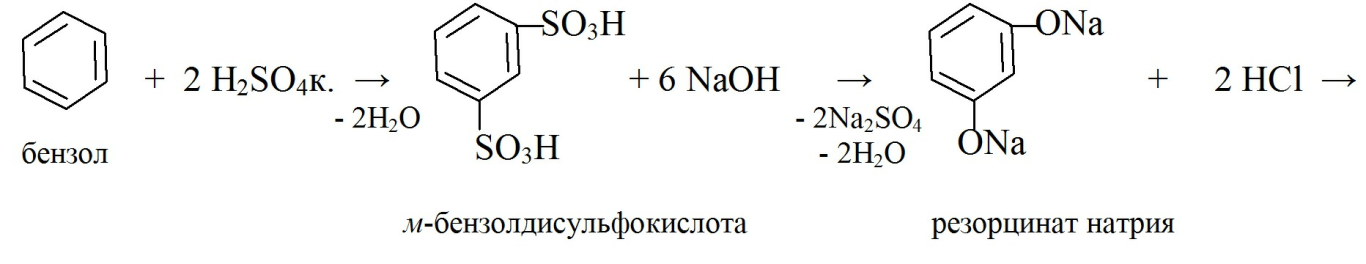
Тимол: синтезируют из м-крезола ацетилированием, с последующей конденсацией полученного продукта ацетоном при 300 0С и восстановлением водородом изопропенил-м-крезола:
Подлинность
Общие реакции (см. функциональный анализ)
Фенолы проявляют слабые кислотные свойства за счет подвижного атома водорода фенольного гидроксила и хорошо растворяются в растворах щелочей.
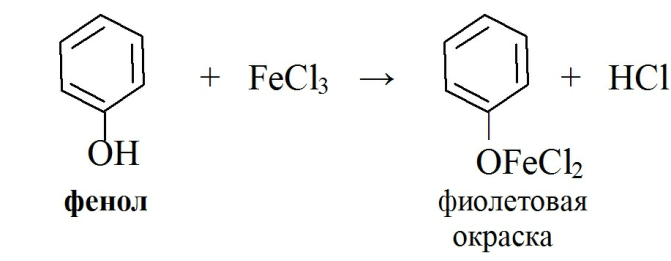
1) Реакция образования окрашенных растворимых комплексов с солями тяжелых металлов, в частности с FeCl3. Состав комплексов и их окраска обусловлены количеством фенольных –ОН и влиянием других функциональных групп:
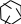
Тимол, ввиду пространственных затруднений в молекуле не образует окрашенных соединений с FeCl3.
2) Окислительно-восстановительные реакции на основе восстановительных свойств. Фенолы легко окисляются до хинонов, окрашенных в розовый или желтый цвет. Двухатомные фенолы окисляются быстрее, чем одноатомные. В щелочной среде окисление идет быстрее.
Резорцин окисляется с образованием сложной смеси продуктов:
· окисляется NaNO2 в присутствии H2SO4к. с образованием желтой окраски;
· при окислении аммиачным раствором нитрата серебра выпадает серый осадок серебра или серебряное зеркало на стенках пробирки;
· окисляется хлорамином в присутствии NH4OH и образует черно-фиолетовое окрашивание, которое при прибавлении HCl переходит в красно-розовое;
· с фосфорномолибденовой кислотой и NH4OH образует синее окрашивание.
Тимол и фенол так же образуют с данными реактивами синее и зеленое окрашивание соответственно.
Тимол окисляется:
· гипохлоритом Na в среде NH4OH с образованием зеленого окрашивания, переходящего в сине-зеленое;
· при растворении тимола в ледяной СH3COOH и добавлении смеси H2SO4к. и HNO3к. (1:1) появляется сине-зеленое окрашивание в отраженном свете и темно-красное окрашивание в проходящем свете.
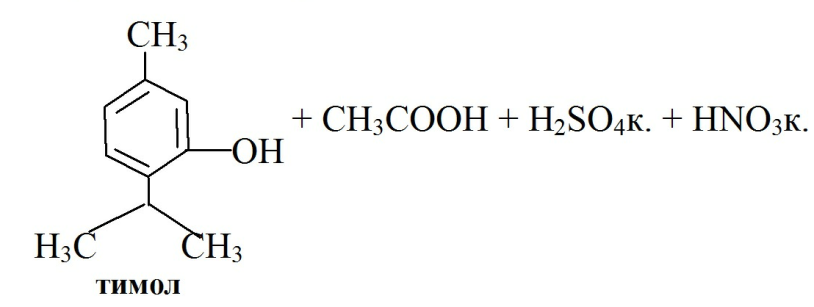
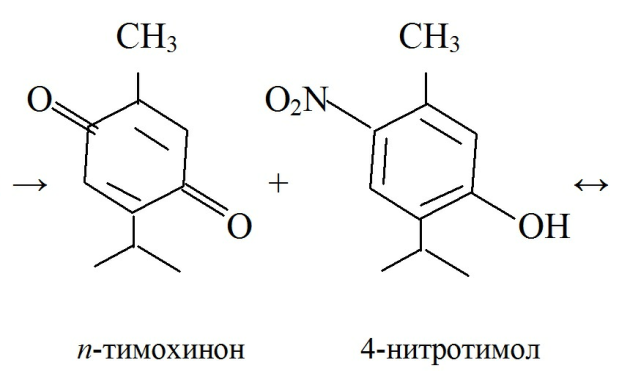
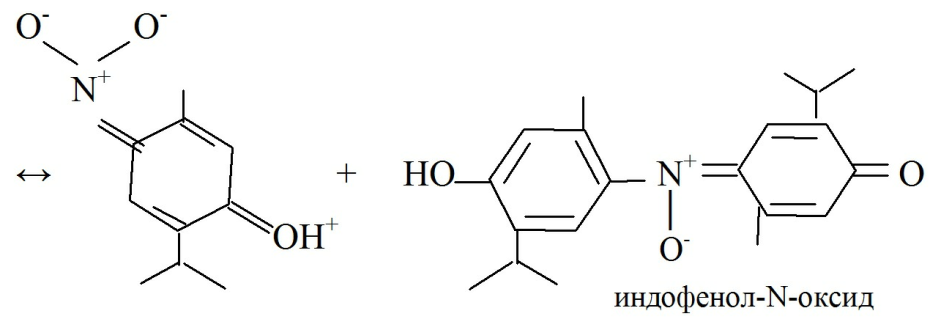
· Реакция образования индофенольного красителя основана на окислении фенолов до хинонов, которые при конденсации с NH3 или аминопроизводными и избытком фенола
5
образуют индофеноловый краситель:
фенол сине-зеленого цвета при + HCl переходит в красный;
резорцин буровато-желтого цвета при + HCl → красный;
тимол слабо-розового цвета при + HCl → желтый.
3) Реакции окисления и конденсации.
· Фенолы реагируют с формальдегидом с образованием окрашенных продуктов конденсации:
с реактивом Марки (формальдегид в концентрированной серной кислоте) образуется ауриновый краситель красного цвета (см. функциональный анализ);
с формальдегидом в щелочной среде сначала появляется розово-красное окрашивание, а затем бурый цвет, так как при стоянии образуются многократно окиметилированные продукты:
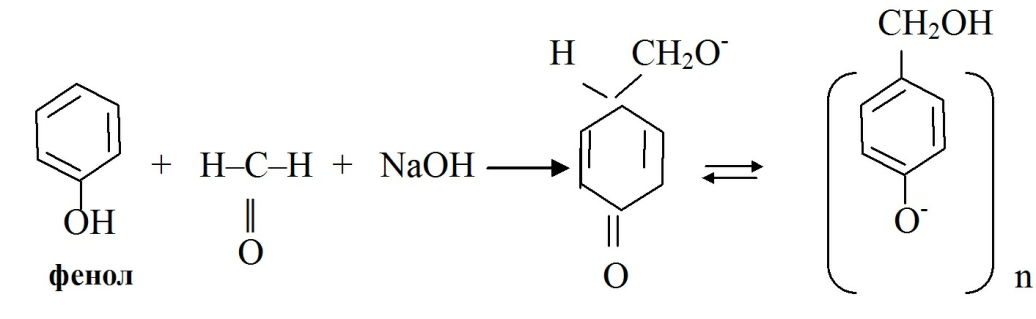
· При конденсации фенолятов с хлороформом в щелочной среде так же образуются окрашенные продукты реакции:

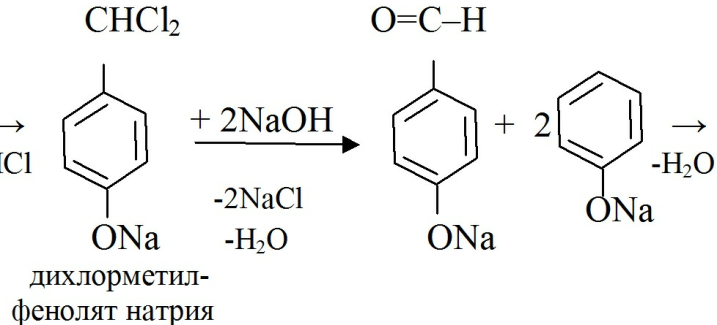
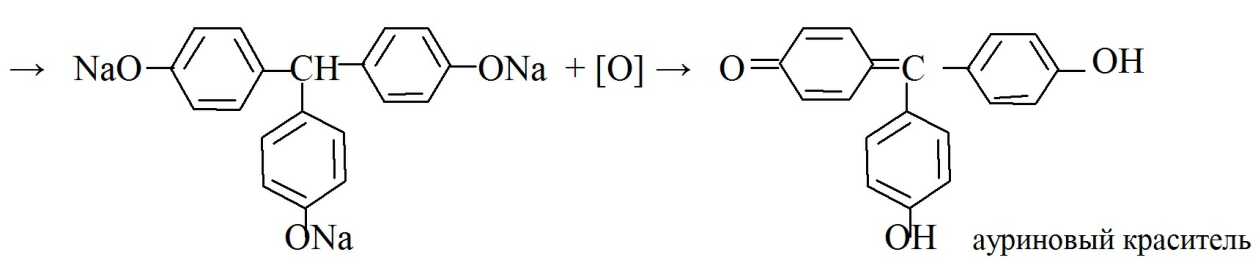
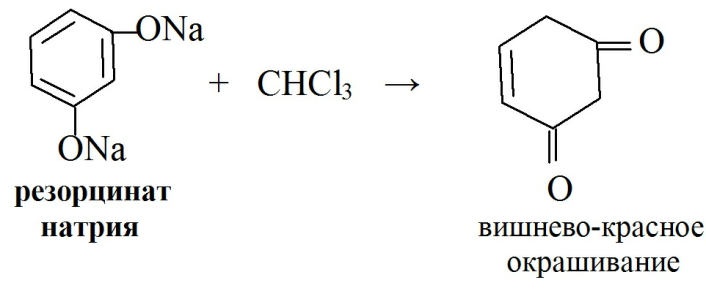
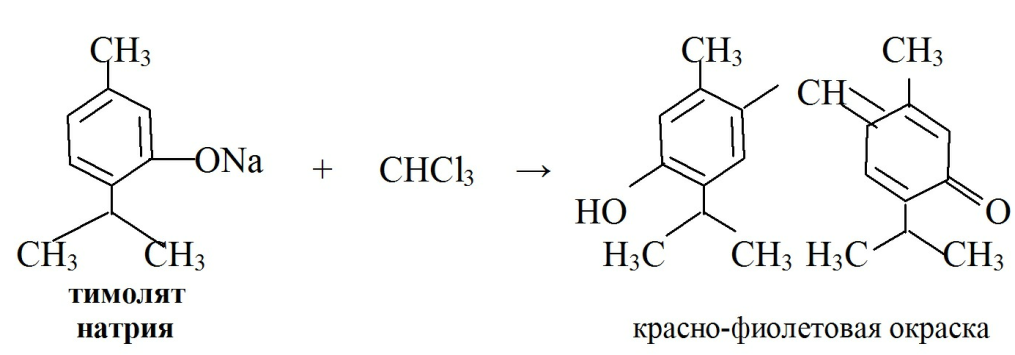
· При конденсации с 2,6-дихлорхинонхлоримидом образуется индофенол коричневого или желтого цвета, при прибавлении бутанола окраска становится зеленой.
· С ксантидролом в среде HCl образуется соль ксантилия малиново-красного цвета (фенол), сине-фиолетового цвета (резорцин) или красного цвета (тимол).
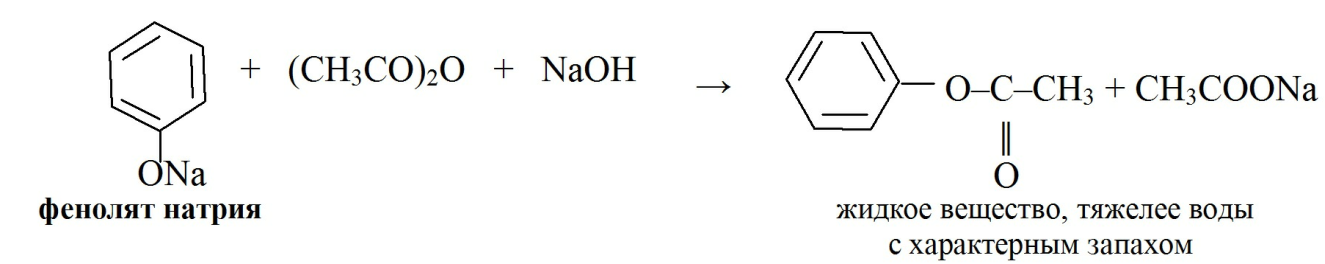
· С уксусным ангидридом фенолы образуют сложные эфиры – ацетаты:
· При сплавлении со фталевым ангидридом и последующем растворении плава в NaOH фенол образует продукт конденсации малинового цвета (фенолфталеин), тимол образует синий цвет (тимолфталеин), резорцин сначала образует плав желто-красного цвета, а после добавления раствора щелочи - зеленую флуоресценцию (см. учебник).
4) Реакции электрофильного замещения:
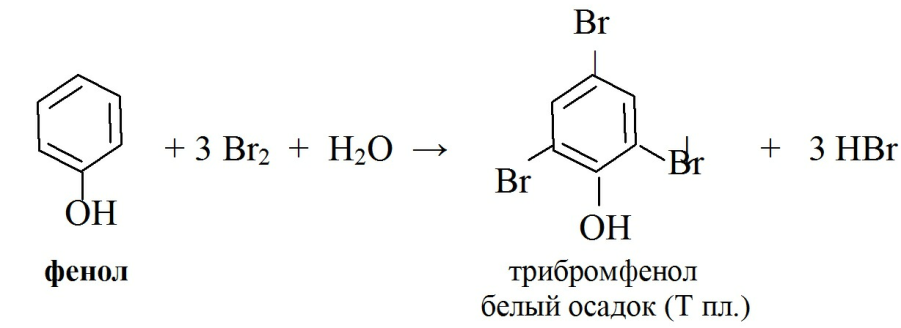
· Правило бромирования.реакция галогенирования (бромирования). Основана на электрофильном замещении водородов бензольного кольца в о- и п-положениях на бром, с образованием нерастворимого бромпроизводного. На холоду сначала образуется моно-, ди-, а затем уже трибромпроизводное в виде белого осадка.
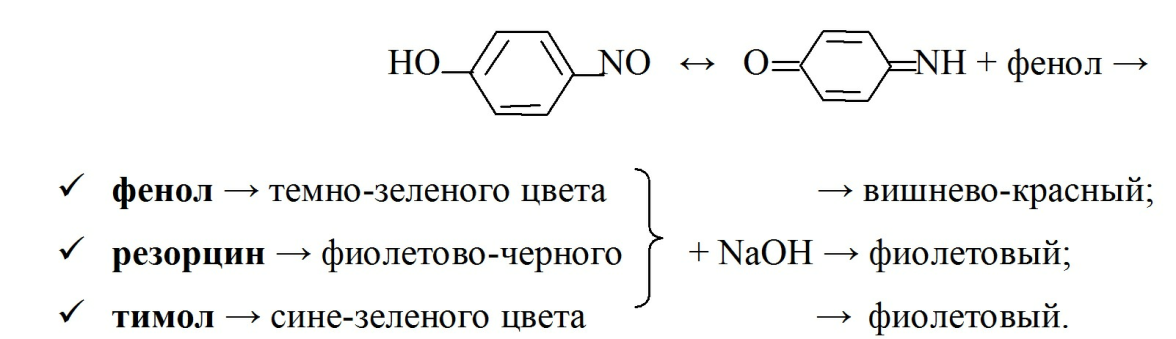
· реакция нитрозирования. Она является разновидностью индофенольной реакции. При проведении нитрозореакции Либермана к фенолу добавляют NaNO2 и HCl, образуется п-нитрозофенол (цвета зеленого чая), переходящий в п-хиноноксим, который еще с
7
одной молекулой фенола образует индофеноловый краситель:
· реакция нитрования проходит при действии азотной кислоты, при этом образуются о- и п- нитрофенолы:
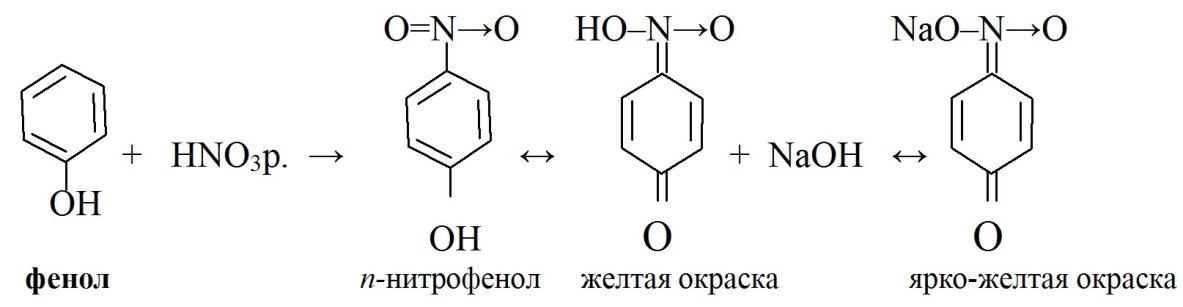
Аналогичная реакция протекает с нитрованным в о-положении фенолом - 1-нитрозо-2-нафтолом в присутствии HNO3. Образуется красно-бурое окрашивание, переходящее в фиолетовое, а затем при добавлении хлороформа, хлороформный слой окрашивается в желтый цвет (см. учебник). Тимол в аналогичных условиях дает сине-фиолетовую окраску хлороформного слоя.
5) Реакции сочетания:
· с диазореактивом; основана на способности фенолов вступать в реакцию сочетания с диазореактивом (диазотированная сульфаниловая кислота) с образованием азокрасителя (см. функциональный анализ).
· реакция сочетания с 4-аминоантипирином проводится в присутствии K3[Fe(CN)6] и NaOH, при этом образуется красно-фиолетовое окрашивание (антипириновый краситель).