
- •Современные методы физико-химического анализа
- •Введение
- •Методические указания к лабораторным занятиям Лабораторная работа 1
- •Лабораторная работа 2
- •Лабораторная работа 3
- •Лабораторная работа 4
- •Методические указания к практическим занятиям
- •Решение:
- •Методические указания к самостоятельной работе
- •3.1 Роль самостоятельной работы магистрантов в образовательном процессе
- •3.2 Самостоятельное изучение теоретических разделов курса
- •Раздел 1. Основные понятия и законы физической химии. Термохимия, химическое равновесие
- •Тема 1.1. Химическая термодинамика. Законы термодинамики.
- •Тема 1.2. Химическое равновесие. Константа химического равновесия.
- •Раздел 2. Термодинамика фазовых равновесий
- •Тема 2.1. Фазовые равновесия в однокомпонентных системах.
- •Тема 2.2. Фазовые равновесия в многокомпонентных системах.
- •Раздел 3. Теория растворов неэлектролитов
- •Тема 3.1. Общая характеристика и классификация растворов. Идеальные растворы.
- •Тема 3.2. Законы реальных растворов. Термодинамика систем жидкий раствор-газ.
- •Раздел 4. Поверхностные явления и адсорбция
- •Раздел 5. Основы электрохимии
- •Раздел 6. Основы химической кинетики
- •3.3 Практические занятия
- •3.4 Методика решения типовых задач по темам курса
- •Тема 1 Химическая термодинамика
- •Тема 2 Химическое равновесие
- •Поскольку константа равновесия равна 1, система находится в состоянии равновесия, реакция может протекать, как в прямом, так и в обратном направлении.
- •Тема 3 Растворы неэлектролитов
- •Тема 4 Поверхностные явления и адсорбция
- •Тема 5 Основы электрохимии
- •Тема 6. Основы химической кинетики
- •Методические указания к процессу самостоятельной подготовки к контролю знаний
- •Рекомендуемая Литература
- •Оглавление
- •660041, Г. Красноярск, пр. Свободный, 79
Лабораторная работа 2
фотометрическое определение содержания Fe3+ и Cu2+
Цель работы:
1. Ознакомиться с фотометрическим методом.
2. Изучить принципы определения концентрации ионов металлов методом градуировочного графика, сравнения, добавок и дифференциального, а также по среднему значению изомолярного коэффициента погашения.
3. Найти концентрацию Fe3+ в растворе, пользуясь методами градуировочного графика, сравнения, добавок и по среднему значению молярного коэффициента погашения; провести сопоставление результатов.
4. Найти концентрацию Cu2+ в растворе, используя подходящие варианты дифференциального метода.
Краткие теоретические сведения
Фотометрический метод анализа основан на измерении эффектов взаимодействия вещества с электромагнитным излучением оптического спектрального диапазона.
В фотометрическом анализе однородная нерассеивающая система поглощает световой поток видимой, а также ультрафиолетовой и ближней инфракрасной областей спектра. При этом она возбуждается, переходя на более высокий энергетический уровень. Анализ по поглощению световой энергии молекулами и сложными ионами анализируемых веществ составляет обширную группу методов, имеющих очень широкое применение как в научно-исследовательских лабораториях, так и на производстве. Наибольшее распространение получили методы, основанные на поглощении в видимой области спектра (в интервале длин волн 400 – 800 нм). Это объясняется возможностью получения различных интенсивно окрашенных органических и неорганических соединений, пригодных для использования в данном спектральном интервале с помощью достаточно простых и недорогих приборов.
Каждая однородная система обладает способностью поглощать излучение определенной длины волны. Нагляднее всего такая способность проявляется при работе с веществами, которые характеризуются избирательным поглощением в видимой части спектра. В результате поглощения одной или нескольких длин волн из сплошного белого света система приобретает определенную окраску (т. е. цвет любого окрашенного соединения будет дополнительным к цвету поглощенного излучения).
Количественный фотометрический анализ использует математическую зависимость между поглощательными свойствами однородной нерассеивающей системы и количеством частиц, участвующих в процессе поглощения. Следовательно, светопоглощение при определенной длине волны является материальным воплощением информации об исследуемом веществе и составляет аналитический сигнал. Обычно предпочитают выбирать такие условия фотометрирования, при которых наблюдается прямолинейная зависимость светопоглощения от концентрации раствора. Однако кроме метода, основанного на построении линейного градуировочного графика, существуют и другие варианты количественного фотометрического анализа. В частности, известны методы сравнения, добавок, дифференциальный, кинетический, широко распространен анализ многокомпонентных систем.
В фотометрической практике используют различные химические реакции, приводящие к образованию соединений, которые обладают значительным светопоглощением. При этом объектом изучения могут быть растворы как неорганических, так и органических веществ. Более всего в фотометрии распространены реакции комплексообразования, окисления-восстановления и т. д. Используемые в фотометрии реакции должны непременно сопровождаться возникновением, изменением или ослаблением светопоглащения раствора и протекать избирательно, быстро, воспроизводимо. Кроме того, желательно, чтобы окраска аналитической формы определяемого вещества была устойчивой во времени и к действию света.
Любое фотометрическое определение состоит из нескольких этапов: подготовка пробы и переведение анализируемого компонента в раствор, получение его окрашенной формы, измерение светопоглощения (т. е. регистрация аналитического сигнала при условиях обеспечивающих, максимальную интенсивность); соответствующая метрологическая оценка полученных данных. Все указанные этапы одинаково важны, поскольку от правильности выполнения каждой операции и учета любого фактора, влияющего на систему, зависит конечный результат эксперимента.
Условием применения фотометрического метода для количественного определения вещества является подчинение основному закону светопоглощения Бугера – Ламберта – Бера:
![]() ,
, ![]() (2.1)
(2.1)
где А – оптическая плотность (светопоглощение) раствора; Т – его пропускание; J – интенсивность излучения, прошедшего через раствор; Jo – интенсивность светового потока, падающего на раствор; – молярный коэффициент поглощения, l – толщина светопоглощающего слоя раствора; с – концентрация испытуемого вещества в растворе.
Важным дополнением служит закон аддитивности, сущность которого заключается в независимости поглощения индивидуального вещества от наличия других компонентов, обладающих собственным светопоглощением или индифферентных к электромагнитному излучению. Таким образом, оптическая плотность смеси компонентов, подчиняющихся основному закону и не взаимодействующих между собой, при данной длине волны поглощения равна сумме оптических плотностей отдельных компонентов при этой же длине волны.
![]() (2.2)
(2.2)
Измерение абсолютных значений Jo и J технически затруднительно. Поэтому для оценки степени поглощения света веществом проводят сравнение интенсивностей световых потоков, проходящих через испытуемый раствор и через раствор, поглощение которого условно принято нулю (раствор сравнения). Учитывая указанное обстоятельство, следует правильно понимать физический смысл оптической плотности.
Фотометрические приборы позволяют измерять величины оптической плотности (А) или пропускания (Т,%). Теоретически величина А изменяется от нуля до бесконечности. Однако не все величины оптической плотности могут быть измерены с достаточной точностью. Оптимальное значение оптической плотности, отвечающее минимальной погрешности измерений (△мин), по теоретическим расчетам равно 0,434. погрешность не превышает 2 △мин, если светопоглощение укладывается в интервал 0,1–1,2.
В фотометрии в качестве приемника и преобразователя световой энергии обычно используют фотоэлементы, сила фототока которых, согласно закону фотоэффекта, пропорциональна интенсивности падающего на них излучения. Эта сила измеряется, как правило, с помощью гальванометров – микроамперметров.
На рис. 2.1 приведена принципиальная схема двухлучевого спектрофотометра.
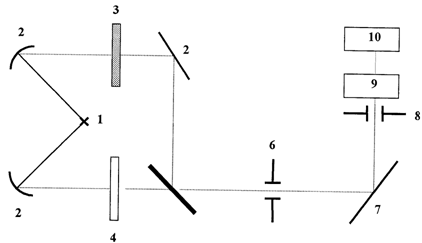
Рис. 2.1. Принципиальная схема двухлучевого спектрофотометра
Излучение от источника света 1 делится на два пучка системой зеркал 2. Рабочий пучок проходит через кювету с образцом 3, а пучок сравнения – через компенсатор фона 4. С помощью дискомодулятора 5 пучки попеременно направляются на входную щель монохроматора 6 и через нее – на дифракционную решетку 7, которая разлагает излучение в спектр и направляет его на выходную щель 8. Монохроматическое изображение щели попадает на приемник – висмутовый болометр 9. В отсутствии исследуемого образца интенсивности рабочего пучка и пучка сравнения одинаковы, в приемнике сигналы от этих пучков вычитаются; на выходе сигнал отсутствует. При поглощении рабочего пучка исследуемым веществом на приемник попадают лучи различной интенсивности, в результате чего в приемнике возникает переменный сигнал. После усиления и преобразования сигнала производится идентификация сигнала регистрирующим устройством 10. При медленном повороте решетки щель 8 последовательно вырезает узкие участки спектра, и вычерчивается кривая зависимости пропускания от длины волны.
До применения конкретной аналитической методики с использованием фотометрических измерений должны быть проведены некоторые предварительные измерения.
Выбор оптимальной длины волны
Для выбора светофильтров обычно измеряют оптическую плотность раствора со всеми имеющимися в данном приборе фильтрами. Тот светофильтр, при котором наблюдается максимальное значение светопоглощения, и применяют при последующих измерениях. Однако в видимой части спектра выбор фильтра может осуществляться и более быстро – по окраске раствора, с учетом того, что цвет светофильтра должен быть дополнительным к цвету исследуемого вещества.
Выбор оптимальной толщины светопоглощающего слоя
К фотометрическим приборам обычно прилагается набор кювет с различной толщиной светопоглощающего слоя (от 0,5 до 5 см). Кюветы подбирают таким образом, чтобы значения оптических плотностей серии растворов укладывались в оптимальный интервал 0,1 – 1,2, соответствующий приемлемой погрешности измерений. Выбор кювет при работе в видимой области спектра производится визуально, в соответствии с интенсивностью окраски растворов. Если растворы сильно окрашены, то пользуются кюветами с малой рабочей длиной. В случае слабо окрашенных растворов применяют кюветы большой длины, а в подобранную таким образом кювету наливают раствор из середины серии и измеряют его светопоглощение при оптимальной длине волны. Если оптическая плотность составляет примерно 0,3 – 0,5, то кювета выбрана удачно. Если же светопоглощенне выходят за границы указанного диапазона, то следует соответственно увеличить или уменьшить длину кюветы.
Выбор раствора сравнения
Раствор сравнения – раствор, светопоглощение которого принимают равным нулю. Под исследуемым подразумевают любой раствор, поглощение которого измеряют относительно раствора сравнения. Раствор, содержащий неизвестную концентрацию определяемого компонента, принято называть испытуемым (анализируемым).
Как указывалось ранее, фотометрические измерения проводят относительно раствора сравнения, светопоглощение которого условно принято равным нулю. При его выборе нужно учитывать поглощение исследуемого раствора и влияние сопутствующих компонентов. Растворы сравнения могут быть различные.
1. Растворитель (например, вода, толуол и т. п.) Обычно растворители используют лишь в том случае, если нет наложения в спектрах поглощения исследуемого соединения и реагента.
2. Раствор реагента. Он применяется при наличии наложения в спектрах поглощения растворов изучаемого комплексного соединения и реагента. Если комплекс неустойчив (и потому берется большой избыток реагента), то в растворе сравнения создают ту же его концентрацию, которая взята для приготовления исследуемого соединения. Когда комплекс устойчив (и потому достаточно малого избытка реагента, но поглощение его велико), используется один из вариантов дифференциального метода измерений.
3. Раствор контрольного опыта. Его готовят в условиях приготовления эталонных растворов, но не вводят определяемый элемент. При этом исключается влияние загрязнений, присутствующих в применяемых реактивах. Такой раствор сравнения рекомендуется для определения ультрамалых количеств элементов.
4. Раствор анализируемого объекта. Он применяется в случае, когда другие присутствующие в растворе элементы не образуют соединений с реагентом, но поглощают свет при той же длине волны.
При использовании кювет необходимо соблюдать следующие правила:
– Не держать растворы в кюветах длительное время, поскольку многие химические соединения способны адсорбироваться на поверхности стекла и загрязнять стенки кювет.
– Вымыть кюветы сразу же по окончании работы. Обычно их моют концентрированными кислотами, тщательно промывают водой, ополаскивают дистиллятом и вытирают снаружи. От органических веществ кюветы отмывают органическими растворителями.
– Не тереть во время мытья или вытирания стенки кювет чем-либо жестким, чтобы не повредить оптическую поверхность. Оптические поверхности следует оберегать от соприкосновения с посторонними предметами и друг с другом.
– Высушивать кюветы изнутри только при работе с органическими растворителями, не смешивающимися с водой. Для ускорения сушки можно последовательно ополоснуть кюветы этанолом и ацетоном.
– Ополаскивать кюветы перед заполнением небольшими порциями очередного раствора (во избежание его разбавления). При этом вначале работают с менее концентрированными растворами.
– Вытирать перед заполнением наружные стенки кювет (даже если они сухие и кажутся чистыми) обезжиренным, мягким, не оставляющим ворса материалом. Не рекомендуется для протирки использовать фильтровальную бумагу.
– Брать кюветы только за кромки и ребра, не касаясь пальцами их рабочих поверхностей.
– Не заполнять кюветы на весу. Перед заполнением ставить их на кусочек фильтровальной бумаги.
– Заливать кюветы до метки на их боковой стенке (т. е. до такого уровня, чтобы световой поток целиком проходил через раствор).
– Не допускать попадания раствора на внешние стенки кювет. В некоторых случаях в ограниченном объеме кюветы жидкость образует мениск и при этом по углам кюветы поднимается на значительную (~5 мм) высоту, иногда переползая на внешние стенки и создавая впечатление протекания кюветы,
– Устанавливать кюветы в кюветное отделение прибора всегда в строго определенное положение, чтобы избежать ошибок, связанных с различием в отражении и рассеянии света.
– Пользоваться одними и теми же кюветами при измерениях эталонных и испытуемого растворов.
– Накрывать кюветы крышками при работе с органическими растворителями во избежание их испарения.
– Не облучать растворы в течение длительного времени, так как при этом на внутренних стенках кювет появляются пузырьки газа, раствор иногда мутнеет, изменяется его светопоглощение. Для предотвращения подобных погрешностей нужно заново заполнить кюветы.
– Хранить кюветы в чистом виде, завернутыми в вату или мягкую бумагу, либо заполненными дистиллированной водой.
Приборы, реактивы: фотоэлектроколориметр КФК-5М с набором кювет, мерные колбы емкостью 100 мл, градуированные пипетки или бюретки.
Реактивы для определения Fe3+: соль железа (Ш) с содержанием 0,1 мг железа в 1 мл, 10 %-й раствор сульфосалициловой кислоты, концентрированный аммиак, 1 М раствор серной кислоты, сухой персульфат аммония, 50 %-й раствор роданида аммония, 1 М раствор соляной кислоты.
Реактивы для определения Cu2+: Соль меди с концентрацией 1 мг меди в 1 мл, 10 %-й раствор аммиака.
Порядок выполнения работы
Определении концентрации Fe3+ методом градуировочного графика
1. Приготовить в мерных колбах серию эталонных растворов:
а) поместить 0, 1, 2, 3, 4, 5 мл раствора соли железа, 2 мл серной кислоты, 10 мл раствора сульфосалициловой кислоты, довести до метки водой и перемешать (раствор в начале серии служит контрольным опытом);
б) прилить 0, 1, 2, 3, 4, 5 мл раствора соли железа, 10 мл раствора сульфосалициловой кислоты, 5 мл раствора аммиака, разбавить водой до метки и размешать (первый раствор используется в качестве контрольного опыта);
в) разбавить исходный раствор соли железа в 20 раз и перемешать; в колбы ввести 0, 6, 10, 20, 30, 40, 50 мл этого раствора, 2 мл соляной кислоты, несколько крупинок персульфата аммония, 2 мл раствора роданида аммония, довести до метки водой и размешать (раствор без соли железа является контрольным опытом).
Подобрать, взяв раствор из середины серии, подходящие кюветы и светофильтр, при котором светопоглощение максимально.
Измерить оптическую плотность всех растворов относительно контрольного опыта.
Построить градуировочный график и установить верхнюю границу его линейности.
Разбавить анализируемый раствор в мерной колбе водой и перемешать. Взять в мерные колбы его аликвотные части (10 мл) и, проведя те же операции, как при изготовлении серии эталонных растворов, фотометрировать относительно контрольного опыта.
Найти по градуировочному графику концентрацию испытуемого раствора. Содержание железа в нем представить в виде

 .
.
Определение концентрации Fe3+ методом сравнения
Рассчитать концентрацию исследуемого раствора, используя в качестве растворов сравнения эталонные растворы с оптической плотностью больше и меньше его светопоглощения.
Количество железа в нем представить в виде .
Определение концентрации Fe3+ методом добавок
Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов.
Взять в три мерные колбы одинаковые аликвотные части испытуемого раствора. В две колбы добавить разные, но точно известные количества определяемого элемента (с учетом соблюдения основного закона светопоглощения, установленного методом градуировочного графика). Прилить остальные компоненты так, как при изготовлении эталонных растворов, довести до метки водой и перемешать,
Измерить относительно контрольного опыта оптическую плотность анализируемого раствора и растворов с добавками, используя подходящие кюветы и длину волны максимального светопоглощения.
Концентрацию анализируемого раствора определить по формуле:
![]() (2.3)
(2.3)
где Ах – оптическая плотность анализируемого раствора; сх - концентрация определяемого компонента; сст - известное содержание определяемого компонента; которое добавляют в анализируемый раствор; Ах+ст – оптическая плотность раствора, содержащего определяемый компонент с добавкой.
Результаты представить в виде .
Определение концентрации Fe3+ по среднему значению изомолярного коэффициента погашения
1. Определить оптическую плотность стандартных растворов Аст1, Аст2, Аст3…
2. Для каждого раствора рассчитать молярный коэффициент погашения по формуле (2.1), а затем его усреднить.
Отобрать в мерные колбы аликвотные части испытуемого раствора, провести все необходимые операции и измерить оптическую плотность в подходящих кюветах при оптимальной длине волны.
Вычислить содержание железа (мг) в анализируемом растворе по формуле:
![]() (2.4)
(2.4)
представить
результат в виде
![]() .
.
Определение высоких концентраций растворов Cu2+ дифференциальным методом
Дифференциальные методы анализа применяют для определения больших количеств веществ, для устранения мешающего влияния посторонних примесей и исключения поглощения реактивов. Этот метод применяют еще и в тех случаях, когда из-за большой концентрации нарушается закон Бугера – Ламберта – Бера или когда значение оптической плотности выходит за границы шкалы прибора, а дальнейшее разбавление раствора нежелательно. Точность определения при использовании дифференциального метода повышается.
1. Приготовить в колбах эталонные растворы: ввести 5, 10, 15, 25, 30 мл раствора соли меди, 20 мл раствора аммиака, разбавить до метки водой и перемешать. Фотометрировать через 10 мин.
2. Подобрать подходящие кюветы и светофильтр, который обеспечивают максимальную оптическую плотность, проведя измерение оптической плотности раствора из середины серии по отношению к первому.
3. Фотометрировать все эталонные растворы относительно первого.
4. Построить градуировочный график.
5. Измерить оптическую плотность каждого эталонного раствора по отношению ко всем предыдущим растворам серии.
6. Вычислить по полученным данным фактор пересчета и усреднить его значение.
![]()
где Aотн = Ax – A0 – относительная оптическая плотность, A0, Ax – оптические плотности раствора сравнения и фотометрируемого раствора относительно растворителя, сст – концентрация стандартного раствора, с0 – концентрация раствора сравнения.
7. Провести с испытуемым раствором те же операции, которые выполнялись при изготовлении эталонных растворов.
8. Измерить его оптическую плотность относительно первого раствора и по графику найти концентрацию определяемого элемента.
9. Представить результаты в статистической форме.
Контрольные вопросы
1. Объясните, в чем заключается метод фотометрии.
2. Перечислите, какие методы фотометрии вы знаете.
3. Из каких этапов состоит фотометрическое исследование?
4. Какой закон применяется в фотометрическом методе анализа в дополнение к основному закону светопоглощения? В чем он заключается?
5. В чем заключается выбор оптимальной длины волны и толщины светопоглощающего слоя?
6. Дайте определение, что такое раствор сравнения и анализируемый раствор.
7. Перечислите правила использования кювет при фотометрии.
