
- •Введение
- •Виды элементарных связей в твердых телах и монолитных соединениях
- •Механизм образования монолитных соединений твердых тел
- •Двухстадийность процесса сварки
- •Сварка плавлением и давлением
- •Пайка и склеивание
- •Термодинамическое определение процесса сварки
- •Типовой баланс энергии процесса сварки
- •Классификация процессов сварки
- •Оценка энергетической эффективности процесса сварки
- •Расчет энергоемкости процессов сварки
- •Требования к источникам энергии для сварки
- •Проводимость газов
- •Электрический разряд в газах. Виды разряда Статическая вольтамперная характеристика
- •Возбуждение дуги и ее зоны Зоны дугового разряда
- •Вольт-амперная характеристика дуги
- •Элементарные процессы в плазме дуги. Эффективное сечение взаимодействия
- •Эффект рамзауэра
- •Ионизация. Потенциал ионизации
- •Термическая ионизация
- •Фотоионизация
- •Деионизация
- •Рекомбинация
- •Излучение плазмы
- •Квазинейтральность плазма
- •Термическое равновесие
- •Плазма – идеальный газ
- •Уравнение саха
- •Физический смысл уравнения саха
- •Эффективный потенциал ионизации
- •Явление переноса
- •Электропроводность
- •Амбиполярная диффузия
- •Теплопроводность плазмы
- •Саморегулирование столба дуги
- •Баланс энергии в столбе дуги
- •Эмиссионные процессы на поверхности твердых тел
- •Эмиссия элетронов с поверхности электродов
- •Термоэлектронная эмиссия
- •Влияние ускоряющего поля эффект шоттки
- •Автоэлектронная эмиссия или туннельные переходы
- •Фотоэмиссия
- •Вторичная эммиссия
- •Влияние неоднородности катодов. Пленочные и оксидные катоды
- •Эмиссионная пятнистость
- •Ионная эмиссия
- •Приэлектродные области сварочных дуг
- •Катодная область
- •Дуги с неплавящимися тугоплавкими катодами
- •Дуги с холодным катодом
- •Магнитное поле и катоды металлических дуг
- •Анодная область
- •Распределения напряжения по длине дуги
- •Баланс энергии дуги
- •Точный баланс энергии для катода
- •Плазменные струи в дуге
- •Характеристика плавящихся дуг
- •Магнитогидродинамика сварочной среды
- •Магнитное поле столба дуги
- •Магнитное поле сварочного контура
- •Дуга переменного тока
- •Вентильный эффект
- •Перенос металла в сварочной дуге. Виды переноса
- •Силы в дуге
- •Термодинамика
- •Приложения
- •Первое начало термодинамики.
- •Основные понятия и определения
- •Формулировка. Первое начало термодинамики
- •Изохорный процесс
- •Изобарный процесс
- •Энтальпия реалтьного вещества, имеющего одно фазовое превращение в твердом состоянии ( )
- •Стандартные условия. Термохимические расчеты
- •Второе начало термодинамики
- •Энтропия
- •Зависимость энтропии от температуры фазового состояния и концентрации
- •Стандартные условия
- •Изотерма химических реакций
- •Изобара химических реакций
- •Равновесие в гетерогенных системах. Правило фаз гиббса-коновалова
- •Константы равновесия в гетерогенных системах
- •Растворы. Закон распределения
- •Упругость насыщенного пара над растворами
- •Растворимость газов в жидкости
- •Растворение газов в металлах
- •Электролиты и их образование
- •Электрическая проводимость электролитов
- •Свариваемость
- •2. Методы оценки свариваемости сталей
- •3. Краткая характеристика свариваемости
Равновесие в гетерогенных системах. Правило фаз гиббса-коновалова
Гетерогенные системы могут быть:
однокомпонентные (Fe – пары, Fe – жид., Fe – тверд.);
многокомпонентные.
Число компонентов определяется числом различных веществ, составляющих систему, но так как они могут реализовать между собой, то необходимо учесть число возможных реакций между ними. Число компонентов равно разности чисел различных веществ в системе и независимых реакций между ними.
Пример.
![]() ,
,
![]() .
.
Таким образом числом компонентов называется число различного вида молекул, необходимого для построения данной системы.
Параметры состояния гетерогенной системы являются Т, Р и концентрация всех компонентов во всех фазах. Общее условие равновесия гетерогенных систем – равновесие между всеми частями – фазами.
,
![]() ,
,
,
![]() .
.
Условия равновесия зависит от строения системы, т.е. число фаз и компонентов.
Связь между параметрами равновесия и строением системы выражается правилом Гибса-Коковалова
![]() ,
,
где
![]() - число степеней свободы или параметров
равновесия,
- число степеней свободы или параметров
равновесия,
- число компонентов;
- число фаз в системе.
Пример №1.
Рассмотрим систему, состоящую из следующих компонентов.
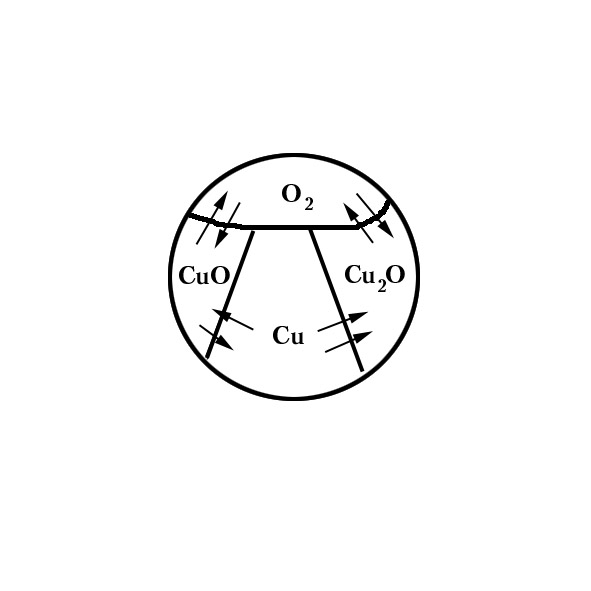
![]()
![]() ,
,
![]() - нонвариантная система.
- нонвариантная система.
Такие системы могут существовать
при определенной
и
![]() .
.
Пример 2.
,
,
![]() - моновариатная система. В этой системе
- моновариатная система. В этой системе
![]() .
.
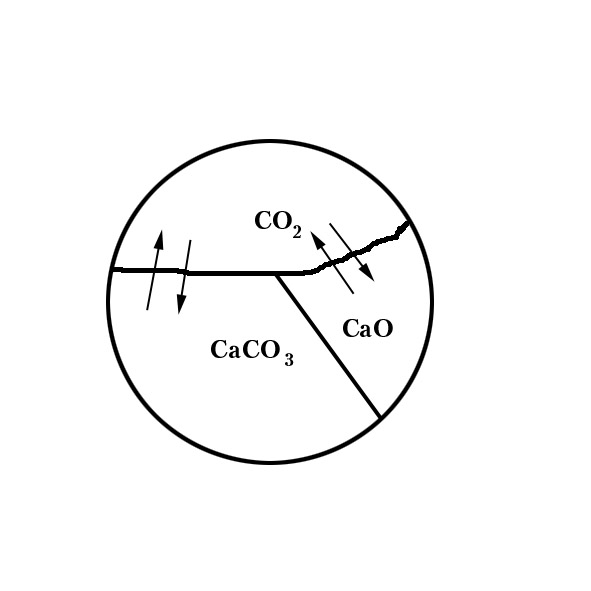
![]() .
.
Величина равновесного давления кислорода, зависящая только от температуры, носит название давление или упругости дислокации и определяет константу равновесия процесса.
Пример №3.
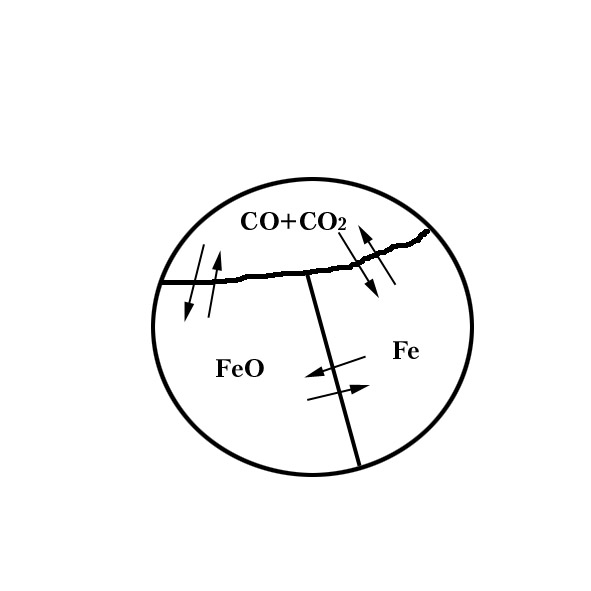
![]() ,
,
![]() ,
,
![]() - бивариантная система с двумя параметрами
равновесия.
- бивариантная система с двумя параметрами
равновесия.
В этой системе параметры
равновесия
и
,
которые зависят от концентрации
![]() ,
- концентрация составляющих газовой
среды.
,
- концентрация составляющих газовой
среды.
Равновесное давление
![]() будет зависеть от
и количества введенного в газовую смесь
.
будет зависеть от
и количества введенного в газовую смесь
.
![]() .
.
Константы равновесия в гетерогенных системах
В отличии от гомогенных систем, в гетерогенных системах константы равновесия выражаются в порциальных давлениях и не содержат порциальных давлений твердых или жидких фаз, если эти фазы представляют собой чистые вещества постоянного состава.
Пример.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Вычисление констант равновесия аналогично расчету гомогенных равновесий.
![]() ,
,
![]() ,
,
![]()
![]()
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Растворы. Закон распределения
Растворами называются гомогенные
системы (или часть системы – фаза),
состоящие из двух или нескольких
компонентов. Растворами называют жидкие
или твердые фазы. А так как в газообразном
состоянии силы взаим. между молекулами
равны, их называют газовыми смесями.
Взаим-е частиц растворенного вещества
и растворителя приводит к изменению их
свойств и создается новая система –
раствор. При образовании раствора резко
увеличивается энтропия
![]() .
Изменение энтальпии
,
.
.
Изменение энтальпии
,
.
Физическое свойство новой
системы – раствора всегда отличается
от свойств растворителя, так как вещество,
образуя с ним комплексы, понижает его
активность (всегда понижает упругость
его пара). А это приводит к изменению
![]() ,
,
![]() .
Изменение
,
,
упругости пара для данной температуры
описываются законами Рауля.
.
Изменение
,
,
упругости пара для данной температуры
описываются законами Рауля.
1Закон: Понижение давления насыщенного пара
![]() ,
,
![]() ,
,
![]() - давление пара над чистым растворителем;
- давление пара над чистым растворителем;
- давление пара над раствором;
- число молей растворимого вещества;
![]() - число молей растворителя.
- число молей растворителя.
2. Закон: Понижение
![]()
![]() ,
,
![]() -
растворителя;
-
растворителя;
- раствора;
![]() - константа кристаллизации;
- константа кристаллизации;
![]() - масса растворимого вещества;
- масса растворимого вещества;
![]() - молекулярный вес растворимого вещества;
- молекулярный вес растворимого вещества;
- масса растворителя.
3 Закон: Повышение
![]() ,
,
![]() - константа кипения.
- константа кипения.
Силы взаимодействия между частицами растворимого вещества и растворителя, а также между частицами самого растворимого вещества, больше. Это приводит к тому, что как бы уменьшается число частиц в растворе, способных самостоятельно перемещаться ми участвовать в процессе, т.е. уменьшается активность растворимого вещества.
![]() ,
,
![]() - активность растворимого вещества;
- активность растворимого вещества;
- коэффициент активности;
- концентрация в растворе.
зависит от температуры, концентрации и природы раствора.
В водных растворах малой
концентрации
![]() .
Для металлических растворов
.
Для металлических растворов
![]() .
.
