
- •1. Десульфурация стали. Десульфурация в дуговой печи, десульфурация тшс и металлическими десульфураторами.
- •2. Обезуглероживание стали (низколегированные и высоколегированные расплавы). Кинетика, термодинамика, обезуглероживание в вакууме.
- •3. Сортамент стали. Назначение марок сталей. Требования по примесям. Перспективные способы плавки.
- •4. Десульфурация стали. Десульфурация в дуговой печи, десульфурация тшс и металлическими десульфураторами.
- •5. Шихтовые материалы электроплавки. Требования к шихтовым материалам.
- •6. Дефосфорация стали в окислительных условиях. Методика расчета основных технологических параметров.
- •7. Проведение окислительного периода. Задачи решаемые в окислительный период. Технологические приемы решения задач.
- •9. Способы интенсификации периода расплавления и окислительного (обосновать).
- •10. Растворимость и предельная растворимость кислорода в железе. Содержание кислорода в металле после окислительного периода в дсп.
- •11. Технология выплавки стали 12х18н10т в дсп переплавом легированных отходов. Разобрать по периодам. Обосновать долю легированного лома.
- •12. Технология выплавки стали 03х18н11 методом аргоно-кислородного обезуглероживания. Обосновать необходимость изменения отношения o2 к Ar.
- •2.1. Выплавка полупродукта.
- •2.2. Внепечная обработка.
- •13. Технология выплавки стали 03х18н11 методом вакуум-кислородного обезуглероживания.
- •14. Технология выплавки стали на свежей шихте при отсутствии в цехе акос.
- •15. Технология выплавки стали на металлизованных окатышах.
- •16. Водород в стали. Растворимость. Источники поступления водорода. Способы снижения водорода в стали.
- •17. Азот в стали. Растворимость азота. Отрицательное и положительное влияние азота. Возможные способы легирования стали азотом.
- •18. Неметаллические включения. Классификация неметаллических включений. Способы удаления неметаллических включений, в том числе и при внепечной обработке (обосновать)
- •19. Акос. Особенности конструкции, технологические возможности.
- •21.Установка циркуляционного вакуумирования.
- •22. Вакуумная индукционная плавка. Основные элементы конструкции вип. Принцип работы вакуумных насосов, вакууматоров. Технология плавки.
10. Растворимость и предельная растворимость кислорода в железе. Содержание кислорода в металле после окислительного периода в дсп.
Прямое определение
![]() затруднено ввиду его малых величин
(10^-8 атм.), поэтому его находят посредством
смеси H2+H2O,
для которой
легко рассчитывается. Как показывают
результаты экспериментов, равновесная
концентрация O2 в жидком
железе при относительно небольших его
содержаниях линейно зависит от квадратного
корня из давления O2 в
газовой фазе. Эта зависимость, которую
принято называть законом Сивертса,
согласуется с выражением для константы
равновесия реакции:
затруднено ввиду его малых величин
(10^-8 атм.), поэтому его находят посредством
смеси H2+H2O,
для которой
легко рассчитывается. Как показывают
результаты экспериментов, равновесная
концентрация O2 в жидком
железе при относительно небольших его
содержаниях линейно зависит от квадратного
корня из давления O2 в
газовой фазе. Эта зависимость, которую
принято называть законом Сивертса,
согласуется с выражением для константы
равновесия реакции:
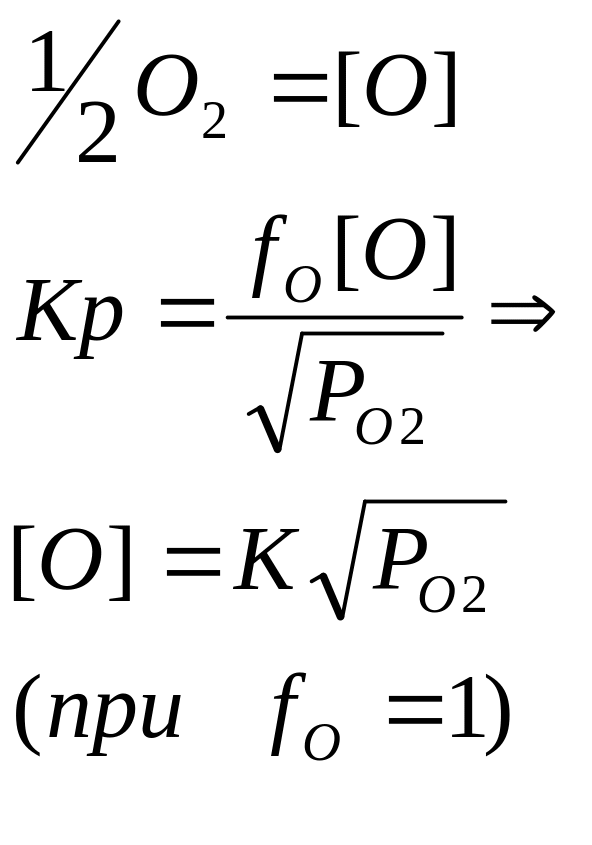
Это свидетельствует о том, что процесс растворения протекает в соответствии с написанной реакцией – т.е. сопровождается диссоциацией молекул на атомы.
В области повышенных содержаний
кислорода, наблюдается отклонение от
закона Сивертса. Эти отклонения можно
количественно выразить зависимостью
коэффициента активности:
![]()
Увеличение равновесной концентрации кислорода в расплаве при возрастании ограничено образованием пленки оксида.
При постоянной температуре появление третьей фазы в 2х-компонентной системе делает ее нонвариантной, и если равновесной 3х-фазной системе повысить давление кислорода, то его концентрация в расплаве не изменится. Система вернется к равновесному состоянию вследствие связывания избытка кислорода в оксид.
Чтобы отличить растворимость кислорода (в 2х-фазной области) от концентрации его в равновесии с оксидом, последнюю называют пределом растворимости. Т.о. растворимость и предел растворимости представляют собой совершенно различные понятия, которые характеризуют разные состояния равновесия.
Растворение газообразного кислорода в железа сопровождается сильным тепловыделением и, следовательно, отрицательной зависимостью растворимости от температуры.
![]()
Процесс растворения кислорода в железе из оксидной фазы сопровождается поглощением тепла -> предел растворимости кислорода увеличивается с увеличением температуры.
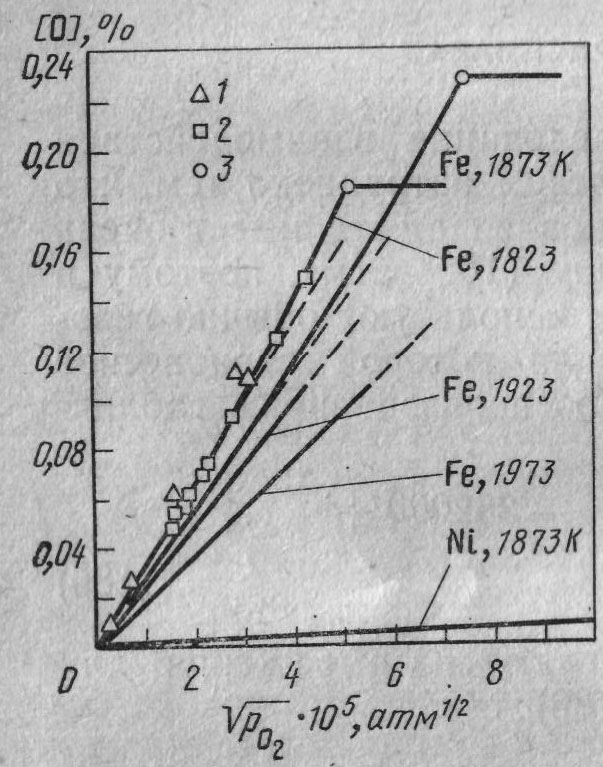
Известно, что при растворения кислорода в жидком железе оксиная фаза появляется при очень низком парциальном давлении (около 10Е-2 атм.)
На рисунке представлена зависимость концентрации кислорода от корня парциального давления. Наклонные линии соответствуют равновесию растворенного в металле кислорода с газовой фазой. Точки перегиба отвечают давлениям, при которых образуются оксиды данных металлов. При заданном значении парциального давления для металла с большим химическим сродством к кислороду характерна более высокая концентрация растворенного кислорода. Вместе с тем, чем больше химическое сродство данного металла к кислороду, тем при более низких парц. давлениях происходит образование оксидной фазы. Если к металлу прибавить некоторое количество раскислителя R, то оксидная фаза появится при более низком давлении кислорода.
При небольших концентрациях R роль знаменателя проявляется сильнее и концентрация кислорода с увеличением R убывает. В дальнейшем (после точки минимума) роль экспоненты возрастает и это приводит к увеличению концентрации растворенного кислорода.
По увеличению раскислительной способности элементы можно расположить в следующей последовательности: Ni, Fe, Mn, Si, Al. В этом ряду каждый последующий элемент будет раскислителем по отношению к предыдущему.
Взаимодействие Fe-C-O в расплавах.
Окисление углерода растворенным
кислородом сопровождается выделением
тепла, и поэтому полнее протекает при
пониженной температуре. В расплавах на
основе Fe температурная
зависимость константы выражена довольно
слабо, т.к. значение
![]() здесь невелико. С повышением температуры
скорость окисления углерода увеличивается.
здесь невелико. С повышением температуры
скорость окисления углерода увеличивается.
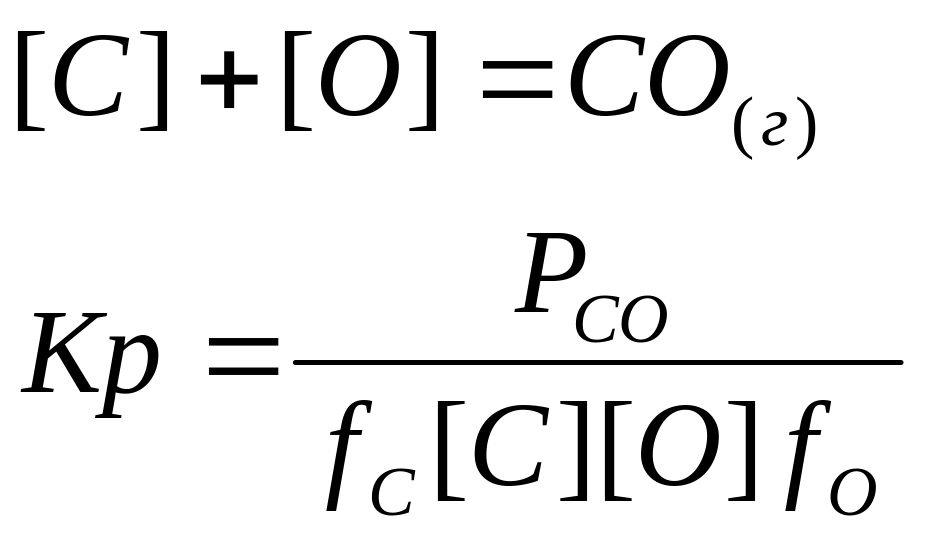

Высокий окислительный потенциал шлака обеспечивает при кипении ванны постоянное поступление в металл кислорода, где он расходуется на образование СО. Степень переокисления ванны определяется соотношением скоростей поступления и расходования кислорода.
При повышении температуры реакция идет
быстрее -> быстрее подходит к равновесию.
Понижение
![]() должно приводить к пропорциональному
уменьшению
должно приводить к пропорциональному
уменьшению
![]() .
В результате уменьшения
всего до 0,1 атм. – резко возрастает
раскислительная способность углерода,
а также обеспечивается глубокое
обезуглероживание расплава без
переокисления.
.
В результате уменьшения
всего до 0,1 атм. – резко возрастает
раскислительная способность углерода,
а также обеспечивается глубокое
обезуглероживание расплава без
переокисления.
Также сейчас обнаружена принципиальная возможность практически полного протекания реакции в глубоком вакууме.
