
- •Санкт-петербургская государственная химико- фармацевтическая академия
- •Санкт-Петербург
- •Содержание
- •1. Введение
- •2. Характеристика готовой продукции производства Метацин (β-диметиламиноэтилового эфира бензиловой кислоты йодметилат)
- •3. Выбор и технико-экономическое обоснование места размещения проектируемого производства
- •4. Технологическая часть
- •4.1. Химическая схема производства метацина
- •4.1.1. Химическая схема стадии тп-1 «Получение диметиламинобензилата (дмаэб)»
- •4.1.2. Химическая схема стадии тп-2 «Получение метацина технического»
- •4.2. Технологическая схема производства метацина
- •4.2.1. Технологическая схема стадии тп-1 «Получение диметиламиноэтилбензилат (дмаэб)»
- •4.2.2. Технологическая схема стадии тп-2 «Получение метацина технического»
- •4.2.3. Технологическая схема стадии тп-3 «Получение метацина фармакопейного»
- •4.3. Изложение технологического процесса
- •4.3.1. Стадия тп-1 «Получение диметиламиноэтилбензилата (дмаэб)» Подготовка оборудования
- •4.3.2. Стадия тп-2 «Получение метацина технического» Подготовка оборудования
- •4.3.3. Стадия тп-3 «Получение метацина фармакопейного» Подготовка оборудования
- •4.4. Расчет производительности оборудования по стадиям и операциям Стадия тп-1 «Получение диметиламиноэтилбензилата (дмаэб)»
- •Стадия тп-2 «Получение метацина технического»
- •Стадия тп-3 «Получение метацина фармакопейного»
- •4.4.1. Расчет коэффициента пересчета
- •4.5. Материальный баланс процесса (материальные расчеты) по проектируемым стадиям и операциям. Выбор оборудования
- •4.5.1. Расчет материального баланса стадии тп-1 «Получение диметиламиноэтилбензилата (дмаэб)» Материальный баланс 1 операции «Очистка бензацина гх и фильтрация от угля»
- •Загружено:
- •Расчет осадка:
- •Материальный баланс 2 операции «Нейтрализация бензацина»
- •Загружено:
- •2. Вступило в реакцию нейтрализации:
- •3. Образовалось в реакции нейтрализации:
- •Материальный баланс 3 операции «Кристаллизация»
- •Материальный баланс 4 операции «Фильтрация и промывка»
- •1. Загружено:
- •Расчет осадка:
- •Материальный баланс 5 операции «Сушка дмаэб»
- •1. Расчет осадка после высушивания:
- •4.5.2. Расчет материального баланса стадии тп-2 «Получение метацина технического» Материальный баланс 1 операции «Йодометилирование дмаэб»
- •Материальный баланс 2 операции «Фильтрация и промывка метацина технического»
- •1. Загружено:
- •2. Расчет осадка:
- •Материальный баланс 3 операции «Сушка метацина технического»
- •1. Расчет осадка после высушивания:
- •4.5.3. Расчет материального баланса стадии тп-3 «Получение метацина фармакопейного» Материальный баланс 1 операции «Растворение»
- •1. Загружено:
- •Материальный баланс 2 операции «Очистка и фильтрация от угля»
- •1. Загружено:
- •Расчет осадка:
- •Материальный баланс 3 операции «Перекристаллизация»
- •Материальный баланс 4 операции «Фильтрация и промывка метацина фармакопейного»
- •1. Загружено:
- •2. Расчет осадка:
- •Материальный баланс 5 операции «Сушка метацина фармакопейного»
- •1. Расчет осадка после высушивания:
- •4.5.4. Выбор оборудования
- •4.5.4.1. Нормы времени на проведение технологических операций и расчет числа операций в сутки
- •4.5.4.2. Выбор реактора р- 15 для проведения йодометилирования дмаэб
- •4.5.4.3. Проверка применимости реактора
- •4.5.4.4. Выбор оборудования
- •4.6. Тепловые расчеты. Проверочный расчет основного процесса и проверка правильности выбора основного аппарата
- •4.6.1. Физико-химические свойства реакционной массы на операции йодометилирования дмаэб
- •Плотность реакционной массы рассчитываем по формуле:
- •Вязкость смеси жидкостей рассчитываем по формуле:
- •Объемная концентрация твердой фазы рассчитывается по формуле:
- •Теплопроводность смеси жидкостей рассчитываем по формуле:
- •Теплоемкость смеси рассчитываем по формуле:
- •4.6.2. Гидромеханический расчет реактора
- •4.6.2.1. Проверка условий безопасной эксплуатации аппарата
- •4.6.2.2. Образование центральной воронки
- •4.6.3. Тепловой эффект химической реакции
- •Йодистый метил
- •Метацин
- •4.6.4. Тепловой баланс реактора йодометилирования р-15
- •4.6.5. Проверочный расчет коэффициента теплопередачи
- •4.7. Спецификация оборудования
- •5. Контроль и автоматизация производства
- •5.1. Перечень и параметры приборов, используемых для управления процессом
- •5.2. Перечень важнейших контрольных точек
- •6. Безопасность технологического процесса
- •6.1. Токсичные свойства сырья, вспомогательных веществ, полупродуктов, готового продукта и отходов производства
- •6.2. Пожароопасные свойства веществ. Газы и жидкости
- •6.3. Пожароопасные свойства веществ. Твердые продукты
- •6.4. Категорирование технологического оборудования по взрывоопасности
- •6.5. Защита от статического электричества
- •6.6. Категории производственных помещений по взрывопожарной и пожарной опасности
- •6.7. Классификация помещений по пуэ для подбора электрооборудования
- •Характеристика установленного электрооборудования
- •6.8. Безопасность технологического процесса и оборудования
- •6.9. Характеристика вредных производственных факторов
- •6.10. Обеспечение гигиенических норм производственных факторов
- •6.11. Вентиляция и отопление производственных помещений
- •6.12. Санитарная характеристика производственного процесса, спецодежда и средства индивидуальной защиты персонала
- •7. Промышленная экология
- •7.1. Образование и характеристика выбросов
- •Характеристика выбросов в атмосферу
- •Пары ацетона (р-15):
- •7.2. Образование и характеристика сточных вод
- •Характеристика сточных вод
- •7.3. Образование и характеристика отходов
- •Характеристика отходов
- •Расчет класса опасности отхода
- •Расчёт класса опасности угля отработанного на тп-1 и тп-3
- •8. Экономическая часть
- •8.1. Планирование работ по ремонту основного технологического оборудования
- •Организация планово-предупредительного ремонта ведущего технологического оборудования
- •8.2.1.2. Расчет затрат на основное технологическое оборудование
- •Расчет капитальных затрат на оборудование
- •8.2.1.2. Расчет сметы капитальных затрат, необходимых для реализации проекта Сводная смета капитальных затрат, необходимых для реализации проекта
- •8.2.2. Планирование текущих затрат на производство и реализацию проектируемой продукции
- •8.2.1.1. Расчет материальных затрат
- •8.2.1.2. Планирование фонда оплаты труда и величины страховых взносов во внебюджетные фонды
- •Планирование полугодового фот и величины страховых взносов во внебюджетные фонды
- •8.2.1.3. Расчет амортизационных отчислений
- •Амортизационные отчисления
- •8.2.1.4. Расчет сметы текущих затрат на производство и реализацию проектируемой продукции
- •Смета полугодовых затрат на производство и реализацию продукции
- •8.2.3. Планирование затрат на формирование оборотного капитала
- •Расчет потребности в оборотных средствах
- •8.3. Расчет показателей эффективности проектируемого фармацевтического производства
- •8.4. Оценка экономической эффективности инвестиций
- •Расчет денежных потоков инвестиционного проекта
- •Расчеты для определения внутренней нормы доходности инвестиционного проекта
- •Результаты оценки экономической эффективности инвестиционного проекта производства метацина
- •9. Строительная и санитарно-техническая часть
- •Расположение оборудования
- •10. Заключение
- •11. Список литературы
4.6.2.2. Образование центральной воронки
Для безопасной работы необходимо соблюдение правил [21]:


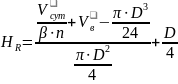 [21]
[21]
Высота и глубина воронки определяются по следующим формулам [21]:

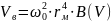

По
номограммам [21]
 и
и
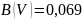
Тогда:


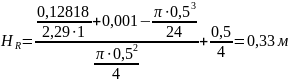
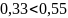
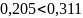
Условие безопасности соблюдается; угрозы поломки мешалки нет.
4.6.3. Тепловой эффект химической реакции
Тепловой эффект химической реакции представляет собой суммарное количество теплот, которое выделяется или поглощается при протекании всех химических реакций (основных и побочных) Его определяют по формуле:
Qх.р
=
 ·qр·η,
[10]
·qр·η,
[10]
где: Gисх – суточное количество исходного продукта, загруженного на реакцию, кг;
M – молярная масса исходного реагирующего вещества, г/моль;
qр – молярный тепловой эффект реакции, кДж/моль;
– число операций в сутки;
– число аппаратов;
1000 – переводной коэффициент для перевода кг в г;
𝜂 – выход по химической реакции.
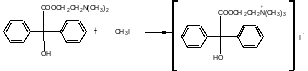
Молярный тепловой эффект химической реакции определяется по закону Гесса:
qp = Σqобркон – Σqобрнач [10]
где: qр – молярный тепловой эффект реакции, кДж/моль;
Σqобркон – сумма теплот образования конечных продуктов реакции, кДж/моль;
Σqобрнач – сумма теплот образования исходных веществ, кДж/моль;
Йодистый метил

По справочным данным Δ H = -3,29 ккал/моль [20]:
qобрCH3I= - Δ H· 4,19 = 3,29 · 4,19 = 13,79 кДж/моль
ДМАЭБ
По методу Караша-Свентославского:
qобр = Σn·qа – qсг, кДж/моль;
qсг = 109,1·n +Σ(Δζ), кДж/моль [10]
n= 4·С + Н – Р
qсгтв = qсгж – qпл
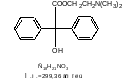
По справочным данным [20]:
ΔAr-Alk= - 14,7 кДж/моль
Δ = 14,7 кДж/моль
= 14,7 кДж/моль
Δ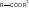 =
69,1 кДж/моль
=
69,1 кДж/моль
Δ =
108,9 кДж/моль
=
108,9 кДж/моль
Р = 5
Таблица 4.6.7
Элемент |
qа, кДж/г-атом |
С |
395,2 |
H |
143,2 |
I |
0 |
O |
0 |
N |
0 |
qсгж = 109,1·(4·18+1·21 – 5) – 14,7·2+ 14,7 + 69,1+ 108,9 = 9764,10 кДж/моль
qпл=K·Tпл=54,4· 373 = 2029,20 Дж/моль
K = 54,4 Дж/моль·К – для органических соединений [20]
qсгтв =9764,10 - 2,03 = 9762,07 кДж/моль
qобрДМАЭБ= Σn·qа – qсг=(18·395,2+21·143,2+1·0+3·0+1·0)-9762,07= 358,73 кДж/моль
Метацин
Теплоту образования метацина определим исходя из реакции образования соли амина:

qобрсоли амина = qобрДМАЭБ + qобрHI+ qн [10]
По справочным данным Δ H = -13,22 ккал/моль [20]
qобрHI= - Δ H · 4,19 = 13,22 · 4,19 = 55,39 кДж/моль
qн = 30,17 кДж/моль - принимаем по реакции нейтрализации слабого основания сильной кислотой [20]
qобр метацин= 358,73 + 55,39 + 30,17 = 444,29 кДж/моль
qp = 444,29 – 358,73 – 13,79 = 71,83 кДж/моль
Qх.р
=
 ·71,83·0,975
= 2121,87
кДж
·71,83·0,975
= 2121,87
кДж
4.6.4. Тепловой баланс реактора йодометилирования р-15
Разобьём процесс на тепловые режимы и составим температурный график процесса.

Рис. 4.6.4. Температурный график процесса йодометилирования
Загрузка ДМАЭБ. τ = 60 мин
Выдержка. τ = 180 мин
Охлаждение. τ = 180 мин
I режим – загрузка ДМАЭБ при 20 °С, τ = 60 мин
Уравнение теплового баланса:
Q1+ Q2 + Q3+Qм= Q4
Q5=0, т.к. t=const
Q6=0, т.к. tнар = t окр.ср.= 20 °С
Q1 – количество тепла, вносимого с перерабатываемыми веществами, кДж
Q1 = ΣGi·ci·tнач/(β·n), [10]
где: Gi – операционная масса i-го компонента, кг;
ci – удельная теплоемкость i-го вещества, кДж/кг;
tнач – начальная температура i-го вещества, ºС.
Таблица 4.6.8
-
Наименование компонента
Масса Gi,
кг
Теплоемкость ci, кДж/(кг·К)
ацетон
75,92
2,180
вода
0,49
4,182
йодистый метил
10,88
0,578
ДМАЭБ
20,77
1,333
примеси
0,64
1,333
Q1 = ((75,92·2,180 + 0,49·4,182 + 10,88·0,578+ 20,77·1,333+ 0,64·1,333)·20/(2,29·1) = 1767,54 кДж
Q3 – тепловой эффект процесса, кДж
Примем, что на I режиме реакция йодометилирования протекает на 20 %.
Q3= 0,20·Qх.р.
Q3 = 0,20 · 2121,87 = 424,37 кДж
Qм – количество тепла, выделяемое мешалкой в перемешиваемую среду, кДж
Qм = Nуд ·Vоп ·τ ·60 [10]
где: Nуд – удельная мощность, затрачиваемая на перемешивание жидкости, Вт/м3;
Vоп – операционный объем реакционной массы, м3 (Vоп = 128,18 л);
τ – длительность режима, мин.
Nуд = Nж/V,
где: V – объем жидкости в реакторе, м3.
Nуд= 6,02/0,12818 = 46,97 Вт/м3
Qм= 46,97·128,18·60·60/106 = 21,67 кДж
Q4 – количество тепла, накопленное продуктами реакции , кДж
Q4 =ΣGi·ci·tкон/(β·n), [10]
где: tкон – конечная температура i-го вещества, ˚С
Так как реакция проходит на 20 %, то:
Таблица 4.6.9
-
Наименование компонента
Масса Gi,
кг
Теплоемкость ci, кДж/(кг·К)
ацетон
75,92
2,180
вода
0,49
4,182
йодистый метил
8,94
0,578
ДМАЭБ
16,67
1,333
примеси
0,64
1,333
метацин
5,97
0,987
ДМАЭЭ ДФМУК
0,05
1,333
йодоводород
0,02
0,205
Q4= ((75,92·2,180 + 0,49·4,182 + 8,94·0,578+ 16,67·1,333+ 0,64·1,333+ 5,97·0,987+ 0,05·1,333+ 0,02·0,205)·20/(2,29·1) = 1762,09 кДж
Q2 – количество тепла, которое необходимо подвести, кДж
Q2 = Q4 – Q1– Qм – Q3
Q2 = 1762,09 – 1767,54 – 21,67 – 424,37 = – 451,49 кДж
Поверхность теплообмена:
Fт/о
=
 , [10]
, [10]
где: Δtср – средняя разность температур,
 – коэффициент
теплопередачи.
– коэффициент
теплопередачи.
При охлаждении жидким хладагентом, если температура реакционной массы остается постоянной:
Δtср
=
 ,
[10]
,
[10]
где: – температура жидкого теплоносителя на выходе из рубашки аппарата, ºС;
– температура жидкого теплоносителя на входе в рубашку аппарата, ºС;
tр.м. – температура реакционной массы в аппарате, ºС.
Задаемся для охлаждающей воды =12 °С, =14 °С, тогда:
Δtср
=
 =
6,95 °С
=
6,95 °С
Коэффициент теплопередачи определяется по формуле:
К=
 ,
Вт/м2·К
[10]
,
Вт/м2·К
[10]
где: α1 – коэффициент теплоотдачи от теплоносителя (охлаждающей воды) к стенке аппарата, Вт/м·К;
α2 – коэффициент теплоотдачи от стенки аппарата к реакционной массе, Вт/м·К;
∑rзагр- термическое сопротивление загрязнений стенок с внутренней и наружной стороны, Вт/м2·К;
δст– толщина стенки аппарата, м
λст – теплопроводность нержавеющей стали, Вт/м2·К (λст= 46,5 Вт/м2·К – по справочным данным)
Охлаждение осуществляется водой, для которой по справочным данным α1=300 Вт/м·К, rзагр= 18·10-5Вт/м2·К [10].
Коэффициент теплоотдачи от стенки аппарата к реакционной массе
α2
=
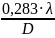 ·
Re0,75
· KN0,25
·
·
Re0,75
· KN0,25
·
 ·
·
 ·
·
 ,
Вт/м2·К
[10]
,
Вт/м2·К
[10]
где: Re – критерий Рейнольдса;
KN – критерий мощности;
с – теплоемкость перемешиваемой среды, Дж/кг·К;
λ – теплопроводность перемешиваемой среды, Вт/м·К;
D, dм – диаметр аппарата и мешалки, м;
μ, μст – вязкость перемешиваемой среды, при средней температуре в аппарате и при температуре стенки; Па·с;
HR – высота жидкости в аппарате, м.
α2
=
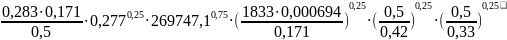 =
1590,65
Вт/м2·К
=
1590,65
Вт/м2·К
Данные взяты из гидромеханического расчета реактора Р-15
К=
 =
183,45 Вт/м2·К
=
183,45 Вт/м2·К
Fт/о
=
 =
0,10 м2
=
0,10 м2
0,10< 0,81 , т.е. Fт/о<Fном ⇨ поверхности теплообмена достаточно.
Расход хладагента (охлаждающей воды)
G =
 =
=
 = 53,88
кг
= 53,88
кг
Тепловая нагрузка:
q2
=
 =
=
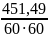 = 0,13 кВт [10]
= 0,13 кВт [10]
II режим – выдержка при 20 °С, τ = 180 мин
Уравнение теплового баланса:
Q1+ Q2 + Q3+Qм= Q4
Q5=0, т.к. t=const
Q6=0, т.к. tнар = t окр.ср.= 20 °С
Q1II= Q4I
Q1 = 1762,09 кДж
Примем, что на II режиме реакция йодометилирования протекает на 80 %.
Q3= 0,80·Qх.р.
Q3 = 0,80 · 2121,87 =1697,50 кДж
Nуд= 6,02/0,12818 = 46,97 Вт/м3
Qм= 46,97·128,18·180·60/106 = 65,01 кДж
Так как реакция проходит на 80 %, то:
Таблица 4.6.10
-
Наименование компонента
Масса Gi,
кг
Теплоемкость ci, кДж/(кг·К)
ацетон
75,92
2,180
вода
0,49
4,182
йодистый метил
1,16
0,578
ДМАЭБ
0,26
1,333
примеси
0,64
1,333
метацин
29,84
0,987
ДМАЭЭ ДФМУК
0,27
1,333
йодоводород
0,11
0,205
Q4= ((75,92·2,180 + 0,49·4,182 + 1,16·0,578+ 0,26·1,333+ 0,64·1,333+ 29,84·0,987+ 0,27·1,333+ 0,11·0,205)·20/(2,29·1) = 1740,26 кДж
Q2 = Q4 – Q1– Qм – Q3
Q2 = 1740,26 – 1762,09 – 65,01 – 1697,50 = – 1784,44 кДж
Поверхность теплообмена:
Fт/о = , [10]
Δtср = = 6,95 °С
К= = 183,45 Вт/м2·К
Fт/о
=
 =
0,15 м2
=
0,15 м2
0,15< 0,81 , т.е. Fт/о<Fном ⇨ поверхности теплообмена достаточно.
Расход хладагента (охлаждающей воды)
G =
=
 = 212,94
кг
= 212,94
кг
Тепловая нагрузка:
q2
=
=
 = 0,16 кВт [10]
= 0,16 кВт [10]
III режим – охлаждение до 0 °С, τ = 180 мин
Уравнение теплового баланса:
Q1 + Q2 + Qм = Q4 + Q5 + Q6
Q1III=Q4II = 1740,26 кДж
Nуд= 6,02/0,12818 = 46,97 Вт/м3
Qм= 46,97·128,18·180·60/106 = 65,01 кДж
Q4 =
 ·
tкон
=
·
tкон
=
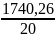 · 0 = 0 кДж
· 0 = 0 кДжQ5 – количество тепла, расходуемое на нагрев (охлаждение) аппарата, кДж
Q5 = 0,7·Gап·cмат· ( tкон – tнач ) · Kпот [10]
где: 0,7 – коэффициент, учитывающий неравномерность нагрева;
Gап – масса аппарата, кг;
cмат - теплоемкость материала, из которого изготовлен аппарат, кДж/кг·К (0,5 кДж/кг·К – для стали);
tкон – средняя конечная (для данного режима) температура аппарата, ˚С;
tнач– средняя начальная (для данного режима) температура аппарата, ˚С;
Kпот – коэффициент, учитывающий потери на нагрев эмали и изоляции (1,11 – для эмалированного аппарата с изоляцией).
Коэффициент теплопередачи:
К= , Вт/м2·К
В качестве хладагента используется холодильный рассол.
Принимаем по справочным данным: α1=200 Вт/м·К, rзагр= 18·10-5Вт/м2·К.
К=
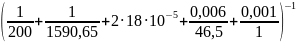 =
140,49 Вт/м2·К
=
140,49 Вт/м2·К
Принимаем начальную температуру рассола (раствор хлорида натрия) Θ1= - 5 °С, конечную температуру Θ2= - 2 °С. Средняя температура рассола:
A
=
 =
=
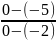 = 2,5
= 2,5
Δtср
=
 =
=
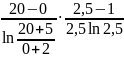 = 5,18 °С
= 5,18 °С
Θ2ср.кон. = Θ1 + Δtср ·lnA = - 5 + 5,18·ln2,5= - 0,25 °С
t1
=
 =
=
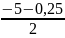 =
- 2,63 °С
=
- 2,63 °С
Конечная температура аппарата определяется по формулам:
tст1=
t1– =
–2,63–
=
–2,63–
 = - 0,78 °С
= - 0,78 °С
tст2=
t2
+
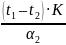 =
0 +
=
0 +
 = - 0,23 °С
= - 0,23 °С
tкон
=
 =
= = - 0,51 °С
= - 0,51 °С
Q5 = 0,7·250·0,5· (–0,51 – 20 ) · 1,11 = – 1992,03 кДж
Q6 – количество тепла, теряемое аппаратом в окружающую среду, кДж
Q6 = Q6из + Q6неиз [10]
Q6= Fап·α·(tнар–tокр.ср.) · τ · 3,6 [10]
где: Q6из – количество тепла, теряемое изолированной частью аппарата, кДж;
Q6неиз – количество тепла, теряемое неизолированной частью аппарата, кДж;
Fап – площадь поверхности аппарата, м2;
α – коэффициент теплоотдачи от стенки в окружающую среду, Вт/м2·К;
tнар– температура наружной поверхности аппарата, °С;
tокр.ср – температура окружающей среды, °С;
τ – продолжительность процесса, ч;
3,6 – коэффициент для перевода Дж в кДж и секунд в часы.
α = 9,74 + 0,07·(tнар – tокр.ср.) [10]
Принимаем температуру на поверхности изоляции tиз= 5 °С (т.к. хладагент - холодильный рассол), температуру окружающей среды tокр.ср = 20 °С. Температуру неизолированной части аппарата принимаем равной средней температуре стенки.
αиз= 9,74 + 0,07·(5 – 20) = 8,69 Вт/м2·К
αнеиз= 9,74 + 0,07·(–0,51 – 20) = 8,30 Вт/м2·К
Fиз = Fруб + Fобеч + Fкр· x,
где: х – процент крышки, покрытый изоляцией.
Fнеиз= Fкр·(1-х)
Fруб= 𝜋·Dнар·Hцил+1,086·(Dнар)2
Dнарруб = D1+2·S1+2·δизол= 0,55+2·0,004+2·0,05 = 0,658 м
Hцилруб=
 =
=
 =
=
 = 0,34 м
= 0,34 м
Fруб= 𝜋·0,658·0,34+1,086·0,6582 = 1,17 м2
Fобечцил= 𝜋·Dоб·Hоб
Dоб = D+2S+2δизол = 0,5+2·0,006+2·0,05 = 0,612 м
Hоб = H4 – S – D/4– Hрубцил
Hоб
= 0,55 – 0,006 –
 – 0,34 = 0,079 м
– 0,34 = 0,079 м
Fобечцил= 𝜋·0,612·0,079 = 0,15 м2
Fкриз = 1,086·D2об· х
Fкриз = 1,086·0,6122· 0,5 = 0,20 м2
Fиз = 1,17 +0,15+0,20 = 1,52 м2
Fнеиз= 1,086·0,6122·0,5 = 0,20 м2
Q6из = 1,52·8,69·(10 – 20.) · (180/60) · 3,6 = - 1425,55 кДж
Q6неиз = 0,20·8,30·(– 0,51 – 20.) · (180/60) · 3,6 = - 367,70 кДж
Q6 = - 1425,55 +(- 367,70) = - 1794,25 кДж
Q2 = Q5 + Q6 + Q4 – Q1– Qм
Q2 = –1992,03 – 1794,25 + 0 – 1740,26 – 65,01= – 5591,55 кДж
Поверхность теплообмена:
Fт/о =
Fт/о
=
 =
0,78 м2
=
0,78 м2
0,79 < 0,81 , т.е. Fт/о<Fном ⇨ поверхности теплообмена достаточно.
Расход хладагента (холодильного рассола – раствора хлорида натрия)
G =
 =
=
 =
296,59
кг
=
296,59
кг
Тепловая нагрузка:
q2
=
=
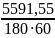 = 0,52 кВт
[10]
= 0,52 кВт
[10]
