
Термодинамика
1. Қасиеттері бойынша ажырылатын, бөлу беті бар, екі немесе одан да көп фазадан тұратын термодинамикалық жүйе:
А) ашық
В) жабық
С) оқшау
D) гомогенді
Е) гетерогенді +
2. «Ашық ыдыстағы глюкозаның сұйытылған ерітіндісі» жататын жүйе:
А) дөрекі дисперсті
В) гетерогенді
С) оқшау
D) жабық
Е) ашық +
3. «Жабық ыдыстағы 0,9%-ды NaCl ерітіндісі» жататын жүйе:
А) дөрекі дисперсті
В) гетерогенді
С) оқшау
D) жабық +
Е) ашық
4. Изобаралық-изотермиялық жағдайдағы жүйенің энергия қорын сипаттайтын күй функциясы:
А) температура
В) қысым
С) энтальпия +
D) энтропия
Е) Гиббс энергиясы
5. Изобаралық-изотермиялық жағдайда химиялық реакция нәтижесінде бөлінетін немесе
сіңірілетін жылу мөлшері:
А) температуралық коэффициент
В) реакцияның жылу эффектісі +
С) стандартты ыдырау жылуы
D) стандартты түзілу жылуы
Е) стандартты бейтараптану жылуы
6. «Кез келген химиялық қосылыстың ыдырау жылуы оның түзілу жылуына абсолюттік шамасы бойынша тең, бірақ таңбалары қарама-қарсы» - бұл анықтама:
А) термодинамиканың бірінші бастамасы
В) термодинамиканың екінші бастамасы
С) Лавуазье-Лаплас заңы +
D) Гесс заңы
Е) Гесс заңының салдары
7. Лавуазье-Лаплас заңының математикалық өрнегі:
А) Q = DU + A
В) DHт = -DHы +
С) QV = DU
D) Qp = DH
Е) DHт = DHы
8. Әр нүктедегі қасиеттері бірдей, бөліну беті болмайтын термодинамикалық жүйе:
А) гомогенді +
В) гетерогенді
С) оқшау
D) ашық
Е) жабық
9. «Т=298,15 К температурада және р=101,325 кПа қысымда жай заттардан 1 моль күрделі зат түзілгендегі реакцияның жылу эффектісі » - бұл:
А) түзілу жылуы
В) стандартты түзілу жылуы +
С) жану жылуы
D) бейтараптану жылуы
Е) ыдырау жылуы
10. Екі немесе одан да көп фазалардан тұратын, қасиеттері бойынша ажыралатын, бөлу беті бар термодинамикалық жүйе:
А) оқшау
В) жабық
С) ашық
D) гетерогенді +
Е) гомогенді
11. Гомогенді термодинамикалық жүйе:
А) адам
В) өсімдік
С) қанттың судағы сұйытылған ерітіндісі +
D) тұнба бетіндегі натрий хлоридінің қаныққан ерітіндісі
Е) дәрілік препараттың ұнтағы.
12. Гетерогенді термодинамикалық жүйге жатады:
А) газдалмаған минералды су
В) қанттың судағы сұйытылған ерітіндісі
С) глюкозаның судағы сұйытылған ерітіндісі
D) NаСІ судағы сұйытылған ерітіндісі
Е) дәрілік препараттардың ұнтағы +
13. Қоршаған ортамен энергиясымен де, массасымен де алмасатын термодинамикалық жүйе:
А) ашық +
В) жабық
С) оқшау
D) гомогенді
Е) гетерогенді
14. Қоршаған ортамен энергиясымен алмасатын, массасымен алмаспайатын термодинамикалық
жүйе:
А) ашық
В) жабық +
С) оқшау
D) гомогенді
Е) гетерогенді
15. Жабық термодинамикалық жүйеге жатады:
А) адам
В) өсімдік
С) суыған тас +
D) термос
Е) тірі клетка
16. Термодинамиканың бірінші заңының математикалық өрнегі
А) DG = DН - ТDS
В) Q = DU + pDV +
С) PV = m/N · RT
D) DS = Qқай-ды / T
Е) V = k CaA CbB
17. Изобаралық процестерде:
А) p = const +
B) T = const
C) V = const
D) m = const
E) H = const
18. Термодинамикалық жүйелердегі изохоралық процестерде өзгермейді:
А) қысым
В) температура
С) көлем +
D) ішкі энергия
Е) энтальпия
19. Изобаралық процестегі жылу эффектісін Qp есептейтін өрнек:
А) Qp = ∆G -T∆S
B) Qp = ∆U
C) Qp = ∆H +
D) Qp = p∆V
E) Qp = U + p∆V
20. Химиялық реакциялардың жылу эффектісін зерттейді:
А) термодинамика
В) биохимия
С) химиялық кинетика
D) термохимия +
Е) электрохимия
21. Эндотермиялық реакцияларда:
А) температура жоғарылағанда реакция жылдамдығы төмендейді
В) реакцияның энтальпиясы артады ( Н >O)+
С) реакцияның жылу эффектісі оң (Q>O)
D) тепе-теңдік орнау үшін катализатор қажет
Е) тепе-теңдік орнау үшін ингибитор қажет
22. Эндотермиялық реакцияларда:
А) Q < 0, DН > 0 +
В) Q < 0, DН < 0.
С) Q > 0, DH > 0
D) Q = 0, DH < 0
Е) Q > 0, DН = 0
23. Экзотермиялық реакцияларда
А) Q < 0, DН < 0
В) Q > 0, DH < 0 +
С) Q > 0, DH > 0
D) Q < 0, DН > 0
Е) Q = 0, DH > 0
24. «Стандарты жағдайда реакцияның жылу эффектісі сәйкес стеохиометриялық коэффициенттеріне көбейтілген өнімдердің түзілу жылуларының қосындысы мен бастапқы заттардың түзілу жылуларының қосындыларының айырымына тең» - бұл анықтама:
А) термодинамиканың бірінші заңы
В) Рауль заңы
С) Лавузье-Лаплас заңы
D) Гесс заңының бірінші салдары +
Е) термодинамиканың екінші заңы
25. Гесс заңының бірінші салдарының формуласы:
А) Qр = DН
В) DG = DH - TDS
С) DS = Qқайт-ды/T
D) DHpo = åDHoтүз.өнім – åDHo түз. бастапқы +
Е) DU = U2 – U1
26. Термодинамикалық жүйеде өтетін процестегі энтропиясы өзгермейтін реакция:
А) HCl + NH3 ® NH4Cl
В) C2H5OH + 3O2 ® 2CO2 + 3H2O
С) NI3NH3 ® N2 + ЗНI
D) H2 + Сl2 ® 2НСl +
Е) 2CO + O2 ® 2CO2
27. Термодинамикалық жүйеде өтетін процестегі энтропиясы артатын реакция:
А) 2N2O + 4O2 ® 2N2O5
В) 3Н2 + N2 ® 2NН3
С) 4НСl + O2 ® 2Сl2 + 2Н2O
D) N2 + О2 ® 2NO
Е) 2Н2O2 ® 2H2O + O2 +
28.Адам жататын термодинамикалық жүйе:
А) гомогенді ашық
В) гетерогенді жабық
С) гомогенді оқшау
D) гетерогенді ашық +
Е) гомогенді жабық
29. Гетерогенді термодинамикалық жүйе:
А) біртекті
В) бір ғана фазадан тұрады
С) фазалар аралығында бөліну беті болмайды
D) фазалар аралығында бөліну беті болады +
Е) әр нүктедегі қасиеттері бірдей
Химиялық реакциялардың кинетикасы
1. Химиялық кинетика зерттейді:
А) химиялық реакцияның жылдамдығы мен механизмін +
В) химиялық энергияның жылу энергиясына өзгеру заңдылықтарын
С) химиялық энергияның кинетикалық энергияға өзгеру заңдылықтарын
D) химиялық реакциялардың жылу эффектісін
Е) химиялық реакция кезінде ортаның рН-ының өзгеруін
2. Химиялық реакцияның жылдамдығы – бұл:
А) уақыт бірлігінде әрекеттесуші заттардың концентрациясының өзгеруі +
В) химиялық реакцияның элементарлық актысына қатынасатын молекулалар саны
С) ферменттің бір молекуласының әсерінен өзгеретін субстрат молекуласының саны
D) реакцияның кинетикалық теңдеуіндегі дәреже көрсеткіштерінің қосындысы
Е) уақыт бірлігінде катализатор концентрациясының өзгеруі
3. Гомогенді реакцияның жылдамдығы:
А) химиялық реакцияның элементарлық актісіне қатысатын молекулалар саны
В) бірлік көлемде уақыт бірлігінде әрекеттесетін молекулалар саны +
С) уақыт бірлігінде бірлік бет ауданындағы әрекеттесетін молекулалар саны
D) реакцияның кинетикалық теңдеуіндегі дәреже көрсеткіштерінің қосындысы
Е) бірлік уақыттағы катализатор концентрациясының өзгеруі
4. Химиялық реакцияның жылдамдық константасның температураға тәулділігін сандық түрде сипаттайды:
А) Вант-Гофф ережесі +
В) әрекеттесуші массалар заңы
С) Гиббс теңдеуі
D) Михаэлис-Ментен теңдеуі
Е) Гендерсон-Гассельбах теңдеуі
5. 2NO + O2 ↔2NO2 реакция жылдамдығының кинетикалық теңдеуі:
А) w = [NO]2 + [O2]
В) w = 2[NO][O2]
С) w = 2[NO2]2
D) w = k[NO][O2]
Е) w = k[NO]2[O2] +
6. 2NO + O2 ↔ 2NO2 кері реакция жылдамдығының кинетикалық теңдеуі:
А) w = [NO2]2
В) w = 2[NO2]
С) w = k[NO2]2 +
D) w = k[NO][O2]
Е) w = k[NO]2[O2]
7. A + B + B ® AB2 реакциясына сәйкес кинетикалық теңдеу:
А) w = k[B][B]
В) w = k[A][B]
С) w = k[A][B]2 +
D) w = k[AB2]
Е) w = k[A][B2]
8. Химиялық реакция жылдамдығының әрекеттесуші заттардың концентрациясына
тәуелділігін сандық түрде сипаттайды:
А) Вант-Гофф ережесі
В) әрекеттесуші массалар заңы +
С) Гиббс теңдеуі
D) Михаэлис-Ментен теңдеуі.
Е) Гендерсон-Гассельбах теңдеуі.
9. Ферменттердің каталитикалық әсерінің ерекшелігі:
А) өте төмен каталитикалық активтілік көрсетеді
В) каталитиклық әсердің температураға тәуелсіздігі
С) каталитиклық әсердің рН-қа тәуелсіздігі
D) жоғары таңдамалылық әсері +
Е) әсердің температуралық оптимумының болмауы
10. w = k*c2 кинетикалық теңдеуге сәйкес келетін реакция реті:
А) нөлдік
В) біріншілік
С) үшіншілік
D) екіншілік +
Е) бөлшектік
11. Біріншілік ретті реакцияның кинетикалық теңдеуі :
А) w = k
В) w = dc/ dt
С) w = k. C +
D) w =k. c2
Е) w =k. ca .cb
12.Ағзадағы биологиялық катализаторларды ... деп атайды:
А) аминоқышқылдар
В) полисахаридтер
С) липидтер
D) ферменттер +
Е) көмірсулар
13. Тірі ағзадағы ферменттердің функциясы :
А) оксигендерді тасымалдайды
В) биохимиялық реакцияларды тездетеді +
С) иммунитетті қалыптастырады
D) ағзаны энергиямен қамтамасыз етеді
Е) тіндер мен мүшелерге оттекті тасымалдайды
14. Гетерогенді реакциялардың жылдамдығы:
А) бірлік көлемде уақыт бірлігінде әрекеттесетін молекулалар саны
В) уақыт бірлігінде бірлік бет ауданындағы әрекеттесетін молекулалар саны +
С) химиялық реакцияның элементарлық актісіне қатысатын молекулалар саны
D) ферменттің бір молекуласының әсерінен өзгеретін субстрат молекуласының
Е) реакцияның кинетикалық теңдеуіндегі дәреже көрсеткіштерінің қосындысы саны
15. Реакцияның нағыз жылдамдығын өрнектейтін қатынас :
А) v = – (с2 – с1) / (τ2 – τ1)
В) v = Dс / Dτ
С) v = (с2 – с1) / (τ2 – τ1)
D) v = – Dс / Dτ
Е) v = ± dс / dτ +
16. Гомогенді реакцияның өлшем бірлігі:
А) моль / (л·.с) +
В) моль / (м2. с)
С) л / (моль. с)
D) м2/ (моль. с)
Е) моль / м2.
17. Кинетикалық теңдеуге W = kC(O2) сәйкес реакция:
А) 2C(т) + O2(г) ® 2CO(г) +
В) CO(г) + O2(г) ® 2CO2(г)
С) 2SO2(г) + O2(г) ® 2SO3(г)
D) N2(г) + O2(г) ® 2NO(г)
Е) O2(г) + 2H2(г) ® 2H2O(с)
18. Бимолекулалық реакцияны көрсетіңіз .
А) H2 + J2 ® 2HJ +
В) J2 ® 2J
С) H2 ® 2H
D) NH4Cl ® NH3 + HCl
Е) NH4CNS ® (NH2)2CS
19. "Температура әрбір 10 градусқа өскенде реакция жылдамдығы 2-4 есе артады"- бұл ереже:
А) Дюкло-Траубе
В) Вант-Гофф +
С) Шульце- Гарди
D) Панет-Фаянс
Е) Пригожин
20. Реакция жылдамдығына катализатордың әсері:
А) тура реакцияның жылдамдығын төмендетеді
В) кері реакцияның жылдамдығын төмендетеді
С) реакцияны активтендіру энергиясы төмен реакцияның бағытына бағыттайды +
D) актвтендіру энергиясы жоғары реакцияның бағытына бағыттайды
Е) тепе-теңдікті ығыстырады
21. Жүйенің қысымын 5 есе арттырғанда СаСО3(т) = СаО(т) + CO2(г) тура реакцияның жылдамдығы:
А) 5 есе өседі
В) 25 есе кемиді
С) 5 есе кемиді
D) 25 есе артады
Е) өзгермейді +
22. Тура реакция aA + bB « cC + dD үшін массалар әрекеттесуші заңының өрнегі:
А) w = k CA . CB
В) w = k (CAa + CBb)
С) w = k CAa . CBb +
D) w = k CCc . CDd
Е) w = k (CCc + СDd)
23. Молекулалығы үшке тең реакция:
А) H2 + J2 = 2HJ
В) J2 = 2J
С) 2NO + O2 = 2NO2 +
D) CO + Cl2 = COCl2
Е) Ca(HCO3)2 « H2O + CO2 + CaO
24. 2NO(г) + Cl2(г) ® 2NOCl(г) реакциясы үшін тепе-теңдік константасының өрнегі:
А) K = С2(NOCl) / С2(NO) . С(Cl2) +
В) K = С2(NO) . С(Cl2)
С) K = С2(NO) . С(Cl2) / С2(NOCl)
D) K = С2(NOCl) / С2(NO) + С(Cl2)
Е) K = C2(NO) + C(Cl2) / C2(NOCl)
25.Тура бағытта жүретін реакция CaCO3(қ) ® CO2(г) + CaO(қ) үшін әрекеттесуші массалар заңының өрнегі:
А) w = k С(CaCO3)
В) w = k С(CaO) . с(CO2)
С) w = k +
D) w = k С(CaO) + с(CO2))
Е) w = k С(CO2)
26. Реакцияның кинетикалық w = k CAa . CBb теңдеуіндегі дәреже көрсеткіштерінің қосындысы:
А) реакцияның молекулалығы
В) реакцияның элементарлық актысыне қатысатын молекулалар саны
С) реакция реті +
D) реакцияның жылдамдығы
Е) реакцияның жылдамдық константасы
27. Химиялық реакцияның элементарлық актысына қатысатын молекулалар саны:
А) реакцияның молекулалығы +
В) реакция реті
С) реакция жылдамдығы
D) реакцияның жылдамдық константасы
Е) реакцияның температуралық коэффициенті
28. Реакция жылдамдығының температураға тәуелділігін сандық түрде сипаттайды :
А) Лавуазье-Лаплас заңы
В) әрекеттесуші массалар заңы
С) Аррениус теңдеуі +
D) Михаэлис-Ментен теңдеуі
Е) Гендерсон-Гассельбах теңдеуі
29. Вант-Гофф ережесі бойынша реакциялық қоспаның температурасын 30 0С-тан 40 0С-қа көтергенде, реакция жылдамдығы:
А) 22,4 есе артады
В)10 есе кемиді
С) 2-4 есе артады +
D) ең үлкен мәніне жетеді
Е) 8 есе артады
30. Катализ құбылысы сипатталады:
А) химиялық реакцияның жүру процесіне катализатор жұмсалады
В) катализатор химиялық реакцияның тепе-теңдігіне әсер етпейді +
С) реакция аяақталғанда катализатор мөлшері 2 есе кемиді
D) катализатор тек тура реакцияның жылдамдығын арттырады
Е) катализатор тек кері реакцияның жылдамдығын төмендетеді
31. γ = (Kt + 10) / Кt теңдеуіндегі γ шамасы:
А) изотондық коэффициент
В) координациялық сан
С) реакция жылдамдылығының температуралық коэффициенті +
D) эквиваленттік фактор
Е) иондану дәрежесі
36. Температура жоғарылағанда:
А) экзотермиялық реакцияның жылдамдығы артады, ал эндотермиялықтікі – кемиді.
В) Экзотермиялық реакцияның жылдамдығы кемиді, ал ал эндотермиялықтікі – артады +
С) экзотермиялық та, эндотермиялық та реакцияның жылдамдықтары өзгермейді
D) экзотермиялық та, эндотермиялық та реакцияның жылдамдықтары артады
Е) экзотермиялық та, эндотермиялық та реакцияның жылдамдықтары кемиді
Ерітінділер
Концентрация
1. Берілген қышқылдық-негіздік реакцияларда бір сутек ионына, тотығу-тотықсыздану реакцияларында бір электронға эквивалентті болатын Х затының шартты немесе шын бөлігін атайды:
А) эквивалент +
В) эквиваленттік фактор
С) эквиваленттің молярлық концентрациясы
D) зат эквивалентінің зат мөлшері
Е) мольдік үлес
2. Берілген қышқылдық-негіздік реакцияларда бір сутек ионына немесе берілген тотығу-тотықсыздану реакцияларында бір электронға Х затының қандай бөлігі эквивалентті болатындығын көрсететін сан:
А) эквивалент
В) эквиваленттік фактор +
С) эквиваленттің молярлық концентрациясы
D) зат эквивалентінің зат мөлшері
Е) мольдік үлес
3. Эквиваленттік факторды белгілейді:
А)
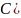
В)

С)

D)
 +
+
Е)

4. Алюминий сульфатының эквиваленттінің молярлық концентрациясының белгіленyі:
А)
В)
( +
+
С)
 (
(
D)

Е)
5.
 қатынысымен есептейді:
қатынысымен есептейді:
А) қышқылдың эквиваленттік факторын
В) негіздің эквиваленттік факторын
С) тұздың эквиваленттік факторын
D) оксидтердің эквиваленттік факторын
Е) тотығу-тотықсыздану реакциясына қатысқан заттың эквиваленттік факторын +
6.
 қатынысымен есептейді:
қатынысымен есептейді:
А) қышқылдың эквиваленттік факторын +
В) негіздің эквиваленттік факторын
С) тұздың эквиваленттік факторын
D) оксидтердің эквиваленттік факторын
Е) тотығу-тотықсыздану реакциясына қатысқан заттың эквиваленттік факторын
7.
 қатынысымен есептейді:
қатынысымен есептейді:
А) қышқылдың эквиваленттік факторын
В) негіздің эквиваленттік факторын +
С) тұздың эквиваленттік факторын
D) оксидтердің эквиваленттік факторын
Е) тотығу-тотықсыздану реакциясына қатысқан заттың эквиваленттік факторын
8.
 қатынысымен есептейді:
қатынысымен есептейді:
А) қышқылдың эквиваленттік факторын
В) негіздің эквиваленттік факторын
С) тұздың эквиваленттік факторын +
D) қышқылдық-негіздік реакциясына қатысқан заттың эквиваленттік факторын
Е) тотығу-тотықсыздану реакциясына қатысқан заттың эквиваленттік факторын
9. Моль/кг – өлшем бірлігімен өлшенеді:
А) моляльдық концентрация +
В) молярлық концентрация
С) эквиваленттің молярлық концентрация
Д) массалық үлес
Е) мольдік үлес
10. Моль/л - өлшем бірлігімен өлшенеді:
А) мольдік үлес
В) молярлық концентрация +
С) моляльдық концентрациия
Д) массалық үлес
Е) мольдік үлес
11. Молярлық массасы 74 г/моль Ca(OH)2 эквивалентінің молярлық массасы (г/моль):
А) 74
В) 60
С) 40
D) 37 +
Е) 34
12. Молярлық массасы 136 г/моль CaSO4 эквивалентінің молярлық массасы (г/моль):
А) 272
В) 136
С) 96
D) 68 +
Е) 40
13. Молярлық массасы 40 г/моль NaOH эквивалентінің молярлық массасы (г/моль):
А) 120
В) 80
С) 40 +
D) 20
Е) 10
14. Эквивалентінің молярлық массасы 26 г/моль Al(OH)3 молярлық массасы (г/моль):
А) 130
В) 78 +
С) 39
D) 26
Е) 13
15. Эквиваленттік факторы f э = 1 тең қосылыс:
А) Na2SO4
В) NaNO3 +
С) CaCI2
D) Na2CO3
E) Na3PO4
16. Эквиваленттік факторы f э = 1/2 тең қосылыс:
А) Na2SO4 +
В) NaNO3
С) NaCI
D) NaBr
E) Na3PO4
17. Эквиваленттік факторы f э = 1/3 тең қосылыс:
А) Na2CO3
В) Na3PO4 +
С) NaNO3
D) Ca(OH)2
Е) Al2(SO4)3
18. Эквиваленттік факторы f э = 1/6 тең қосылыс:
A) Al(OH)3
В) Na3PO4
C) Al2(SO4)3 +
D) CaCI2
E) Mg(NO3)2
19. Эквиваленттік факторлары бірдей қосылыстар орналасқан қатар:
А) KCI, Ca(OH)2, H2SO4
B) Al(OH)3,H2CO3, NaBr
C) AlJ3, Fe(OH)3,CrCI3 +
D) Cr(OH)3, FeSO4, HCI
E) KCI, Al(OH)3, FeSO4
20. Моль/кг - өлшем бірлігімен өлшенеді:
А) эквиваленттің молярлық массасысы
В) молярлық концентрация
С) моляльдық концентрация +
D) массалық үлес
Е) мольдік үлес
21. Моль/л - өлшем бірлігімен өлшенеді:
А) молярлық масса
В) молярлық концентрация +
С) массалық үлес
D) массалық концентрациясы
Е) мольдік үлес
22. Еріген заттың массалық үлесінің өлшем бірлігі:
А) моль/л
В) г/мл
С) % +
D) кг
Е) моль/кг
23. Еріген зат массасының ерітіндінің жалпы массасына қатынасы:
А) моляльдық концентрациия.
В) молярлық концентрация
С) массалық үлес +
D) эквиваленттің молярлық концентрациясы
Е) мольдік үлес
24. Еріген заттың зат мөлшерінің ерітінді көлеміне қатынасы:
А) молярлық концентрациия +
В) моляльдық концентрация
С) эквиваленттің молярлық концентрациясы
D) массалық үлес
Е) мольдік үлес
25. Еріген заттың зат эквиваленті мөлшерінің ерітінді көлеміне қатынасы:
А) молярлық концентрациия
В) эквиваленттің молярлық концентрациясы +
С) моляльдық концентрация
D) массалық үлес
Е) мольдік үлес
26. Еріген заттың зат мөлшерінің еріткіш массасына қатынасы:
А) молярлық концентрациия
В) мольдік үлес
С) эквиваленттің молярлық концентрациясы
D) массалық үлес
Е) моляльдық концентрация +
27. Молярлық концентрацияны есептейтін теңдік:
А)

В)

С)
 +
+
D)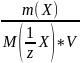
Е)

28. Эквиваленттің молярлық концентрациясын есептейтін теңдік:
А)
В)
С) +
D)

Е)
29. Эквиваленттің молярлық концентрациясын есептейтін теңдік:
А)
В)
С)
D)
Е)
 +
+
30. Еріген заттың массалық үлесін есептейтін теңдік:
А)
В)
С)
D) +
Е)
31. 100г ерітіндідегі еріген заттың массасын көрсететін концентрация:
А) молярлы концентрация
В) массалық үлес +
С) массалық концентрация
D) мольдік үлес
Е) моляльды концентрация
32. Көлемі 1 литр ерітіндідегі еріген заттың зат мөлшерін сипаттайтын концентрация:
А) молярлы концентрация +
В) массалық үлес
С) массалық концентрация
D) мольдік үлес
Е) молялды концентрация
33. Көлемі 1 литр ерітіндідегі еріген заттың затэквиваленті мөлшерін сипаттайтын концентрация:
А) молярлы концентрация
В) массалық үлес
С) эквиваленттің молярлы концентрациясы +
D) мольдік үлес
Е) молялды концентрация
34. Еріген заттың зат мөлшерінің еріткіш массасына қатынасын сипаттайтын концентрация:
А) молярлы концентрация
В) массалық үлес
С) массалық концентрация
D) мольдік үлес
Е) молялды концентрация +
35. Көлемі 1 литр ерітіндіде 3,65 г HCl ерітілген. Ерітіндінің молярлы концентрациясы (моль/л):
А) 1,0
В) 0,5
С) 0,1 +
D) 0,05
Е) 0,01
36. Көлемі 1 литр ерітіндіде 4,00 г NaOH ерітілген. Ерітіндінің молярлы концентрациясы (моль/л):
А) 0,0010
В) 0,00010
С) 0,10 +
D) 0,050
Е) 0,005
37. Массасы 182 г суда 0,1 моль глюкоза ерітілген. Ерітіндідегі глюкозаның массалық үлесі:
А) 0,09 +
В) 0,98
С) 18,0 %
D) 0,5 моль/л
Е) 9,0 %
38. Эквиваленттер заңының математикалық өрнегі:
А)

В)
 +
+
С)

D)

Е)

39. Эквиваленттер заңы салдарының математикалық өрнегі:
А)
 +
+
B)

C)
D)
Е)
40. қатынасы бойынша есептейді:
А) еріген заттың массалық үлесін
В) эквиваленттің молярлық концентрациясын
С) молярлық концентрацияны +
D) моляльдық концентрацияны
Е) молдік үлесті
41. қатынасы бойынша есептейді:
А) еріген заттың массалық үлесін
В) эквиваленттің молярлық концентрациясын +
С) молярлық концентрацияны
D) моляльдық концентрацияны
Е) молдік үлесті
42.
 қатынасы бойынша есептейді:
қатынасы бойынша есептейді:
А) еріген заттың массалық үлесін +
В) эквиваленттің молярлық концентрациясын
С) молярлық концентрацияны
D) моляльдық концентрацияны
Е) молдік үлесті
43.
 қатынасы бойынша есептейді:
қатынасы бойынша есептейді:
А) еріген заттың массалық үлесін
В) эквиваленттің молярлық концентрациясын
С) молярлық концентрацияны
D) моляльдық концентрацияны +
Е) молдік үлесті
44.
Эквивалентінің молярлық концентрациясы
оның молярлық концентрациясына тең
қосылыс
 :
:
A) HCl +
B) Na2СO3
C) К2SO4
D) Са(NO3)2
E) H3PO4
45.
Эквивалентінің молярлық концентрациясы
оның молярлық концентрациясынан үлкен
қосылыс (
 ):
):
A) HCl
B) NaCl
C) NaOH
D) KNO3
E) H3PO4 +
Коллигативтік қасиеттер
1. Қан плазмасына гипертонды болатын ерітінді:
А) 0,1 % NaCl-нің ерітіндісі
В) 10,0 % NaCl-нің ерітіндісі +
С) 0,15М NaCl-ді ерітіндісі
D) 0,9 % NaCl-нің ерітіндісі
Е) 0,01М NaCl-ді ерітіндісі
2. Қан плазмасына изотонды болатын ерітінді:
А) 1,0 М NaCl-нің ерітіндісі
В) 10,0 % NaCl-нің ерітіндісі
С) 0,1% М NaCl-ді ерітіндісі
D) 0,9 % NaCl-нің ерітіндісі +
Е) 0,01 М NaCl-ді ерітіндісі
3. Қан плазмасына гипотонды болатын ерітінді:
А) 1,0 М NaCl-нің ерітіндісі
В) 10,0 % NaCl-нің ерітіндісі
С) 0,15 М NaCl-ді ерітіндісі
D) 0,9 % NaCl-нің ерітіндісі
Е) 0,01 % NaCl-ді ерітіндісі +
4.Ағзаның осмостық қысым әсерінен белгілі бір пішін және иілгіштігін сақтауын қамтамасыз ететін жасушаның серпімділігі:
А) лизис
В) тургор +
С) гемолиз
D) плазмолиз
Е) деплазмолиз
5. Гипотонды ерітіндідегі жасушаның ісініп, содан соң жарылу құбылысы:
А) диализ
В) тургор
С) гемолиз +
D) плазмолиз
Е) деплазмолиз
6. Гипертонды ерітіндідегі жасушаның жиырылу құбылысы:
А) гемолиз
В) тургор
С) диализ
D) плазмолиз+
Е) деплазмолиз
7. Қан тамырына егу үшін қолданатын ерітінді:
А) аса қаныққан
В) гипертонды
С) изотонды +
D) гипотонды
Е) қаныққан
8. Вант-Гофф заңы бойынша ерітінді концентрациясы тәуелді:
А) еріткіштің ерітінді бетіндегі қаныққан бу қысымының өзгеруіне
В) ерітіндінің қату температурасының төмендеуіне
С) ерітіндінің қайнау температурасының жоғарылауына
D) ерітіндінің осмостық қысымына +
Е) диффузия құбылысына
9. Рауль заңының математикалық өрнегі:
А)
 +
+
В) PV = CRT
С) C1V1 = C2V2
D) π = CRT
Е)
c =

10. Ерітінділердің коллигативті қасиеттеріне жатпайды:
А) ерітінді бетіндегі еріткіштің қаныққан бу қысымы
В) ерітіндінің қайнау температурасының жоғарылауы
С) ерітіндінің қату температурасының төмендеуі
D) ерітіндінің осмостық қысымы.
Е) ерітіндінің молялды концентрациясы +
11. Ерітіндіде жоғары молекулалық қосылыстардың болуынан туындайтын осмостық қысымның бір бөлігі:
А) ерітінді бетіндегі еріткіштің қаныққан бу қысымы
В) онкотикалық қысым +
С) осмостық қысым
D) ерітіндіні изотондау
Е) тургор
12. Осмостық қысымы стандартпен салыстырғанда жоғары ерітінді:
А) гипертонды +
В) гипотонды
С) изотонды
D) физиологиялық
Е) қаныққан
13. NaCl-ның 10,0 % ерітіндісіндегі эритроцитте байқалатын құбылыс:
А) гемолиз
В) плазмолиз +
С) деплазмолиз
D) тепе-теңдік жағдай
Е) эндоосмос
14. NaCl-ның 0,1% ерітіндісіндегі эритроцитте байқалатын құбылыс:
А) гемолиз +
В) плазмолиз
С) диализ
D) тепе-теңдік жағдай
Е) экзосмос
15. Молярлы концентрациялары бірдей ерітінділерде бөлшек сандары тең болатын ерітінді түзетін қосылыстар:
А) Na2SO4 және NaCI
B) КCI және NaBr +
C) NaBr және K2SO4
D) NaCI және K2SO4
E) Na2CO3 және Na3PO4
16. Тамақ өнеркәсінде жиі пайданылатын ас содасының формуласы:
А) С6Н12О6
В) NаCI
C) KNO3
D) NaHCO3 +
E) Na2CO3
