
- •Вміст водорозчинного Al2o3 розраховували за формулою, %:
- •Вміст вільної h2so4 розраховували за формулою, %:
- •4.1 Термодинамічний аналіз можливості перебігу процесу сульфатизації каолінової сировини
- •7.2 Розрахунок вартості електроенергії малотоннажного підприємства
- •7.3 Зведена калькуляція випуску продукції
- •Список використаних джерел
ВСТУП
У наш час розповсюдженим методом знешкодження рідкофазних викидів є прояснення із застосуванням коагулянтів і флокулянтів з очищенням стоків до умов спуска у водойми або до вимог оборотного водопостачання. В якості відповідних реагентів використовуються солі алюмінію або заліза і складні органічні речовини – флокулянти.
Існуючі технології прояснення води орієнтовані, як правило, на дозування реагентів у рідкому вигляді. Однак при цьому осад коагуляції нерідко утворюється в недостатньо кондиційованому вигляді (наприклад, з незадовільними фільтраційними характеристиками), а для реалізації процесів коагуляційного знешкодження забруднених вод потрібне створення складного реагентного і технічного господарства, власне кажучи, – додаткового виробництва з технологічними засобами збереження, перекачування, дозування рідких коагулянтів, усереднення, коректування кислотності стічних вод і т. п. Якоюсь мірою це представляється виправданим при обробці крупнотоннажних стічних вод, а також для тих водоохоронних систем, у яких паралельно проясненню реалізується нейтралізаційно-осаджувальне виділення токсичних розчинних інгредієнтів стоків. В умовах же нерегулярних чи малотоннажних стоків, особливо на нехімічних підприємствах, проведення очищення стічних вод за приведеною схемою стає надто економічно обтяжливим.
Реалізація же прояснення стічних вод з використанням порошкоподібних реагентів (бажано ще й з флокулюючими і сорбційними властивостями) не вимагає виконання операцій, пов'язаних з приготуванням і дозуванням освітлюючих розчинів, додатковою флокуляційною обробкою води і з вимушеною багатостадійною фільтрацією осаду.
Особливий інтерес з екологічної точки зору в плані недорогих процесів кондиціонування промислових стічних вод може представляти одержання коагулянтів на основі неочищеного сульфату алюмінію, що в сукупності майже на порядок здешевить витрати як на реагенти, так і на процеси очищення забруднених малотоннажних водних систем у порівнянні з існуючими у світовій практиці методами і технологіями.
Актуальність теми. Погіршення екологічного стану в країні є однією із найнебезпечніших національних загроз сталому розвитку України. Чи не насамперед це стосується положенню справ із природною водою. Серед інших чинників суттєву частку в постійне її забруднення вносять численні підприємства з малотоннажним (10 - 500 м3 за добу) скиданням і утворенням стічних вод. Ці води (чи, точніше, вже рідкі системи), відповідно санітарно-гігієнічним вимогам, не можуть бути без попередньої обробки спрямовані в міську каналізацію або безпосередньо в природні водоймища (але іноді так і робиться).
Незважаючи на те, що якісний та кількісний склад полютантів у таких рідких стоках дуже різноманітний, ці стічні води мають загальні ознаки, а саме:
стічні води мають невеликий добовий об'єм (дебіт) і їхній викид є нерегулярним;
майже всі домішки за класичною фазово-дисперсною ознакою відносяться до І-ІІІ груп (переважно І-ІІ), себто вміщують абразивні частинки, нафтопродукти, біогенні речовини, технічні мастила, поверхнево-активні речовини (ПАР), йони важких металів, фтору, заліза і, в умовах України, радіонукліди.
Перелічені обставини роблять економічно недоцільним та практично неможливим використання громіздких стаціонарних технологій коагуляційного, сорбційного та іншого очищення стоків з застосуванням традиційних рідких коагулянтів, що застосовуються для підприємств з регулярним скидом великих об'ємів стічних вод досить постійного складу.
Вирішити проблему можна за рахунок кардинального спрощення технології та обладнання операцій прояснення та максимального очищення таких стоків, що може бути досягнуто при застосуванні комбінованих сумішей широкого діапазону порошкоподібних (або гранульованих) реагентів – неорганічних флококоагулянтів-сорбентів. Очищення малотоннажних стічних вод у цьому випадку не буде економічно обтяжливим, тому що ці операції можуть бути періодичними, немає потреби в складному обладнанні, а склади реагентів легко адаптуються до стічних вод різноманітного походження.
Оскільки світових і вітчизняних аналогів композиційного коагулянту з не відділеною активною силікатною кислотою майже немає, науковою проблемою є розробка теоретичних основ їхнього синтезу (одержання) і обґрунтування відповідних засад для наступної технології виробництва і застосування.
Зв’язок роботи з науковими програмами, планами, темами. Роботу виконано на кафедрі технології неорганічних речовин та загальної хімічної технології Національного технічного університету України «Київський політехнічний інститут» за пріоритетним напрямком «Про пріоритетні напрями розвитку науки і техніки» у відповідності до Державних Програм України, що стосуються охорони навколишнього природного середовища (Закон Украни „Про пріоритетні напрями розвитку науки і техніки” №2623-ІІІ від 11.07.2001р. і №2519-VIвід 09.09.2010р.) в рамках державних науково-дослідних тем Міністерства освіти і науки України №2032-п «Фізико-хімічні закономірності комплексної обробки і кондиціювання забрудненої води і утилізації відходів водоочищення» (01.01.2007 – 31.12.2009 рр., № державної реєстрації 0107U002381, КВНТД І.2 15.17.21, УДК 6.61.632:658.691 ), № 2815ф «Розробка фундаментальних основ видалення важких металів з водних систем за допомогою полімерних реагентів комплексної дії» (01.01.2005 – 31.12.2008 рр., № державної реєстрації 0105U000998, КВНТД І.1 02.00.13, УДК 6.61.632:658.691:541.127), № 2361- п „Розробка новітньої ресурсозберігаючої технології утилізації токсичних компонентів осадів водоочищення” (01.01.2010-31.12.2011, № державної реєстрації 0110U002210 КВНТД 1.2 15.17.21 УДК 543:628.3:628.543) та державної науково-дослідної теми Міністерства промислової політики України № 1–179–08 «Розробка та впровадження комплексної технології очищення стічних вод текстильних виробництв з утилізацією складових осадів водоочищення» (01.11.2008 – 31.12.2009 рр., № державної реєстрації 0108U010342).
Мета і завдання дослідження. Мета роботи полягає в створенні наукових засад синтезу та використання нового класу ефективних порошкових флококоагулянтів з сорбційною активністю на основі вітчизняної позабалансової природної (каолінової) сировини ( низькоякісної нативної каолінової глини Просянівського та Веселовського українських родовищ).
Основними завданнями роботи є:
розробка теоретичних та технологічних засад одержання (синтезу) порошкових (та гранульованих) коагулянтів на основі неочищеного алюміній сульфату з невідокремленим сіліцієм (сіліцій (IV) оксидом) як джерела активної кремнекислоти в якості флокулянту;
дослідження умов, хімічного, термодинамічного і кінетичного перебігу процесів при сульфатизації каолінової сировини; складання математичної моделі цих процесів;
дослідження флококоагулянтів-сорбентів на модельних і реальних забруднених водах (в т.ч., ґрунтових) з високою кольоровістю, мутністю, окисненістю (себто з вмістом органічних і нафтохімічних домішок), з вмістом важких металів, фтору, заліза, радіонуклідів та інших ксенобіотиків (виявлення оптимальних доз реагентів, вимір ізотерм адсорбції, граничній адсорбції за типами забруднювачів води тощо);
узагальнення теоретичних засад досліджених процесів з метою обґрунтування технологічних основ синтезу та застосування нового класу твердих флококоагулянтів-сорбентів широкої гами дії.
Проведення напівпромислової оцінки як технології одержання цільового реагенту з глинистої сировини, так і його ефективності на реальних промислових стоках;
Розрахунок економічної доцільності виробництва і застосування реагенту у порівнянні з відомими алюміній вмісними коагулянтами.
Методи дослідження. Дисертаційна робота проводилася з використанням нижчевказаних експериментальних методів дослідження:
для ідентифікації вихідної сировини та цільового продукту:
рентгеноструктурний аналіз;
ІЧ-спектроскопія;
термогравіметричний аналіз;
мікроскопія;
рентгеноскопічний аналіз
для встановлення складу вихідної сировини та цільового продукту:
гравіметричний аналіз;
титриметричний аналіз;
фотометричний аналіз;
рентгенофлюорисцентний та рентгеноструктурний аналіз.
для встановлення складу природних та стічних вод до та після процесу очищення:
титриметричний аналіз;
фотометричний аналіз.
рН-метричний метод аналізу.
Наукова новизна одержаних результатів. Показана можливість використання низькоякісних нативних каолінових глин українських родовищ для одержання реагенту комплекної дії на основі неочищеного алюміній сульфатуз домішками активної силікатної кислоти. Науково обгрунтована можливість переробки низькоякісних нативних каолінових глин методом сульфатнокислотного спікання без проведення попереднього високотемпературного випалу каолінової сировини з отримання композитних коагулянтів. Обґрунтовано і доведено механізм взаємодії каолініту з сульфатною кислотою та розраховані основні кінетичні параметри процесу. Показано, що процес сульфатизації здійснюється у дві стадії і для кожної з них отримано кінетичні рівняння, які адекватно описують процес.
Обґрунтованість і достовірність наукових положень, висновків і рекомендацій. Наукові положення, сформульовані у дисертації, є добре обґрунтованими. Кожний пункт наукової новизни роботи підтверджено численними експериментальними дослідженнями із застосуванням сучасних фізико-хімічних методів. Отримані наукові результати пройшли перевірку у напівпромислових умовах.
Наукове значення роботи. Наукова ідея, що покладено в основу роботи, полягає у наступному.
Традиційні технології водопідготовки та очищення стічних побутових та промислових вод складаються з послідовних дискретних операцій прояснення, знезараження, адсорбції, йонного обміну тощо. При цьому на кожній окремій стадії з відповідним обладнанням застосовується специфічні реактанти - коагулянти (в рідкому стані), флокулянти, хлор або озон, йонообмінні смоли, активовані вугільні або інші сорбенти, біореагенти тощо. Як свідчить практика, це виправдовує себе при регулярному стоці або надходженні стабільних об'ємів природної води і при наявності складного і громіздкого стаціонарного обладнання.
Як вже відмічено вище, це важко і економічно обтяжливо реалізувати при малотоннажному, нерегулярному стоці забруднених вод нестабільного різноманітного складу. Тому виглядає раціональним, економічно і технологічно обґрунтованим поєднання у складі одного синтетичного реагенту властивостей здійснення більшості перелічених операцій в одному апараті з фільтраційним або осадовим пристроєм. При цьому бажано, щоб цей реагент можливо було виготовляти з широким діапазоном складу для легкої адаптації до локальних умов його застосування при специфічних і змінних у часі стоках та видах забруднених вод.
Саме цю ідею покладено в основу роботи. Фактом є те, що поєднання алюмовмісного коагулянту з активною кремнекислотою надає першому ще й флокуляційних властивостей. Попередніми дослідами встановлено, що таку композицію реально синтезувати з низькоякісної алюмосилікатної сировини, якої багато в Україні і яка зараз не використовується, складується і забруднює довкілля. Пошукові дослідження показали, що можливо навіть емпірично синтезованими (себто, поки-що неоптимального складу) флококоагулянтами-сорбентами досить ефективно прояснювати воду, вилучати з неї до 80-85 % домішок І-ІІ групи, а осад після знешкодження домішок швидко відокремлювати від очищеної води.
Виходячи з аналізу світової та вітчизняної наукової і науково-технічної інформації, ці питання майже не досліджено і науковий підхід у їхньому вирішенні - відсутній.
Практичне значення отриманих результатів. У результаті проведених досліджень розроблено технологічні засади одержання нового порошкоподібного реагенту (типу флококоагулянту-сорбенту). Технология пройшла напівпромислову перевірку на обладнанні ВАТ „Шосткинський завод хімічних реактивів”. Доведено можливість виробництва неочищеного коагулянту з каолінових глин шляхом сульфатнокислотного спікання. Відносно просте апаратурне оформлення технології та доступність сировинних баз робить можливим упровадження розробленого методу виробництва на багатьох підприємствах (навіть неглиноземного профілю) та широке застосування пропонованих реагентів у практиці водоочищення.
Особистий внесок здобувача. Особистий внесок полягає у цілеспрямованому виконанні досліджень як в експериментальному, так і в аналітичному плані (підбір й аналіз літературних та науково-технічних джерел, аналіз отриманих результатів). Постановка задач, обговорення результатів дослідження та формулювання висновків проводилися спільно з науковим керівником д. т. н. Астреліним І.М. та науковим консультантом к. т. н. Толстопаловою Н.М.
Апробація результатів дисертації. Матеріали дисертаційної роботи було докладено та обговорено на наступних конференціях. на I Всеукраїнській науково-практичній конференції аспірантів та молодих вчених (м. Київ, Україна, 2006 р.), Х Міжнародній науково-практичній конференції студентів, аспірантів та молодих вчених “Екологія. Людина. Суспільство” (м. Київ, Україна, 2007 р.), IІ Всеукраїнському з’їзді екологів (м. Вінниця, Україна, 2008 р.), Міжнародній науково-технічній конференції “Техника и технология защиты окружающей среды” (м. Мінськ, Республіка Білорусь, 2006 р.), IIІ Всеукраїнській науково-практичній конференції аспірантів та молодих вчених (м. Київ, Україна, 2008 р.); ХІ Міжнародній науково-практичній конференції студентів, аспірантів та молодих вчених “Екологія. Людина. Суспільство” (м. Київ, Україна, 2009 р.), ХIІ Міжнародній науково-практичній конференції студентів, аспірантів та молодих вчених “Екологія. Людина. Суспільство” (м. Київ, Україна, 2009 р.).
Публікації. За результатами виконаних досліджень опубліковано 5 статтей та 19 тези доповідей і держано 1 патент України.
Структура дисертації. Дисертація складається з вступу, 7 розділів, висновків, списку використаних джерел та додатків. Роботу викладено на 136 сторінках машинописного тексту (31 рисунків, 19 таблиць і 1 додатків). Список джерел включає 90 найменування.
РОЗДІЛ 1
СУЧАСНИЙ СТАН ПРОБЛЕМИ ОДЕРЖАННЯ І ЗАСТОСУВАННЯ КОАГУЛЯНТІВ
Кислотні способи переробки алюмовмісної сировини з метою отримання коагулянту – алюміній сульфату.
У практиці водопідготовки для коагуляційного очищення природних і стічних вод від завислих і колоїдних домішок найчастіше використовують солі алюмінію, особливо алюмінію сульфат [1 – 7]. Для отримання цього реагенту останнього часу дуже широко застосовуються методи кислотного розкладання різноманітних природних алюмовмісних руд [1, 8 – 10], що дозволяє використовувати низькоякісну, непридатну для видобутку глинозему у великих промислових масштабах сировину. Для розкладання низькосортних алюмінієвих руд можуть застосовуватися майже усі мінеральні кислоти. У багатьох роботах пропонується використовувати сульфатну [8, 11], соляну [11 – 14], нітратну [15, 16], фтористоводневу [11] та інші кислоти. З усіх цих кислот доцільніше застосовувати сульфатну кислоту як більш дешеву та менш корозійноактивну.
Однією з проблем при виробництві алюмінію сульфату сульфатнокислотними методами з висококремнистої сировини, що містить до 79 % кремній (IV) оксиду [1], є складність розділення сульфатного розчину та кремнеземистого шламу і подальше відмивання останнього від залишків вищезгаданого розчину. У той же час виробництво неочищеного алюміній сульфату дозволяє уникнути цих труднощів. При цьому в отриманому продукті зростає вміст нерозчинного залишку, що призводить до відповідного зменшення вмісту цільового компоненту (алюмінію сульфату), проте, з іншого боку, не відділений силіцій у подальшому може служити джерелом активної силікатної кислоти (H2SiO3, SiO2 ·H2O), що широко застосовується у практиці очищення стічних вод в якості флокулянту [1, 3, 17 – 19]. Виробництво подібного коагулянту є досить простим у технологічному і технічному оформленні і може бути організоване за нескладною схемою та на стандартному обладнанні не тільки на будь-яких хімічних, а й навіть на нехімічних підприємствах, у тому числі і для власних потреб.
Останнього часу отримання алюмінію сульфату та коагулянтів на його основі у промисловості здійснюється шляхом розкладання різних видів сировини: алюмінію гідроксиду, нефелінів, алунітів, бокситів, каолінів та алюмовмісних шламів і відходів підприємств з виробництва глинозему тощо.
Виробництво алюмінію сульфату з алюмінію гідроксиду
Сучасне виробництво очищеного сульфатнокислого алюмінію засноване, головним чином, на використанні в якості сировини алюмінію гідроксиду, який отримують з алюмінієвих руд лужним способом Байєра [1,8].
Виробництво алюміній сульфату з його гідроксиду складається з двох основних технологічних стадій – розкладання гідроксиду сульфатною кислотою та кристалізації продукту, що утворюється [20]. Сутність першої стадії – у змішуванні пульпи алюмінію гідроксиду з сульфатною кислотою (60 – 65 %) і подальшій їх взаємодії протягом 0,3 – 2 год з утворенням цільового продукту. Температура реакції (105 ÷ 120 C) підтримується гострою парою. На наступній стадії реакційна маса із вмістом водорозчинного Al2O3 14,5 – 15,5 % охолоджується у реакторі до 95 C та кристалізується на столах або у барабанних кристалізаторах.
Перевага цього методу отримання коагулянту – у відносній простоті оформлення технологічного процесу та у високій чистоті продукту. Основний недолік – висока вартість та дефіцитність вихідної сировини –алюмінію гідроксиду, що виробляється з дорогих високоякісних бокситів закордонних родовищ (Гвінея тощо).
Виробництво алюмінію сульфату з нефелінів
Нефеліни – гірські породи, в яких одним з основних породоутворюючих мінералів є нефелін (Na, K)[AlSiO4], що входить до складу нефелінових сієнітів, фенолітів, уртитів, нефелінових базальтів. Як хімічну сировину використовують нефеліновий концентрат, який отримують з апатито-нефелінових руд [21].
За цим способом алюмінію сульфат утворюється у вигляді суміші алюмінієвих галунів у натрієвій та калієвій формах – (Na, K)Al(SO4)212 H2O. Важлива перевага цього процесу – легкість розкладання нефеліну сульфатною кислотою. Реакція відбувається бурхливо, з виділенням великої кількості теплоти. Так, при взаємодії нефеліну з кислотою концентрації 40 – 50 % температура реакційної маси сягає 75 – 90 C, а при збільшенні концентрації до 75 % – до 140 – 150 C [1]. При цьому можливе утворення галунів з меншою кількістю молекул кристалізаційної води або навіть повністю безводних. Взаємодія нефеліну з сульфатною кислотою вказаних вище концентрацій перебігає з великою швидкістю і практично закінчується за 1 – 3 хв.
Технологічний процес може бути оформлений декількома способами [8, 22 – 24]. Вони відрізняються, у принципі, лише умовами дозрівання готового продукту (тривалість дозрівання змінюється від 1 год до 2 – 4 діб або виробництво реалізується за повної відсутності даної стадії). Звісно, надтривалий термін дозрівання суттєво зменшує привабливість технології. В залежності від способу концентрація кислоти може змінюватись у межах від 35 до 73 %. Ступінь розкладання концентрату може досягати 85 – 95 %.
Недоліком цього процесу, поряд з відміченими вище, є й невисока якість продукту (за вмістом для рідкого коагулянту Al2O3 та нерозчинного залишку), оскільки утворюється він у неочищеному вигляді. Головним же є те, що використовується досить якісна і недешева алюмовмісна сировина, поклади якої промислового значення відсутні в Україні.
1.1.3 Виробництво алюміній сульфату з промислових відходів
В якості сировини для виробництва алюмінію сульфату можуть використовуватись також золи після згоряння деяких видів вугілля, тобто мінеральна частина вугілля, багата на глинозем (іноді вміст Al2O3 у такій золі може досягати 35 % [8]), енергошлаки теплових станцій, металургійні шлаки, тощо [25 – 28].
Розкладання мінеральної частини вугілля можна реалізувати тільки після попереднього випалу (500 – 1200 C протягом 2 – 5 год). Власне кислотне розкладання перебігає за температури 90 – 95 C протягом 1,5 год з використанням сульфатної кислоти концентрацією від 10 до 40 % (доза кислоти – 90 % від стехіометрії). Ступінь вилучення алюміній оксиду при цьому може становити 60 – 80 % [29 – 33].
Пропонується також спосіб переробки алюмовмісних шламів шляхом вилуговування їх сульфатною кислотою за температури 50 – 115 C протягом 60 – 200 хв. Концентрація кислоти, що використовується у даному процесі, становить 24 – 27 %, а доза її на розкладання – 87 – 89 % від стехіометричної (відношення Р : Т у пульпі при цьому дорівнює 5). При виробництві сульфату алюмінію за цим способом ступінь вилучення алюмінію у розчин може досягати 75 – 95 % (у перерахунку на оксид алюмінію) [34, 35].
Повідомляється про дослідження з технології виробництва коагулянтів з білого шламу (натрієвого алюмосилікату) глиноземних заводів [36]. Запропоновано два варіанти технології. За першим варіантом для отримання твердого коагулянту пульпа білого шламу в промивній воді змішується з концентрованою сульфатною кислотою. У результаті екзотермічних процесів і розкладання білого шламу після остигання утворюється тверда сульфатна маса – коагулянт для очищення висококаламутних природних вод. За другим варіантом для очищення стічних вод білий шлам на місці споживання пропонується розводити сульфатною кислотою і отриманий розчин дозувати у відстійники стічної води. Результати лабораторних і укрупнених випробувань свідчать, взагалі, про прийнятну ефективність нового коагулянту.
Пропонується також спосіб одержання коагулянту з відпрацьованого прожареного каталізаторного шламу процесу синтезу поліолефінів, для чого останній змішують з водою та додають концентровану сульфатну кислоту [37]. Отриману суміш нагрівають і витримують за температури 105 – 110 C протягом 30 хв. Потім гарячу суміш фільтрують. Фільтрат нейтралізують аміаком до pH 5,5 – 6,5 і охолоджують до 0 – 10 C. Кристали, що випали, промивають сумішшю води й ацетону в об’ємному співвідношенні відповідно 1: (1 – 1,2). Пропозиції щодо ацетонового промивання підвищують пожежну категорію виробництва, чим зменшують технологічну привабливість способу (до речі, ацетон віднесено до прекурсорів).
За способом [38] осад водоочисної станції, що містить 58 % мас. органічних домішок, зневоднюють (дуже важка операція), висушують за температури 100 – 110 C, а потім при перемішуванні оброблюють концентрованою сульфатною кислотою у співвідношенні з масою сухої речовини осаду (0,7 – 0,85): 1 з наступним введенням концентрованої нітратної кислоти у співвідношенні з масою сухої речовини осаду (0,01 – 0,05) : 1. Застосування отриманого коагулянту в дозі 4,05 мг/дм3 дозволяє знизити колірність води з 64 до 9 – 13 град, а кількість завислих речовин з 2,3 до 0,2 – 0,4 мг/дм3.
Основним недоліком способів виробництва сульфату алюмінію з шламів та зол є досить високий вміст у цих відходах оксидів заліза (іноді до 10 %), що не дозволяє отримувати коагулянт високої якості або вимагає додаткових технологічних операцій з очищення продукційних розчинів від сполук заліза.
Але чи не головним «слабким місцем» пропозицій, розглянутих у п.1.1.3 є те, що вихідні сировинні ресурси не здатні забезпечити масштабне виробництво цільового продукту, окрім досить ускладнених технологічних рішень без переконливого наукового обгрунтування.
Виробництво алюміній сульфату шляхом переробки каолінів
Підсумовуючи усе вищевикладене щодо виробництва сульфату алюмінію, можна побачити, що недоліком майже усіх видів алюмовмісної сировини, що використовується у даному процесі, є їхня недостатня кондиційність за вмістом заліза або висока вартість і дефіцитність. У той же час існує природна мінеральна сировина, яка за наведеними параметрами відповідає вимогам до вихідного матеріалу, з якого доцільно виробляти алюміній сульфат, що далі буде використовуватися в якості коагулянту. Ця мінеральна сировина – каолініт, основна складова частина каолінових глин, запаси яких в Україні величезні [39, 40]. Каолінові глини – основна сировина порцеляново-фаянсової промисловості, проте для виробництва коагулянту можливо і бажано використання саме некондиційного каоліну, що за деякими параметрами (пластичність, гігроскопічність, властивості у керамічній масі, міцність у сухому та випаленому стані) не відповідає вимогам вказаної галузі силікатної (керамічної) промисловості. Перспективним є також використання для отримання алюмовмісних коагулянтів незбагачених каолінів, особливо тих, що утворюються у вигляді побічних продуктів у гірничодобувній промисловості [41].
Каоліни як сировина для отримання алюміній сульфату
Каоліни належать до групи мономінеральних глин [1]. Глина називається каоліновою, якщо у ній міститься більше 50 % мінералу каолініту – Al2Si2O5(OH)4, хімічний склад якого наступний, %: 39,5 Al2O3; 46,6 SiO2; 13,9 H2O [8]. Каолінові глини відрізняються від каолінів більш високою дисперсністю часток каолініту, більшою пластичністю та здатністю спікатись за високих температур. У глинах переважають частки менше 2мкм, у каолінах – менше 5 мкм. До складу каолінів можуть входити й інші глинисті мінерали: диккіт, галуазит, накрит і гідрослюда, а також польові шпати та слюда (іноді до 30 – 40 %) [50]. Домішками також є кремнезем у вигляді кварцу й опалу, рідше халцедону (від сотих часток відсотка до 60 % і більше), оксид (IV) титану у вигляді рутилу й ільменіту (1 – 2 %), залізо – у вигляді різноманітних залізистих мінералів: лимоніту, гематиту, сидериту й ін. (до 2, рідше до 5 %) [8]. Декотрі каоліни містять мінерали гібсит і діаспор, внаслідок чого у них відмічається підвищений вміст оксиду алюмінію. З інших домішок у каолінах часто зустрічаються карбонати, пірит, глауконіт, алуніт, левігіт, гіпс й ін. Внаслідок присутності домішок хімічний склад каолінів змінюється у доволі широких межах.
Приблизно 70 % каоліну-сирцю, що видобувається у світі, надходить на каолінові підприємства для збагачення, а той, що лишився, лише частково використовується у незбагаченому вигляді, наприклад у промисловості вогнетривких матеріалів. Для виробництва ж коагулянтів доцільно використовувати як збагачені, так і незбагачені каоліни. У зв’язку з великим обсягом споживання збагаченого каоліну керамічною, целюлозно-паперовою й іншими галузями промисловості, виникають певні труднощі у забезпеченні виробництва коагулянтів цим видом сировини. Тому більш перспективно застосування незбагачених каолінів, особливо тих, що отримують у вигляді побічних продуктів (у т.ч. відвальних мас) у гірничо-видобувній промисловості.
В Україні розроблюється 12 каолінових родовищ: на Глуховецькому, Просянівському, Турбовському, Дубровському, Буртинському та ін. ведеться видобуток каолінів елювіального походження; поклади Полозького, Володимирського, Новоселицького та Глухівського родовищ містять перевідкладений каолін [8]. Видобування каолінів усіх родовищ, окрім Глухівського родовища, ведеться відкритим способом. Виробництвом збагаченого каоліну на Україні займаються Глуховецький, Просянівський та Турбовський каолінові комбінати.
Глуховецьке родовище розташоване у Вінницькій області. Каолін-сирець має об’ємну масу 2,0 т/м3. Глиниста частка складає 52 – 60 %, піщаниста – 40 – 48 %. Збагачений каолін на 85 – 98 % складається з каолініту двох різновидів: польового шпату та слюди. Домішки представлені лейкоксеном, карбонатами, гідрослюдами, мікрокліном, гідроксидами заліза.
Просянівський каоліновий район включає п’ять детально розвіданих ділянок: Маломихайлівський, Лівий схил балки Скидяної, Правий схил балки Скидяної, Західно-Дібровський та Вершинський, а також сім нових пошукових. Глиниста частка каолінів на 90 – 95 % представлена каолінітом. Окремі проби містять незначні домішки гібситу, лейкоксену, галуазиту, гідроксидів заліза, серициту. Вихід каолінового концентрату з сирцю складає у середньому 50 – 55 %. У Приазов’ї розташовані родовища Богородицьке (Біла Балка) та Єкатерининське. Вміст каоліну у сирці Богородицького родовища складає 52 – 55 %. У Приазовській субпровінції розташована низка крупних родовищ перевідкладених каолінів, що залягають іноді з вогнетривкими глинами. Полозьке та Володимирське родовища (Донецька область) розроблюються. Каолін останнього родовища застосовується для виготовлення високоякісних вогнетривких виробів й у порцеляново-фаянсовій промисловості.
У Черкаській області знаходяться крупні родовища каолінових глин: Новоселицьке, Звенигородське, Пісчиковське та Рижановське. З них тільки Новоселицьке детально розвідане й експлуатується. Головною особливістю його каоліну є присутність гібситу, що обумовлює високий вміст глинозему.
Хімічний склад каолінів основних українських каолінових родовищ наведено у таблиці 1.1.
Таблиця 1.1 - Хімічний склад каолінів основних родовищ України [7 ]
Родовище |
Зразок |
Середній вміст, % мас. |
||||||||
SiO2 |
Al2O3 |
Fe2O3 |
TiO2 |
CaO |
MgO |
R2O |
SO3 |
в. п. п. |
||
Глуховецьке |
Каолін– сирець |
46,1– 63,3 |
25,0 – 39,3 |
0 – 4,7 |
0,1 – 4,3 |
0,3 – 0,7 |
0 – 0,2 |
0 – 0,4 |
0 –10,27 |
13,2 – 13,8 |
Збагаче-ний |
45,9 – 49,3 |
35,0 – 39,3 |
0,1 – 4,7 |
0 – 4,6 |
0 – 10,9 |
0 – 1,2 |
0 – 1,0 |
– |
12,8 – 13,8 |
|
Просянівське |
Каолін– сирець |
49,6 – 65,3 |
24,0 – 38,4 |
0,5 |
0,2 – 0,5 |
0,2 – 0,7 |
0,1 – 0,3 |
0,5 – 0,6 |
0,1 |
8,8 – 12,8 |
Збагаче-ний |
46,5 |
36,0 – 38,5 |
0,1 – 1,4 |
0,1 – 0,7 |
0,3 – 0,6 |
– |
0,5 – 0,6 |
– |
12,5 – 14,0 |
|
Богородицьке |
Каолін-сирець |
52,7 – 71,4 |
19,9 – 32,6 |
0,2 – 1,1 |
0,2 – 1,3 |
1,5 |
– |
– |
– |
6,0 – 11,0 |
Збагаче-ний |
46,9 – 47,1 |
35,0 – 36,7 |
0,1 – 1,7 |
0,3 – 3,1 |
0,9 – 3,2 |
– |
– |
– |
13,3 – 13,6 |
|
Полозьке |
Каолін-сирець |
– |
39,1 – 45,1 |
1,0 – 1,5 |
– |
0,4 – 0,9 |
– |
– |
– |
– |
Вогнетривка глина |
– |
26,0–42,3 |
1,0 – 1,5 |
– |
0,4 – 0,7 |
– |
– |
– |
– |
|
Володимирське |
Перевід-ложені каоліни |
56 – 68 |
19 – 40 Al2O3 + TiO2 |
0,4 – 1,2 |
– |
0,5 |
0,1 – 0,3 |
0,5 |
0,3 |
9 – 13 |
Новоселицьке |
Каолін-сирець |
25,2 – 71,6 |
36,8 – 70,1 |
0,2 – 7,6 |
– |
0,1 |
0,3 |
0,1 – 0,4 |
– |
13,5 – 25,4 |
Збагаче-ний |
43,2 |
44,1 |
1,4 |
1,7 |
– |
– |
0,5 |
– |
14,0 |
|
Розкладання каолінів сульфатною кислотою
Каоліни мають досить складний характер хімічних перетворень і важко розкладаються сульфатною кислотою без попередньої термообробки. Незважаючи на велику кількість праць, присвячених дослідженню термохімічних перетворень каоліну, до теперішнього часу немає єдиної думки щодо механізму процесу. На основі комплексу досліджень фізико-хімічними методами, у тому числі рентгенофазовим аналізом й ІЧ-спектроскопією, механізм термохімічних перетворень каолініту орієнтовно можна представити наступними узагальненими реакціями 1:
 Al2Si2O5(OH)4
450
- 550 C
Al2O32SiO2
+ 2 H2O,
(1.1)
Al2Si2O5(OH)4
450
- 550 C
Al2O32SiO2
+ 2 H2O,
(1.1)
Al2O32SiO2 830 - 850 C -Al2O3 + 2 SiO2, (1.2)
 3
(-Al2O3)
+ 2 SiO2
900
C
3Al2O32SiO2.
(1.3)
3
(-Al2O3)
+ 2 SiO2
900
C
3Al2O32SiO2.
(1.3)
Уявна енергія активації термічного розкладання Eа та теплота дегідратації Qд каолінів різних родовищ змінюються у наступних межах (табл. 1.2).
Таблиця 1.2 – Уявна енергія активації термічного розкладання Eа та теплота дегідратації Qд каолінів різних родовищ (кДж/моль) [1 ]
Каоліни |
Eа |
Qд |
Глуховецькі |
– |
201 |
Просянівські |
247 |
– |
Володимирські |
201 |
279 |
Новоселицькі |
199,5 |
317 |
До температури 450 C каолініт не зазнає термохімічних перетворень, тому він важко розкладається сульфатною кислотою слабкої та середньої концентрацій. Ступінь вилучення оксиду алюмінію з Володимирських каолінів 20 %-вою H2SO4 не перевищує 2 – 3 %. Зі збільшенням температури випалу утворюється високоактивний метакаолініт, що більш легко розкладається сульфатною кислотою за здогадною реакцією1:
Al2O32SiO2 + 3 H2SO4 = Al2(SO4)3 + 2 SiO2 + 3 H2O. (1.4)
Ступінь вилучення оксиду алюмінію у розчин у результаті цього різко підвищується з 2 – 3 до майже 90 %. Зі збільшенням температури випалу до 850 C та особливо до 900 C вилучення глинозему в розчин знижується, що можна пояснити утворенням -Al2O3 та муліту, важко розчинних у сульфатній кислоті. Кремнезем у розчинах H2SO4 розчиняється у незначній мірі, тому його вміст у сульфатному розчині невеликий (0,1 – 0,2 г/дм3).
Збільшення тривалості випалу за температури 600 C до 0,5 год призводить до різкого зростання ступеню вилучення глинозему в розчин з 2 – 3 до 84,7 % при екстракції стехіометричною кількістю 20 %-вої H2SO4 протягом 0,5 год при 104 C. Зі зміною температури екстракції від 60 до 104C ступінь вилучення оксиду алюмінію у розчин підвищується від 14,8 до 92 %. Збільшувати температуру вище 104 C (температура кипіння розчину) недоцільно, тому що це істотно ускладнить апаратурне оформлення процесу– знадобиться застосування апаратів під тиском (автоклавів).
Зміна концентрації кислоти у межах 15 – 40 % мало впливає на вилучення оксиду алюмінію у розчин (91,3 – 95,3 %). Зі збільшенням концентрації кислоти вміст SiO2 у розчині знижується від 0,2 г/дм3, досягаючи при 20 %-вій H2SO4 0,13 г/дм3.
Розкладання каолінів можна також здійснити спіканням їх з сульфатною кислотою вище 200 C [1, 8]. У цьому випадку не потрібен попередній дегідратуючий випал, що дозволяє спростити процес сульфатизації. Послідовність хімічних перетворень при спіканні каолініту з сульфатною кислотою можна представити наступною спрощеною схемою:
A

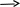 l2Si2O5(OH)4
+ 3 H2SO4
+7Н2О
100
C
Al2(SO4)312H2O
+ 2 SiO2300
C
Al2(SO4)3
+ 2 SiO2
+ 12
H2O.
(1.5)
l2Si2O5(OH)4
+ 3 H2SO4
+7Н2О
100
C
Al2(SO4)312H2O
+ 2 SiO2300
C
Al2(SO4)3
+ 2 SiO2
+ 12
H2O.
(1.5)
При наявності надлишку сульфатної кислоти проти стехіометричної норми можливо утворення кислих алюміній сульфатів. Це утруднює отримання кондиційного коагулянту за вмістом вільної H2SO4.
Обом способам сульфатизації каолінів властива низка недоліків: необхідність спеціальної підготовки каолінів перед випалом, значний пиловиніс у процесі подрібнення випалених каолінів, а також утруднення, що виникають при розкладанні каолінів сульфатною кислотою і при наступному відділенні сульфатного розчину від кремнеземистого шламу. Останнього недоліку позбавлений процес сульфатизації способом спікання, але у цьому випадку відмічаються великі втрати сульфатної кислоти з димовими газами, що відходять.
Спосіб двостадійної сульфатизації каолінів [8] дозволяє отримувати спіки з високою поруватістю (що забезпечує ефективне відділення сульфатного розчину від кремнеземистого шламу), а також значно зменшити втрати сульфатної кислоти. На першій стадії з каоліну та водного розчину сульфатної кислоти та алюміній сульфату готують пульпу, яку піддають грануляційному спіканню. Гранули випалюються та розкладаються сульфатною кислотою.
Втрати сульфатної кислоти з газами, що відходять, підвищуються із збільшенням дози кислоти та температури спікання. Спікання каолінів з 20 % сульфатною кислотою за температури 300 – 400 C дозволяє отримувати спіки з максимальною міцністю та втратою H2SO4 до 1 %. Із збільшенням температури спікання до 700 C втрати сульфатної кислоти складають вже 3%.
При кислотному розкладанні подрібнених спіків із збільшенням тривалості процесу від 0,25 до 1 год ступінь вилучення оксиду алюмінію у сульфатний розчин зростає від 87,3 до 91,2 %. Зменшення розміру часток спіку від 2 – 3 до 0,25 мм сприяє підвищенню ступеня вилучення Al2O3 від 87,2 до 92,7 %. Однак із зменшенням розміру часток значно погіршується розділення сульфатного розчину та кремнеземистого шламу. При цьому оптимальну температуру визначено як 100 – 103 C [8].
Оцінюючи в цілому результати проведених раніше фізико-хімічних досліджень сульфатнокислотного розкладання каолінів, можна відмітити слабке наукове обґрунтування та гадані погляди на механізм цього процесу і рекомендації щодо оптимальних чи раціональних умов його реалізації, які часто базуються виключно на експериментальних дослідженнях типу «чорний ящик».
Технологія отримання алюміній сульфату з каоліну
На практиці для розкладання каолінових глин застосовують, в основному, перелічені вище способи, тобто: розкладання варкою у розведеній сульфатній кислоті з попереднім випалом матеріалу, розкладання у концентрованій сульфатній кислоті методом сульфатного спікання та розкладання методом двостадійної сульфатизації.
Алюміній сульфат за цими методами може бути отриманий у вигляді неочищеного та очищеного продуктів. Неочищений коагулянт відрізняється від очищеного тим, що після розкладання каоліну сульфатною кислотою за реакцією (1.4) оксид силіцію(IV) не відокремлюється і входить до складу продукту, що призводить, звісно, до зниження вмісту цільового компоненту – алюміній сульфату та підвищенню вмісту нерозчинного залишку (н. з.), проте, з іншого боку, невідділений силіцій у подальшому може служити джерелом активної силікатної кислоти, що широко застосовується у практиці очищення стічних вод як флокулянт [1, 3, 17 – 19].
Алюміній сульфат випускається у формі кусків масою до 10 кг або пластівців із вмістом 14 – 16,3 % Al2O3. У невеликих кількостях алюміній сульфат поставляється споживачеві у вигляді розчину, що вміщує 6,7 – 7,7 % Al2O3, а також у вигляді неочищеного продукту, що являє собою суміш алюміній сульфату та нерозчинного залишку, переважно оксиду силіцію(IV) (табл.1.3) [1].
При вмісті у твердому продукті менше 15 % Al2O3 спостерігається злежування, що призводить до значних утруднень при підготовці коагулянту до застосування і збільшує транспортні витрати.
Нижче наведено деякі варіанти реалізації перелічених раніше пропозицій з прийомів виробництва коагулянту алюміній сульфату з каоліну.
Таблиця 1.3 − Вимоги до якості алюміній сульфату Al2(SO4)3
Продукт |
ГОСТ або ТУ |
Сорт |
Показники, що нормуються |
н. з. / Al2O3, не більше |
||||
Al2O3, %, не менше |
Вміст, %, не більше |
|||||||
н. з. |
H2SO4 (вільна) |
Fe2O3 |
As2O3 |
|||||
Al2(SO4)3 (очищ.) |
ГОСТ 12966 – 75 |
Вищий |
17,0 |
0,2 |
– |
0,02 |
0,003 |
– |
Перший |
16,3 |
0,3 |
– |
0,04 |
0,003 |
– |
||
Другий |
15,0 |
0,5 |
0,05 |
0,70 |
0,003 |
– |
||
Al2(SO4)3 техн. (очищ.) у рідкому вигляді |
ТУ 6-08-438-79 |
– |
7,2 0,5 |
1,0 |
0,1 |
0,1 |
0,003 |
– |
Al2(SO4)3 техн. (неочищ) |
ГОСТ 5155 – 74 |
А |
9,5 |
20,9* |
2,0 |
0,5 |
0,003 |
2,2 |
Б |
9,5 |
25,6* |
3,0 |
0,9 |
0,003 |
2,7 |
||
* Умовно. В ГОСТі не наведено.
1.2.4 Отримання алюміній сульфату з каоліну розкладанням варкою
Неочищений алюміній сульфат найчастіше пропонується отримувати з кондиційної каолінової глини, випаленої у полум’яній печі за температури 500 – 550 C [45]. Після охолодження до 50 – 80 C каолін повинен проходити обробку у варочному котлі 63 – 78 % сульфатною кислотою протягом 6 – 8 год за температури 105 – 115 C. У цих умовах не вся дозована кислота, як свідчать дослідні варки, вступає у взаємодію з каолінітом, тому після закінчення варки реакційну масу з вмістом 6 – 8 % вільної сульфатної кислоти треба ще вивантажувати у зрільники, де у результаті її дозрівання за температури 108 – 110 C протягом 8 год вміст вільної кислоти може знижуватися до 2 – 2,5 %. Визріла маса кристалізується при природному охолодженні 6 – 8 год, вільну кислоту пропонується нейтралізувати, наприклад, нефеліном. Якість продукту характеризується наступним хімічним складом (мас. %): 9 Al2O3, не більше 0,8 H2SO4 і не більше 23 нерозчинного залишку. На 1 т неочищеного алюміній сульфату за розрахунком витрачається 0,42 т каоліну вологістю 15 %, 0,32 т H2SO4 (100%), 0,2 – 0,3 т водяної пари та 6 – 6,2 кВтгод електроенергії.
Виробництво очищеного сульфату алюмінію з якісних каолінів було організовано у невеликих кількостях ще у довоєнні роки [46, 53]. Сутність технології зводилась до випалу сировини за температури 750 – 850 C та розкладання випаленого продукту 45 – 60 %-вим розчином сульфатної кислоти за температури кипіння. Пульпу розбавляли та фільтрували. Розчин випарювали та кристалізували алюміній сульфат. Подальші вишукування дослідників були націлені на удосконалення цього процесу. Каолін з вмістом 35 – 40 % Al2O3 подрібнювали у глином’ялці та потім випалювали у барабанній печі. У процесі випалу за температури 700 – 750 C утворюється метакаолініт за реакцією (1.1). Його подрібнювали у кульовому млині й елеватором подавали до бункера, звідки він завантажувався через ваги шнеком до реактора. Попередньо з мірників заливали до реактора сульфатну кислоту та воду. Метакаолініт розкладали 45 %-вим розчином H2SO4 за температури 110 – 115 C при безперервному перемішуванні за реакцією (1.4). Реакційну масу розбавляли промивними водами та відфільтровували кремнеземистий шлам. Фільтрат випарювали до вмісту Al2O3 15 – 16 % і потім кристалізували на поверхні барабанного водоохолоджуваного кристалізатора. Продукт транспортером подавали на склад, звідти його вантажили у вагони для відправки споживачам.
Науково-дослідним інститутом основної хімії (м. Харків) розроблено спосіб отримання алюміній сульфату виключно зі збагачених каолінів, який застосовувався деякий час у промисловому масштабі на Сумському хімічному комбінаті [47, 48]. Каолін подрібнювали і фракцію розміром 3 – 7мм направляли на випал, а більш дрібну – розмелювали, сушили у барабанній печі та гранулювали у тарілчастому грануляторі. Гранули розміром 3 – 7 мм разом з крупкою випалювали у печі з обертовим подом за температури 750 – 800 C. Випалений каолін охолоджували пропусканням великої кількості повітря і подавали на кислотне розкладання за температури 105 – 110 C до реактору проточного типу з рециркуляцією, куди також закачували промивну воду після третьої промивки та концентровану сульфатну кислоту. З метою підтримання заданого температурного режиму реактори були обладнані антегмітовими теплообмінниками. Доза кислоти на розкладання складала 70% від стехіометрично необхідної. Після досягнення концентрації сульфату алюмінію 13,5 % за Al2O3 і вільної сульфатної кислоти менше 0,1 % розчин кристалізували при природному охолодженні. Кремнеземистий шлам піддавали трикратній промивці. Промивна вода після третьої промивки з вмістом 7 % Al2O3 надходила на розкладання. У подальшому схему підготовки сировини було спрощено. Каолін після подрібнення у ножовій дробарці пластифікували у валковій дробарці, отримуючи пластини товщиною 1 – 3 мм, які потім випалювали у печі з обертовим подом. Випал проводили за температури 600 – 800 C, висота шару каоліну у печі складала 250 мм. Випалені каолінові пластини завантажували у реактор для обробки сульфатною кислотою за температури 105 – 115 C. Цей спосіб у порівнянні з наведеними вище має ряд переваг, а саме: виключаються операції розведення суспензії після сульфатного екстрагування та трудомісткі процеси фільтрування і випарювання розчинів алюміній сульфату.
Колективом під керівництвом проф. А.К. Запольського розроблено [47- 49] безперервний спосіб виробництва сульфату алюмінію з високоякісних каолінів (рис.1.1). Каолін з відкритих вагонів вивантажується грейферним краном до складу, звідки подається до бункера та подрібнюється у глинорізальній машині до фракції 30 – 50 мм. Подрібнений каолін та розчин алюміній сульфату надходять у млин мокрого помелу для приготування пульпи вологістю 50 – 55 %. Остання насосом подається до пневматичних форсунок печі киплячого шару. Зневоднення та гранулювання пульпи здійснюється за температури 190 – 230 C з використанням в якості ретуру дрібних гранул. Для класифікації гранул за розміром та відбору фракцій 1 – 3мм у вивантажувальну тічку подають повітря від повітродувки. Гранули з гранулятора надходять через шлюзовий затвор у піч киплячого шару, де випалюються за температури 560 – 580 C. При цьому відбувається зневоднення алюміній сульфату за реакцією
Al2(SO4)3nH2O Al2(SO4)3 + n H2O (1.6)
та утворення метакаолініту за реакцією (1.1). Випалені гранули з печі вивантажуються через шлюзовий затвор у холодильник киплячого шару, звідки після охолодження до 80 – 100 C транспортуються до бункера, а потім на кислотне розкладання.
Випалені гранули з бункера подаються живильником у барабанний апарат безперервної дії. Назустріч гранулам, що рухаються, до реактора надходять сульфатна кислота (93 %) та вода з напірних баків через дозуючі пристрої. Кислота дозується із розрахунку 95 – 97 % від стехіометричної кількості. У барабанному апараті безперервно й одночасно здійснюються три операції: кислотна екстракція алюмінію з метакаолініту, промивка та відділення кремнеземистого шламу – сіштофу. Температура сульфатної екстракції 100 – 110 C, її тривалість 1 – 1,5 год. Концентрований розчин сульфату алюмінію з вмістом 12 – 13 % Al2O3 (ступінь вилучення – 88 – 92%) та до 4 % нерозчинного залишку зливають до збірника продукту та насосом подають на контрольне фільтрування через шар вилужених гранул у присутності флокулянту поліакриламіду, що дозується у кількості 18 г на 1м3 розчину. Відфільтрований розчин надходить до бака-накопичувача і потім насосом подається у пневматичні форсунки гранулятора киплячого шару. Грануляційну сушку здійснюють в інтервалі температур 170 – 200 C. У результаті сушіння отримують частково зневоднений гранульований алюміній сульфат із вмістом 22 – 26 % Al2O3. Гранули охолоджують до 80 C у холодильнику киплячого шару і потім через шлюзовий затвор системою конвеєрів транспортують у бункерний склад, з якого вантажать у вагони для відправки споживачам. Кремнеземистий шлам містить 70 % аморфного оксиду силіцію(IV), 8 – 12 % Al2O3, 0,4 – 0,5 % Fe2O3, до 5 % SO3, 1 – 1,5 % TiO2, до 1 % (K2O + Na2O). Після сушіння у барабанній печі його можна використовувати в якості добавки для виробництва високоміцних цементів та керамічних плиток.
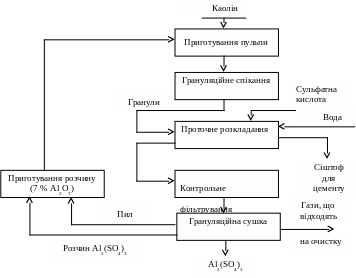
Рис. 1.1. Технологічний процес отримання гранульованого алюміній сульфату з каолінів безперервним методом 8 .
До переваг цього способу слід віднести:
спрощення підготовки сировини;
застосування для приготування пульпи в якості зв’язуючого розчину алюміній сульфату дозволяє отримати гранули з великою міцністю;
грануляція та випал каолінових пульп у апаратах киплячого шару дозволяють одночасно з вивантаженням здійснювати сепарацію гранул і, таким чином, направляти на екстракцію матеріал досить сталого гранулометричного складу;
сульфатну екстракцію у барабанному апараті безперервної дії суміщено з промивкою та відділенням кремнеземистого шламу – сіштофу;
здійснення зневоднення та грануляції концентрованих розчинів алюміній сульфату в апараті киплячого шару дозволяє отримати частково зневоднений гранульований продукт з високим вмістом основного компоненту – оксиду алюмінію;
значне скорочення потрібної виробничої площі;
увесь процес є безперервним і може бути автоматизований.
Як оптимальні умови процесу отримання алюміній сульфату з каоліну розкладанням варкою рекомендуються 1: температура випалу каоліну – 600 C, тривалість випалу 0,5 год., температура сульфатного розкладання – 102 – 104 C, тривалість розкладання – 0,5 – 1 год, концентрація H2SO4 – 15 – 20 % і доза її – 105 % від стехіометричної. Однак така доза буде сприяти отриманню кислого коагулянту. Тому кількість сульфатної кислоти необхідно зменшити до 95 % стехіометричного, хоча це і призведе до деякого зменшення ступеню вилучення алюмінію у розчин.
Отримання алюміній сульфату з каоліну методом сульфатного спікання
У Польщі розроблено [51] спосіб отримання неочищеного коагулянту з глин, відповідно до якого невипалену глину оброблюють розчином H2SO4 в автоклавах за температури 170 – 190 C. Надлишок кислоти у пульпі нейтралізують випаленою глиною, а потім реакційну масу зливають на кристалізаційний стіл. Продукт містить 7 % Al2O3 та 0,5 % Fe2O3 у вигляді сульфатів, 2 % вільної H2SO4 та 37 % нерозчинного залишку. У роботі зазначається, що наявність у коагулянті аморфного SiO2 у вигляді нерозчинного залишку сприяє покращенню коагулюючих властивостей продукту.
Ще за одним, розробленим у Польщі способом [53], передбачається одержання неочищеного сульфату алюмінію з глини, що містить 25 % Al2O3 та 4 % Fe2O3. Невипалену глину змішують з оборотним маточним розчином і розкладають надлишком H2SO4 в автоклавах за температури 170 – 190 C. Вилучення оксиду алюмінію у розчин складає близько 90 %. Розчин алюміній сульфату відфільтровують від нерозчинного кремнеземистого осаду та випарюють в апаратах з заглибними пальниками. Із розчину з молярним відношенням сульфат-іону до суми алюмінію та заліза не менше 1,65 за температури 50 C кристалізують заліза (II) сульфат з домішками сульфату алюмінію, який відділяють фільтруванням від маточного розчину і використовують в якості коагулянту. На другій стадії кристалізації після центрифугування та промивки отримують чистий алюміній сульфат. Маточний розчин після кристалізації направляють для приготування глиняної суспензії. Спосіб перевірено у промисловому масштабі на установці продуктивністю 5000 т/рік Al2(SO4)3. Одним з основних утруднень є відділення висококремнеземистого шламу від сульфатного розчину. Незважаючи на застосування флокулянтів, продуктивність фільтруючої апаратури залишається досить низькою.
У Франції запропоновано [6] спосіб отримання коагулянту з високоякісних глин, що містять до 40 % Al2O3, шляхом спікання їх з концентрованою сульфатною кислотою в обертовій печі за температури 400C. У результаті спікання утворюється безводний алюміній сульфат, завдяки чому вміст водорозчинного оксиду алюмінію у продукті значно підвищується. Спік з 22 % Al2O3 у вигляді сульфату, що містить SiO2, представляє собою продукт, який можна транспортувати навалом у вагонах. Зазначається, що силіцій (IV) оксид у процесах очищення води збільшує швидкість осадження флокулюючих колоїдів. Під час спікання каоліну частина кислоти видаляється з димовими газами і заходи щодо очищення останніх від Н2SO4 чомусь не передбачаються.
Співробітниками Інституту газу та ІЗНХ НАН України розроблено [1] інший спосіб отримання неочищеного гранульованого коагулянту з каолінів. При перемішуванні у мішалках каоліну, сульфатної кислоти та кислої суспензії від мокрої очистки димових газів після гранулятора готують каолінову пульпу вологістю 45 – 50 %. Сульфатна кислота дозується у кількості 90 – 95% від стехіометричної норми. Вміст каоліну в пульпі складає 23 – 24 % і сульфатної кислоти – 25,8 %. Пульпу в корекційних збірниках перемішують стисненим повітрям при безперервній її циркуляції і потім насосами подають по кільцевому трубопроводу в пневматичні форсунки. Пульпу розпилюють компресорним повітрям за тиску 0,5 МПа. У печах киплячого шару здійснюється грануляційне спікання при температурі 200 – 230 C. Випалені гранули неочищеного коагулянту вивантажуються комірковим живильником у шнек та транспортуються до робочої камери холодильника киплячого шару.
Отриманий з каолінів гранульований коагулянт має наступний склад (% мас.): 16 – 18 водорозчинного Al2O3, 30 – 32 н. з., 2 – 4 вільної H2SO4, 0,8– 1 Fe2O3 та 8 – 10 кристалізаційної води. На 1 т готового продукту витрачається 0,6 – 0,7 т каоліну, 0,55 т сульфатної кислоти (93 %), 470 нм3 стисненого повітря, 5,2 м3 води, 180 нм3 природного газу та 164 кВтгод електроенергії.
У Національному технічному університеті України “КПІ” співробітниками кафедри технології неорганічних речовин та загальної хімічної технології хіміко-технологічного факультету було проведено низку досліджень, виявлені оптимальні умови та обґрунтовано раціональний технологічний режим процесу отримання Al2(SO4)3 шляхом спікання з сульфатною кислотою збагаченого каоліну Просянівського родовища [52, 54]. Встановлена оптимальна температура складає 260 – 300 C, концентрація кислоти – 25 % (при дозі її 95 % від стехіометричної кількості).
В Інституті хімії АН Узбекистану останнім часом розроблено спосіб [1] отримання алюміній сульфату з ангренських каолінових глин. За запропонованою технологією каолін з бункера, сульфатну кислоту в кількості 90 % від стехіометричної норми з напірного бака та промивну воду змішують у двовалковому змішувачі. Пульпу спікають за температури 280 – 300 C протягом 1,5 год у барабанній печі. Спік, що містить до 16 % водорозчинного оксиду алюмінію і відповідає технічним умовам на неочищений коагулянт, може використовуватися для очищення питних та стічних вод. При відношенні Р / Т = 3 і температурі 90 – 95 C спік вилуговують водою в апараті з мішалкою. Вилучення глинозему в розчин досягає 80 %. Пульпу фільтрують на рамному фільтр-пресі. Кремнеземистий шлам пропонують використовувати у виробництві будівельних матеріалів. Розчин алюміній сульфату концентрацією 50 – 60 г/дм3 Al2O3 випарюють за температури 100 – 110 C до концентрації 145г/дм3 і потім піддають грануляційній сушці в апараті киплячого шару.
Як оптимальні умови процесу отримання сульфату алюмінію з каоліну методом сульфатного спікання рекомендуються 1: температура спікання – 300 C, вологість пульпи – 45 %, тривалість спікання – 1 год, температура розкладання – 100 C, тривалість вилуговування – 0,5 год., відношення Р / Т = 2 – 2,5.
1.3 Висновки до розділу 1 і постановка задач дослідження
Критичний огляд сучасного стану і перспектив налагодження виробництва коагулянтів на основі каолінових глин чи каолінів виявив наступне.
1.3.1 Розробники в дослідженнях мало приділяли уваги особливостям стану вихідної сировини, себто іноді навіть не вказували походження останньої: збагачений каолін чи нативні каолінові глини, некондиційні залишки каоліну після збагачення природної каолінової сировини тощо. В той же час, ця обставина є досить суттєвою як при проведенні сульфатнокислотної переробки вихідної сировини, так і при інтерпретації фізико-хімічних засад перебігу хімічних і термохімічних перетворень у відповідних процесах.
1.3.2 В розглянутих технологіях не ставилось завданням виявити, надати чи підсилити привабливі при застосуванні відповідних коагулянтів їхні сорбційні властивості, за наявністю яких сфера використання, технологічна і економічна привабливість коагулянтів-сорбентів переходить на більш високий рівень у ієрархії в процесах водоочищення.
1.3.3 Актуальними проблемами є наукове обґрунтування і розробка способів отримання коагулянтів , які мають дуже широкий спектр дії та здатні видаляти різні домішки з забруднених вод в одну стадію. В основу отримання необхідно закласти неенергоємні технології та використовувати низьковмісну алюмінієву сировину.
1.3.4 Застосування порошкоподібних коагулянтів у процесах очищення сточних вод (СВ) особливо доцільним виявляється для тих потенційних споживачів подібного продукту, які не мають потреби або змоги будувати та утримувати відповідні споруди для рідких коагулянтів, тому що, наприклад, стоки у них з’являються періодично, час від часу, і не є сталими за складом та значними за об’ємами . Такими стоками є СВ СТО, невеликих дільниць фінішної обробки металів, шкіряно-хутряних фірм тощо. Саме і особливо для таких споживачів дуже зручно мати справу з порошкоподібними коагулянтами, які б до того ж володіли подекуди сорбційними властивостями (для поглинання домішок нафтопродуктів, іонів важких металів, паливно-мастильних відходів, органічних сполук).
1.3.5 Виробництво подібних коагулянтів починає мати розвиток за кордоном, але відсутнє в Україні (потреби в них частково задовольняються за рахунок коштовного імпорту). А тим часом виробництво подібного продукту може бути відносно простим у технологічному і технічному оформленні і організованим за нескладною схемою та на стандартному обладнанні не тільки на будь-яких хімічних, а й навіть і на нехімічних підприємствах, у тому числі і для власних потреб. До того ж виробництво алюміній сульфату, засноване на використанні в якості сировини каоліну (навіть такого, що не задовольняє вимогам інших виробництв, що застосовують його у власних технологічних схемах, порцеляново-фаянсова, целюлозно-паперова промисловість тощо) особливо актуальне саме на Україні. В нашій країні відчувається нестача високоякісної алюмовмісної сировини (бокситів, нефелінів і інш.), а запаси каолінових глин майже невичерпні.
Підсумовуючи усе вищесказане, метою роботи визначається розробка теоретичних та технологічних засад одержання порошкоподібного реагенту на основі українських сировинних джерел та застосування його для коагуляційно-сорбційного очищення стічних вод різного походження. Як метод переробки каоліну на коагулянт раціонально прийняти сульфатнокислотне спікання (як більш економний спосіб) з науковою аргументацією і оптимізацією параметрів розкладу в напрямку отримання у готовому продукті коагуляційних, флокуляційних та сорбційних якостей.
РОЗДІЛ 2
ОБ’ЄКТ ТА МЕТОДИ ДОСЛІДЖЕНЬ
2.1 Об’єкт дослідження
Об’єктом дослідження є технологія сульфатнокислотної переробки вітчизняної сировини- незбагаченої (нативної) каолінової глини Веселовського та Просянівського родовища – у порошковий флококоагулянт- сорбент.
2.1.1 Каолінова глина вітчизняних родовищ
2.1.1.1 Дослідження структурно-механічних і фізико-механічних властивостей каолінової глини Веселовського і Просянівського родовищ
Незалежно від спрямованості робіт з використання каолінової глини, неодмінному висвітленю і рішенню підлягають питання, пов’язані з добуванням, зберіганням,транспортуванням, перемішуванням, підготовкою до переробки( сушіння, розмелення, класифікації), дозуванням у реактори. Для обгрунтування відповідних рекомендацій необхідно мати дані з ряду фізико-механічних властивостей і реологічних характеристик глин і глинистих суспензій та пульп. У літературі [55] є досить обмежені відомості щодо фізико-механічних властивостей нативних каолінових глин вказаних родовищ. Так, для каолінових глин Просянівського родовища у нативній формі у літературних джерелах існують лише дані щодо природного кута скосу та плинності. Сировина Просянівського родовища після добування зазнає, як правило збагачення та розмолу і в подальшому використовується у фарфоро-фаянсовій промисловості( виготовлення санітарної кераміки) та у паперовому виробництві. Щодо нативних каолінових глин Веселовського родовища - в літературі відсутні будь-які дані, корисні для обґрунтування технологічних умов їх хімічної переробки у коагулянт. Це пов’язано з тим , що добута глина зараз використовується тільки у керамічній галузі промисловості. На підставі власних дослідів автори [55] рекомендують при транспортуванні каолінових глин підтримувати їхню вологість на рівні 25%. Рекомендації з вибору транспортних засобів, умов зберігання, видів устаткування для кислотної переробки в зазначеному напрямі відсутні.
Структурно- механічні і реологічні властивості каолінових глин Веселовського і Просянівського родовищ вивчались нами як для зразків у нативному, вологому, повітряно-сухому і висушеному (за температури Т=110 С) видах, так і для глинистих пульп і суспензій аналогічних до тих , що використовувались нами при сульфатнокислотному способі їхньої переробки у водоочисні продукти.
Відносну і насипну щільність зразків каолінових глин визначали пікнометрично [56]- для відносної щільності у середовищі етилового спирту. За здатністю до ущільнення оцінювали таку характеристику як плинність.
Дисперсійний склад різних зразків каолінових глин , що впливає на ряд реологічних характеристик сипучих речовин та їхніх пульп і суспензій, визначали за допомогою фотоседиментографу (ФС-151). Усі зразки каолінових глин перед сульфатнокислотним розкладанням подрібнювали до розмірів часток ≤0,25 мм і надалі дослідження проводили тільки з вказаною дисперсною фракцією. Реологічні характеристики (умовну межу плинності, ефективну в’язкість , повзучость) визначали з застосуванням ротаційного вікозиметру (ВСН-3).
2.1.2 Реактиви
В роботі використовували наступні хімічні сполуки реактивної, „ч”, „хч”, „чда” – чистоти: кислота сульфатна – Н2SO4, х.ч., ДСТУ 2318-93 від ТОВ «Хімлаборреактив», Україна; кислота сульфатна контактна технічна 1-й сорт, ГОСТ 2184-77 виробництва об’єднання „Український титан”.
Методи проведення аналізів
Аналітичні методи дослідження каолінової сировини
Визначення вмісту алюміній оксиду
Визначення вмісту Al2O3 проводилося гравіметричним методом з осадженням алюмінію у вигляді фосфатів AlPO4 [56]. Осад фосфатів, отриманий у результаті взаємодії кислотного екстракту з фосфатною кислотою та розчином аміаку, надалі відфільтровували, висушували та прожарювали протягом 10 – 15 хв у муфелі за температури 700 C. Прожарений осад охолоджували та зважували у вигляді AlPO4.
Вміст Al2O3 знаходили за формулою, %:
![]() ,
(2.1)
,
(2.1)
де g1 – маса прожареного осаду AlPO4, г; 0,9589 – коефіцієнт перерахунку AlPO4 на Al2O3; 250 – об’єм кислотного розчину глини, см3; g – наважка проби глини, г; V – об’єм розчину, узятий для аналізу, см3.
2.2.1.2 Визначення вмісту заліза (ІІІ) оксиду
Метод аналізу заліза, використаний у даній роботі, – фотометричний, оснований на вимірюванні оптичної густини забарвлених розчинів комплексної сполуки заліза з іоном роданіду CNS- [56]. Максимум світопоглинання цієї сполуки відповідає довжині хвилі світла = 490 – 508нм. Для побудови калібрувального графіка з робочого стандартного розчину солі заліза відбирались аліквоти, що містили від 0,02 до 0,1 мг заліза. Оптична густина вимірювалася на фотоелектроколориметрі КФК-2-УХЛ4.2 по відношенню до „холостого” розчину (що не містить іонів заліза). У результаті вимірювань було отримано лінійну залежність оптичної густини розчинів від концентрації іону заліза у них. Йони заліза (II) попередньо окиснювали до заліза (III). За цим методом визначається 0,05 – 4мг заліза у літрі розчину.
Вміст Fe2O3 знаходили за формулою, %:
![]() ,
(2.2)
,
(2.2)
де CFe – концентрація Fe, визначена за калібрувальним графіком, мг; 2,865 – коефіцієнт перерахунку Fe на Fe2O3.
2.2.1.3 Визначення вмісту кальцій оксиду
Метод аналізу кальцію, використаний у даній роботі, – титриметричний [56]. Сутність методу полягає у тому, що кальцій осаджували у вигляді оксалату з оцтовокислого розчину. Осад розчиняли у сульфатній кислоті і титрували щавлеву кислоту, що при цьому виділяється, розчином калій перманганату. Осадження кальцію вели за суворо визначеного pH розчину (4,0) у присутності індикатору бромкрезолового зеленого або метилового оранжевого За вказаного pH полуторні оксиди утворюють розчинні комплекси зі щавлевою кислотою і попереднє їхнє відділення не потребується. Точність методу складала 0,8 % (відн.) за вмісту CaO 20 – 50% і 5 % (відн.) за вмісту CaO 1 – 5 %.
Вміст CaO знаходили за формулою, %:
![]() ,
(2.3)
,
(2.3)
де
![]() – об’єм розчину KMnO4,
витрачений на титрування, см3;
0,0028 – титр точно 0,1 моль/дм3
розчину
KMnO4
по
CaO, г/см3.
– об’єм розчину KMnO4,
витрачений на титрування, см3;
0,0028 – титр точно 0,1 моль/дм3
розчину
KMnO4
по
CaO, г/см3.
2.2.1.4 Визначення вмісту магній оксиду
Магній оксиду у даній роботі визначали гравіметричним методом [56]. За цим методом вміст магнію аналізували з розчину, в якому осаджено кальцій у вигляді оксалату. При додаванні до такого розчину фосфат іонів магній осаджується у вигляді MgNH4PO46H2O. Ця речовина після прожарювання у муфельній печі за температури 1000 – 1050 C утворює білий осад магній дифосфату Mg2P2O7.
Вміст MgO знаходили за формулою, %:
![]() ,
(2.4)
,
(2.4)
де g2 – маса прожареного осаду Mg2P2O7, г; 0,3622 – коефіцієнт перерахунку Mg2P2O7 на MgO.
2.2.1.5 Визначення вмісту натрій та калій оксидів
Натрій та калій оксидів визначали за допомогою метода полум’яно-емісійної спектрометрії [57]. Сутність методу полягала в тому, що досліджуваний розчин вводили у вигляді аерозолю у полум’я горілки, що працює на суміші газів (повітря та пропану або повітря та ацетилену). Тиск повітря та горючого газу підтримується постійним. У полум’ї атоми металів збуджуються та, переходячи зі збудженого у нормальний стан, випромінюють світло певних довжин хвиль. Зі спектру емісії монохроматором виділяються характерні для визначаємих металів лінії (для натрію = 589 нм, калію = 768 нм). За інтенсивністю цих ліній визначали концентрацію елементів у пробі, для чого будували калібрувальні графіки за стандартними солями цих металів. Чутливість визначення дуже висока (менше 0,1 мг/дм3); відносна похибка методу мала.
2.2.1.6 Визначення вмісту титан (IV) оксиду
Метод визначення титану, використаний у даній роботі, – фотометричний, оснований на взаємодії титан (IV) сульфату у кислому середовищі з пероксидом водню з утворенням комплексної сполуки, забарвленої у жовтий колір [56]. Ця сполука являє собою похідне надтитанової кислоти і утворюється за наступною реакцією:
Ti(SO4)2 + H2O2 H2[TiO SO4* H2O2 ]. (2.5)
Максимум світопоглинання цієї сполуки відповідає довжині хвилі світла = 400 нм. Для побудови калібрувального графіка зі стандартного розчину титану відбиралися аліквоти, що містили від 0,1 до 1 мг титану. Оптична густина вимірювалася на фотоелектроколориметрі КФК-2-УХЛ4.2 по відношенню до “холостого” розчину (що не містить іонів титану). У результаті вимірювань отримано лінійну залежність оптичної густини розчинів від концентрації іону титану у них.
Вміст TiO2 знаходили за формулою, %:
![]() ,
(2.6)
,
(2.6)
де
![]() – концентрація TiO2,
визначена за калібрувальним графіком,
мг.
– концентрація TiO2,
визначена за калібрувальним графіком,
мг.
2.2.1.7 Визначення вмісту силіцій (IV) оксиду
Метод визначення силіцій (IV) оксиду, використаний у даній роботі, – фотометричний, оснований на утворенні силіціймолібденової комплексної сполуки, забарвленої у жовтий колір [57]. Максимум світопоглинання цієї сполуки відповідає довжині хвилі світла = 670 нм. Для виконання аналізу наважку глини попередньо сплавляли у платиновому тиглі з безводною кальцинованої содою, плав вилуговували водою і в отриманому розчині визначали SiO2 за калібрувальним графіком, для побудови якого зі стандартного розчину натрій гексафторосилікату відбиралися аліквоти, що містили від 0,05 до 0,25 мг SiO2. Оптична густина вимірювалася на фотоелектроколориметрі КФК-2-УХЛ4.2 по відношенню до холостого розчину (що не містить силіцію).
Вміст SiO2 знаходили за формулою, %:
![]() ,
(2.7)
,
(2.7)
де
![]() – концентрація SiO2,
визначена за калібрувальним графіком,
мг; Vпл–
об’єм отриманого розчину плаву, см3.
– концентрація SiO2,
визначена за калібрувальним графіком,
мг; Vпл–
об’єм отриманого розчину плаву, см3.
2.2.1.8 Визначення вологості та втрат при прожарюванні (в. п. п.)
Визначення вологості каолінової глини проводилося шляхом висушування певної наважки глини у сушильній шафі за температури 110 C до постійної маси. В. п. п. визначалися прожарюванням висушеної наважки у муфельній печі при 750 C [57].
Вологість визначалась за формулою, %:
![]() ,
(2.8)
,
(2.8)
де gпоч , gкін – маса тиглю з наважкою до та після висушування, г.
В. п. п. визначалися за формулою, %:
![]() ,
(2.9)
,
(2.9)
де gзменш – зменшення маси при прожарюванні, г.
Аналітичні методи визначення масової долі компонентів продукту кислотної переробки каолінових глин
2.2.2.1 Методики, використані для визначення якості отриманого продукту
Як основні параметри, що визначають якість отриманого флококоагулянту (згідно ГОСТ 5155 – 74 на неочищений технічний сульфат алюмінію (табл. 1.3)), було обрано вміст у готовому продукті цільового компоненту Al2O3 та вільної сульфатної кислоти H2SO4. Також в отриманому флококоагулянті було визначено вміст активної силікатної кислоти.
2.2.2.1.1 Визначення масової частки водорозчинного алюміній оксиду
Метод аналізу готового флококоагулянту на водорозчинний Al2O3, використаний у даній роботі, – титриметричний [58]. Сутність методу полягала у тому, що до розчину флококоагулянту, що аналізується, додавали певну кількість комплексоутворюючого реагенту (трилону Б), який взаємодіє з присутніми у розчині іонами алюмінію. Надлишок трилону надалі відтитровували сіллю цинку у присутності індикатору ксиленолового оранжевого.
Вміст водорозчинного Al2o3 розраховували за формулою, %:
![]() ,
(2.10)
,
(2.10)
де Vтр – об’єм розчину трилону Б, см3; VZn – об’єм розчину ZnSO47H2O, витрачений на титрування, см3; KZn – коефіцієнт перерахунку концентрації розчину ZnSO47H2O на точно 0,05 моль/дм3; 0,00255 – титр точно 0,05моль/дм3 розчину трилону Б по Al2O3, г/см3; m – маса наважки флококоагулянту, г.
2.2.2.1.2 Визначення вмісту вільної сульфатної кислоти
Метод аналізу готового флококоагулянту на вміст вільної H2SO4, використаний у даній роботі, – титриметричний [58]. Сутність методу полягає у тому, що до розчину флококоагулянту, що аналізується, додавали відому кількість реагентів (сульфатна кислота H2SO4, магній хлорид MgCl26H2O та калій оксалат K2C2O4H2O), які пригнічують гідроліз алюміній сульфату, і надалі відтитровували вільну сульфатну кислоту натрій гідроксидом у присутності індикатору метилового червоного.
Вміст вільної h2so4 розраховували за формулою, %:
![]() ,
(2.11)
,
(2.11)
де VNaOH
– об’єм розчину NaOH, витрачений на
титрування, см3;
![]() –
об’єм розчину NaOH, витрачений на титрування
доданої сульфатної кислоти у контрольному
досліді, см3;
0,0049 – титр точно 0,1 моль/дм3
розчину
NaOH по H2SO4,
г/см3;
250 – об’єм розчину флококоагулянту,
см3.
–
об’єм розчину NaOH, витрачений на титрування
доданої сульфатної кислоти у контрольному
досліді, см3;
0,0049 – титр точно 0,1 моль/дм3
розчину
NaOH по H2SO4,
г/см3;
250 – об’єм розчину флококоагулянту,
см3.
2.2.2.1.3 Визначення вмісту водорозчинної форми силікатної кислоти
Попереднє якісне визначення силікат-іону у готовому продукті проводилося за методикою [57], основаною на реакції з амоній молібдатом та бензидином. Гранична концентрація, що відкривається даним методом, – 110-6%.
Метод кількісного визначення активної силікатної кислоти у готовому флококоагулянті, використаний у даній роботі, - фотометричний, оснований на утворенні сіліцієвомолібденової комплексної сполуки, забарвленої у жовтий колір [57]. Максимум світопоглинання цієї сполуки відповідає довжині хвилі світла = 400 – 413 нм. Для побудови калібрувального графіку зі стандартного розчину натрій метасилікату відбиралися аліквоти, що містили від 0,2 до 1 мг SiO2. Оптична густина вимірювалася на фотоелектроколориметрі КФК-2-УХЛ4.2 по відношенню до холостого розчину (що не містить силіцію).
Вміст водорозчинного SiO2 знаходили за формулою, %:
![]() . (2.12)
. (2.12)
Термічні методи досліджень
Термічний аналіз зразків здійснювали на дериватографі Q – 1500 системи Паулік, Паулік, Ердей при нагріванні в неізотермічному режимі у атмосфері азоту за наступних умов: наважки зразків були в межах 0,2 – 1грам, масова чутливість 200 – 500 мг, швидкість нагріву зразка 2,5 – 20град/хвилину, еталонна речовина – α-корунд , матеріал тиглів- алунд, чутливість гальванометрів ДТА- 1мВ, ТГ та ДТГ -5 мВ. Дериваторами реєструвались і оброблялись за відповідною програмою із залученням комп’ютерної техніки.
Рентгеноструктурні дослідження
Рентгеноструктурний аналіз мінеральних і сольових композицій виконувався на приладі ДРОН-3М з фільтрацією кобальтового Кα – випромінювання. Перед аналізом зразки подрібнювались у вібромлині і просіювались через сито з отворами 0.01мм. Рентгенограми реєструвались і оброблялись за допомогою комп’ютерної програми. Для розшифровки рентгенограм використовувалась програма ASTM Demo, яка основана на картотеці ASTM.
Спектроскопічні методи ( ІЧ-спектроскопія, спектрофотометрія)
Елементний склад вихідних речовин вивчали методом рентген-флуоресцентного аналізу на приладі EXPERT 02L (Україна) за таких умов: напруга аноду рентгенівської трубки – 90 кВ, струм – 75 – 100 мкА, час експозиції – 75 с, зона (1 – 2047) каналів. Прилад дозволяє вимірювати елементний склад від магнію до урану.
Спектри в інфрачервоній області знімали на приладі SPECORD M80. Перед аналізом зразки подрібнювали і пресували в таблетку з оптично чистим KBr. Зняття спектрів поглинання в інфрачервоній області проводили за наступних умов: початок розгортки 4000 см-1, кінець - 400 см-1, крок розгортки 1 см-1; фіксувався відсоток поглинання, речовина порівняння- оптично чистий KBr.
2.3 Лабораторна установка для сульфатнокислотної обробки каолінових глин, методика експериментів і аналізів
2.3.1 Опис експериментальної установки для кислотного розкладання каолінової глини
Експерименти по розкладанню каолінової глини сульфатною кислотою проводили у лабораторній установці, зображеної на рисунку 2.1. Попередньо подрібнений каолін змішували з розрахованою кількістю сульфатної кислоти і перемішували до утворення однорідної пульпи(пасти). Отриману пульпу (пасту) помішали в кварцевий тигель 1, який розміщували в печі 2 і витримували протягом певного часу. Нагрівання печі здійснювали за допомогою спіралі 2.1, яка підключена до ЛАТРу 3. Контроль температури суміші здійснювали Pt-PtRh термопарою, яка через перетворювач 5 показує температуру на індикаторі 6. Для запобігання виносу парів кислоти в печі було передбачено керамічну кришку 2.2. Після закінчення часу спікання продукт вилучали з тиглю 1 і подрібнювали до порошкоподібного стану (розмір часточок ≤ 0,25 мм) і всебічно досліджували.
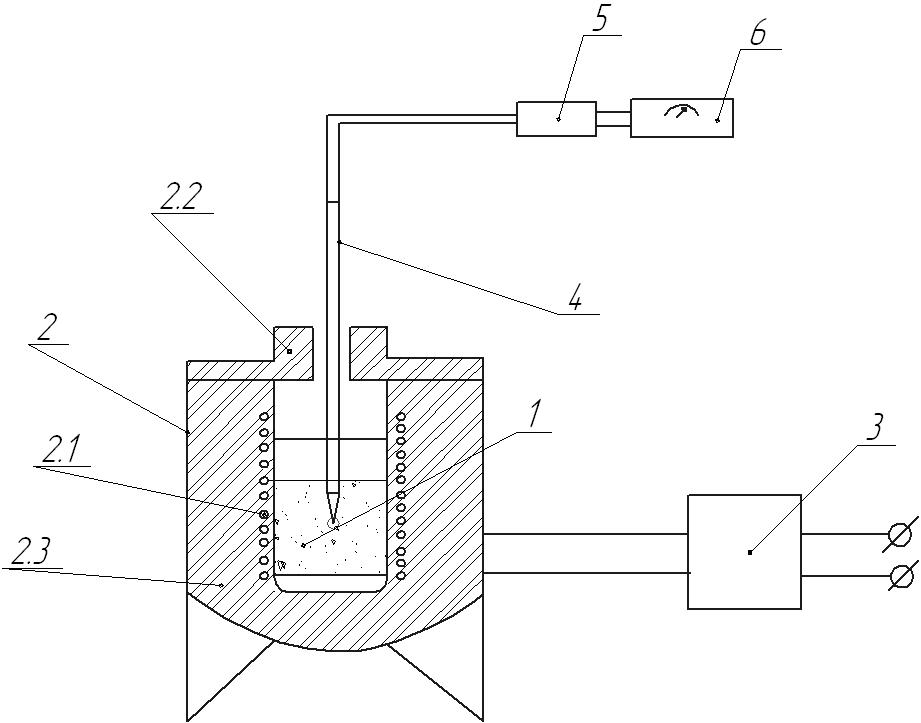
Рис. 2.1 - Схема експериментальної установки для кислотного розкладання каолінової глини:
1 – тигль з реакційною масою; 2 – піч: 2.1 – спіраль нагрівача; 2.2 – кришка; 2.3 – керамічний корпус; 3 – ЛАТР; 4 – контрольна термопара; 5 – електронний перетворювач; 6 – індикатор температури.
2.3.2 Визначення питомої поверхні одержаних зразків флококоагулянту-сорбенту
Визначення питомої поверхні зразків здійснювали методом теплової десорбції азоту.
Метод заснований на тому, що за зміною теплопровідності газового потоку, що проходить через трубку з вимірюваним зразком, визначається кількість азоту, адсорбованого поверхнею зразка з газової суміші при охолодженні його рідким азотом і десорбованого при наступному розігріванні зразка до кімнатної температури [59]. Змінюючи концентрацію адсорбованого газу у суміші, можна одержати кілька значень адсорбції, що відповідають різним концентраціям, побудувати ізотерму адсорбції й обчислити з неї питому поверхню зразка методом БЕТ. По суті, метод теплової десорбції не є хроматографічним, тому що в ньому не використовується зміна тривалості утримання. Проте оскільки для виміру адсорбованої кількості використовується газохроматографічна апаратура, цей метод часто називають газохроматографічним. Метод теплової десорбції відрізняється простотою приладу й операцій і дозволяє швидко вимірювати питомі поверхні від 0,1 до 500 м2/г. На рис. 2.2 представлена схема установки Інституту біорганічної хімії та нафтохімії НАН України, на якій і визначали питому поверхню синтезованих зразків методом теплової десорбції.
Суміш азоту й гелію з балона 1 проходить через ротаметр 2 для контролю швидкості газового потоку, фільтр 3 для осушки й очищення газів, вентиль тонкого регулювання 4 і надходить у порівняльну камеру детектора за теплопровідністю 5 і потім у колонку 6 - U-образну скляну трубку (на шліфах) довжиною 15 – 20 см і внутрішнім діаметром 4 – 5 мм, у нижню частину якої поміщають наважку синтезованого зразку. Зі стовпчика газова суміш надходить у вимірювальну камеру детектора й, пройшовши через пінний вимірник потоку 7, виходить із установки. Сигнал детектора надходить на записуючий потенціометр.
Рисунок 2.2 – Схема установки для визначення величини поверхні методом теплової десорбції.
балон з газовою сумішшю;
перший ротаметр витрати;
фільтр;
регулювальний вентиль;
детектор теплопровідності( катарометр);
адсорбер;
Розрахунок поверхні проводили по десорбційних піках, тому що десорбція відбувається при більш високій температурі і тому швидше, ніж адсорбція, отже десорбційні піки більш симетричні.
Наважку зразку підбирали таким чином, щоб перо самописа відхилялось приблизно на половину всієї шкали.
Об’ємна швидкість газової суміші також пов’язана з величиною поверхні зразка. Чим менше швидкість, тим більша площа піка, тобто більша чутливість. Швидкість газової суміші вибирали в межах від 10 до 60 см3/хв.
Маючи у своєму розпорядженні газову суміш якої-небудь однієї концентрації азоту, можна визначати питому поверхню методом порівняння. Отже за однакових умов (швидкість потоку, напруга на детекторі, охолодження стовпчика) проводили адсорбцію й десорбцію для вимірюваного зразка й для зразка з відомою питомою поверхнею, що слугує еталоном. Розрахунок проводили по площах десорбційних піків, пропорційних загальній поверхні зразків:
S/Sе=sg/sеgе.
Звідси
s=Ssеgе/ Sеg , (2.15)
де S – площа десорбційного піка (см2); s – питома поверхня зразка (м2/г); g – маса зразка (г).
Величини з індексом «е» відносятся до еталонного зразка. Площу піків визначали або за допомогою планіметра і графічно, а також, в окремих випадках, перенесенням контурів піків тонким олівцем на кальку і зважуванням вирізаних контурів на аналітичних вагах (у цих випадках в розрахункову формулу замість площ піків підставляли дані зважування).
2.3.3 Визначення об’єму пор за бензолом
Сорбційний об’єм пор у зразках визначався ваговим способом за сорбцією пари бензолу [59]. Розрахунки проводили за формулою:
![]() , (2.23)
, (2.23)
де Vs – сорбційний об’єм пор, см3/г; q1 – маса бюкса з наважкою сорбенту, г; q2 – маса бюксу з наважкою сорбента після сорбції бензолу, г; q0 – вихідна маса сорбенту, г; ρб – густина бензолу за кімнатної температури, 0,875 г/см3.
2.3.4 Методика лабораторного дослідження ефективності дії флококоагулянту-сорбенту (ФКС)
Дослідження ефективності дії отриманого ФКС проводили на напівпромисловій установці (Floculiator-2000), що представляє собою чотири обладнані мішалками ємності місткістю по 2 дм3 кожна. Схему установки наведено на рис. 2.3.
1 – ємності ; 2 – мішалки; 3 – електромотор .
Рис. 2.3 Схема експериментальної установки для дослідження ефективності дії ФКС.
У приготовану модельну або реальну стічну воду при інтенсивному перемішуванні (Re =17000) вносили розраховані наважки флококоагулянту-сорбенту (ФКС) та перемішували протягом 1 хв. Після цього оберти зменшували до 40 об/хв (Re=700) і 20 хв відбувалось повільне перемішування. Після вимкнення мішалки вода відстоювалась 40 хв. З середини освітленої частини відбирали пробу води та визначали ступінь її очищення за критеріями, що досліджувались.
Математичні методи дослідження і обробки результатів, що використані в роботі
Постановка експериментів при дослідженні процесу одержання та властивостей ФКС проводилась і базувалась на принципах математичного планування експерименту [60,61].
Для визначення термодинамічної імовірності перебігу процесу було використано програму „Спектр”, яка призначена для обрахунку термодинамічничних характеристик та рівноважних концентрацій компонентів в складних системах за заданих температур.
Для розрахунку кінетичних параметрів реакцій, які перебігають у досліджуваних системах, було використано програму Microsoft Office ХР. Програма розповсюджується разом з операційною системою, в межах ліцензії для ВНЗів.
Для ідентифікації піків у ІЧ-спектрах було використано базу речовин: AIST: RIO-DB Spectral Database, SDBS.
2.4.1 Методика обробки термогравіметричних даних
Розрахунки, що використовуються для ізотермічних процесів, не можуть бути з дотатньою достовірністю використані для неізотермічних процесів, тому важливо було визначити співвідношення між кінетичними характеристиками ізотермічних та неізотермічних процесів [62-64].
Одним з важливих критеріїв використання методу є експериментальна можливість реалізації в дослідженнях тих або інших температурних умов. При неізотермічних дослідженнях температура середовища та температура зразка завжди відрізняються, отже в зразку виникає квазістаціонарне температурне поле.
Ступінь перетворення в ізотермічних (Х) та неізотермічних (α) процесах може відрізнятися. Для розрахунку ступеня перетворення в неізотермічному процесі використано наступну формулу:
![]() , (2.5)
, (2.5)
де Z – параметр властивості на час заміру; Z0, Z∞ - початкове й кінцеве значення параметру.
Ізотермічний ступінь перетворення вихідного об’єкту дорівнює неізотермічному лише при інваріантному процесі.
Залежність швидкості процесу ω від тиску відображається рівнянням наступного вигляду [63]:
![]() , (2.6)
, (2.6)
де ω - швидкість неізотермічного процесу.
Рівняння подібного вигляду відображують умови проходження реакцій розкладу в закритих системах в герметичних реакційних сосудах при постійному об’ємі газів. При цьому робиться припущення, що продукт системи - ідеальний газ, а його тиск - функція α.
Слід зазначити, що немає принципової різниці в кінетиці процесів, що протікають в ізотермічних та неізотермічних умовах за умови вірного підбору рівнянь для опису процесу. На практиці ж використання різноманітних температурних програм для ізо- та неізотермічних процесів приводить до різниці у ступенях перетворення, що й ускладнює обробку експериментальних даних для кожного виду експерименту.
Диференційні
методи основані на логарифмічній формі
основного кінетичного рівняння
![]() і використанні для константи К рівняння
Ареніуса
і використанні для константи К рівняння
Ареніуса
![]() . Застосування ж різносно-диференційних
методів (РДМ) для визначення кінетичних
параметрів з даних неізотермічного
експерименту обумовлює залучення
рівняння:
. Застосування ж різносно-диференційних
методів (РДМ) для визначення кінетичних
параметрів з даних неізотермічного
експерименту обумовлює залучення
рівняння:
![]() . (2.7)
. (2.7)
Для опису процесу зародишеутворення (що є апріочіактуальним у плані наших досліджень) даний метод може бути використання РДМ доцільно використовувати з наступними перетвореннями: n=1, m=0:
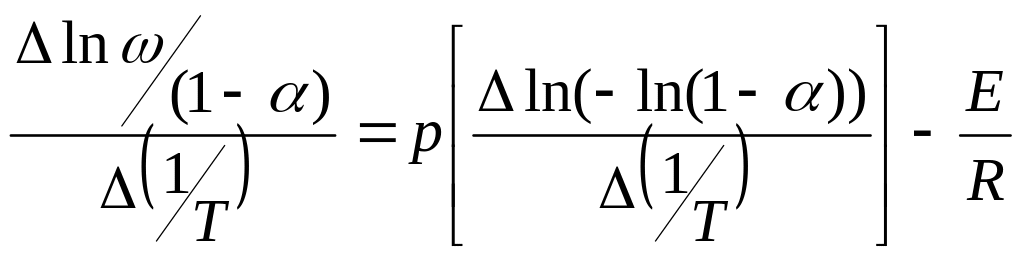 . (2.8)
. (2.8)
Слід відмітити, що точність та адекватність РДМ суттєво залежать від якості експериментальних результатів, особливо при визначенню α й є не дуже точними для початкових та кінцевих значень експериментальних результатів.
Для оцінки енергії активації в нашому випадку є прийнятним рівняння Дойлема [45] :
![]() , (2.9)
, (2.9)
де – f(α j ) i g(α j ) - , Tj - .
Використання інтегральних методів є більш простим, ніж диференційних, що пов’язано з відсутністю в розрахункових рівняннях миттєвої швидкості ω. Водночас складністю є інтегрування константи Кт по температурі.
Одним з інтегральних підходів для аналізу результатів неізотермічних процесів є метод Горовітца і Метцгерера, за яким розрахункове рівняння має вигляд:
![]() , (2.10)
, (2.10)
де θ – різниця значень потічної температури та характеристичної температури Тm.
Оцінку значення енергії активації можна дати за рівнянням:
![]() . (2.11)
. (2.11)
Усі
інтегральні методи можна грубо розділити
на три групи:
![]() ,
,
![]() ,
,
![]() ,
енергію активації можливо знайти з кута
нахилу tg(w). Слід також зазначити, що
функція
,
енергію активації можливо знайти з кута
нахилу tg(w). Слід також зазначити, що
функція
![]() є подвійною логарифмічною функцією, що
суттєво зменшує чуттєвість диференціювання
вихідної функції при описанні механізму
утворення зародків та кристалізації
[45].
є подвійною логарифмічною функцією, що
суттєво зменшує чуттєвість диференціювання
вихідної функції при описанні механізму
утворення зародків та кристалізації
[45].
Представлені вище методи закладено в програму розрахунку, що розроблена співробітниками кафедри ТНР та ЗХТ, за участю автора дисертації, за допомогою якої і велися подальші розрахунки.
РОЗДІЛ 3
ДОСЛІДЖЕННЯ СКЛАДУ, ФІЗИКО- І СТРУКТУРНО- МЕХАНІЧНИХ ТА РЯДУ ФІЗИКО-ХІМІЧНИХ ВЛАСТИВОСТЕЙ КАОЛІНОВОЇ ГЛИНИ, ЩО ВИКОРИСТОВУВАЛАСЬ В РОБОТІ
3.1 Фізико- механічний та деякі фізико-хімічні властивості каолінових глин
Зразки каолінової глини Веселовського і Просянівського родовищ було отримано шляхом усереднення проб, узятих зі сховищ добутою незбагаченої і частково відхідної (після збагачення) сировини відповідних кар’єрів. Зразки являють собою досить дрібнодисперсні порошки сірувато- білого кольору(рис. 3.1).
1
2

Рис. 3.1 - Фотографія зовнішнього виду нативних зразків каолінових глин : 1- Веселовського родовища, 2-Просянівського родовища (збільшення 28х).
Величини визначеної нами істинної і насипної густини (щільності) зразків глини різного стану, а також дані щодо їхньої вологості і температури замерзання наведено в таблиці 3.1.
Порівняння значень насипної щільності зразків каолінової глини при вільній насипці і після утрясання дозволило визначити їхню здатність до ущільнення. За цією здатністю оцінювали таку характеристику глинистих зразків як плинність, а саме :
нерозмелені зразки нативних глин обох родовищ мають „задовільну” плинність;
повітряно-сухі не розмелені зразки обох родовищ - „задовільну” плинність;
не розмелені вологі (15 – 20 % води) зразки- „погану” плинність;
висушені та розмелені до фракції < 0,25 мм зразки- „добру” плинність.
Таблиця 3.1
Фізико-механічні властивості вихідних зразків каолінових глин
№ п/п |
Зразки каолінових глин |
Вологість,% |
Щільність(густина), г/см3 |
Здатність до ущільнення,% |
Кут натурального скосу, град |
Температура замерзання, К |
||
Істин-на |
насипна |
|||||||
При вільній насипці |
При утрясанні |
|||||||
1 |
Веселовське родовище |
|||||||
|
Нативні не розмелені |
10 |
2,4 |
1.23 |
1.4 |
2 |
36 |
265 |
вологі(15-20% води) |
18 |
2,6 |
1.58 |
1.7 |
--- |
32 |
270 |
|
повітряно-сухі не розмелені |
7 |
2,54 |
1.36 |
1.47 |
3,5 |
37 |
263 |
|
висушені та розмелені до фракції <0,25мм |
9 |
2,5 |
1.45 |
1.52 |
8 |
43 |
259 |
|
2 |
Просянівське родовище |
|||||||
|
Нативні не розмелені |
11 |
2,54 |
1.30 |
1.42 |
3 |
36 |
264 |
вологі(15-20% води) |
19 |
2,65 |
1.5 |
1.52 |
0,1 |
31 |
269 |
|
повітряно-сухі не розмелені |
8 |
2,5 |
1.42 |
1.5 |
5 |
37 |
262 |
|
висушені та розмелені до фракції <0,25мм |
8,5 |
2,45 |
1.48 |
1.6 |
7 |
42 |
257 |
|
Результати дисперсійного аналізу зразків каолінових глин представлено на рисунку 3.2.

Рис 3.2 - Дисперсійний склад вихідного зразка каолінової глини Веселовського (1) і Просянівського (2) родовища.
Як видно, основна маса часток вихідних не розмелених зразків каолінових глин обох родовищ має розміри 0,2-0,4 мм.
За результатами досліджень зразків каолінових глин у стані „суміш з рідиною” (водою, розчинами сульфатної кислоти) умовна динамічна межа максимальної текучості( плинності) спостерігається при масовому співвідношенні Т : Р в пульпі, що дорівнює (1 : 2,5). У більш розведених сумішах пластичні деформації практично відсутні . При концентрації твердої фази 40 % (Т : Р ≈ 1 : 1.5) і вище відбувається різке збільшення (до 53Па*с) ефективної в’язкості з утворенням структури глин, здатної включати значні обсяги дисперсійного середовища. У пульпах з концентрацією твердої фази 60 % (Т:Р≈1:0,7) і вище спостерігалася здатність до повільного плину – так званої повзучості[55,85].
3.2 Рекомендації з апаратурного оформлення операцій транспортування, дозування і перемішування каолінових глин та їх суспензій( пульп)
Отримані дані щодо фізико-механічних і структурно-механічних властивостей зразків каолінових глин дозволяють віднести їх до класу гігроскопічних (гігроскопічність 45 %) дрібнодисперсних матеріалів з середньою плинністю. Отже, для здійснення транспортних пересувань і дозувань глин у сухому чи вологому станах необхідна наявність допоміжного вібраційного устаткування, тому що матеріал здатний до злежування. Глини зі значно підвищеною вологістю (40 % і вище ) і глинисті пульпи виявляють аномалії плинності - пластичність, тиксотропію, структурну в’язкість. Отже перед транспортуванням і перемішуванням може бути необхідним репульпувати до вмісту твердої фази не менш 80 %.
З причини високого пилоутворення можна рекомендувати підтримувати каолінову сировину у трохи вологому стані (до вологості не менше 17 %), а перевезення здійснювати у критих транспортних засобах.
Як зазначено вище, при дозуванні навіть сухих глин необхідно використовувати вібраційний пристрій. Для перемішування і дозування глин будь-якої концентрації придатний транспортер, у якому зазначений матеріал рухається в закритому жолобі (типу „редлерів”) за допомогою обертових гвинтових елементів у вигляді стрижнів будь-якого перерізу у формі гвинтових пружин.
Для вивантажування порошкоподібних матеріалів, що здатні до злежування(до яких відносяться і досліджувані каолінові глини), придатне й імпульсне пневмотранспортне устаткування безупинної дії. Для запобігання зависання глин в бункерах можна рекомендувати аеруючі пристрої і віброактиватори (вібраційні побудники)[65].
3.3 Хімічний і мінералогічний склади каолінових глин
3.3.1 Визначення складу каолінових глин хіміко-аналітичними методами
В залежності від родовищ, склад незбагачених каолінових руд, за результатами наших досліджень, змінюється в досить широких межах (%мас.): Al2O3 10-30, SiO2 40-60, K2O до 2, TiO2 0,5-0,9, MgO 1-3 і.т.д.
Результати оптико-мікроскопічних досліджень зразків каолінових глин, які використовувались в наших дослідженнях, вказують на те, що вони являють собою адгезійно зв’язані часточки з нечітко візуально вираженим ступенем дисперсності і без яскраво вираженої кристалічної структури (рис3.1).
Хімічний склад зразків каолінових глин визначали за наведеними вище методиками (п. 2.2.1). Відносна похибка 3-4х рівнобіжних визначень не перевищувала 2 %. Зразки глин, досліджені у роботі, характеризувались величиною рН водної витяжки, рівної 5,5 для каолінової сировини Просянівського родовища та 7,1- для каолінової сировини Веселовського родовища.
Хімічний склад каолінових глин приведений у таблиці 3.2
Таблиця 3.2
Хімічний склад (у перерахунку на оксиди) зразків незбагаченої висушеної каолінової глини (за даними хіміко-аналітичного аналізу)
№ п/п |
Зразки каолінових глин |
Компоненти та їх вміст (%мас.) |
|||||||||
Al2O3 |
Fe2O3 |
CaO |
MgO |
Na2O |
K2O |
SiO2 |
TiO2 |
в.п.п. |
H2O |
||
1 |
Веселовське родовище |
26,80 |
0,92 |
0,64 |
1,27 |
0,38 |
1,77 |
58,40 |
0,82 |
8,90 |
2,25 |
2 |
Просянівське родовище |
38,0 |
0,35 |
0,35 |
0,39 |
0,16 |
0,92 |
46,0 |
------ |
12,6 |
----- |
Хімічний аналіз нерозчинного, у суміші соляної та азотної кислот, залишку каолінової глини показав, що він на 98 % складається з SiO2.
3.3.2 Аналіз зразків каолінових глин інструментальними методами
Інструментальні методи аналізу було використано, по-перше, для визначення точності і репрезентабельності результатів хімічних аналізів, а по-друге, для встановлення мінералогічного складу каолінових глин.
3.3.2.1 Рентгеноструктурні дослідження
Рентгеноструктурні дослідження каоліну Веселовськго та Просянівського родовищ виконувались згідно пункту 2.6.5. Отриману рентгенограму першого з перерахованих зразків родовищ наведено на рисунку 3.3.
Рис. 3.3 – Рентгенограма вихідного каоліну Веселовського родовища.
Рентгенограма каоліну Просянівського родовища майже повністю аналогічна. В обох зразках спостерігаються інтенсивні піки 1.54, 1.669, 2.459, 3.349, 4.27, 7.191, Аº, які відповідають мінеральній структурі кварцу[66]. Піки, які відповідають структурі каолініту, 1.485 ,2.128, 2.238, 2.281, 2.562, 3.581, 4.471, 7.191, Аº. За результатами рентгеноструктурних досліджень можна стверджувати, що основними мінералами в каоліновій глині є кварц та каолініт. Інші мінерали за даним методом визначити практично неможливо, оскільки вони або рентгеноаморфні, або інтенсивність їх піків настільки мала, що їх важко надійно виявити на фоні існуючих.
Мікроскопічні дослідження та точковий аналіз зразків нативних каолінів
Для встановлення структури поверхні та виявлення можливих мікро-домішок у структурі каолінів були проведені мікроскопічні дослідження. Дослідження виконувались на растровому електронному мікроскопі „РЕММА-03” з приставкою мікроаналізу в середовищі інертного газу (азоту). На рис. 3.4 приведена мікрофотографія зразку вихідного каоліну Веселовського родовища при при 500 - кратному збільшенні.
Р

 ис.
3.4 - Мікрофотографія зразку вихідного
каоліну при 500-кратному збільшенні.
ис.
3.4 - Мікрофотографія зразку вихідного
каоліну при 500-кратному збільшенні.
1- точка в якій проводився мікроаналіз.
Дані, щодо результатів аналізу елементного складу зразку нативного каоліну, отриманих методом точкової рентгенівської флуоресценції, приведені в табл. 3.3.
Таблиця 3.3
Результати точкового мікроаналізу нативного каоліна Веселовського родовища
Елемент |
Mg |
Al |
Si |
S |
Ca |
Fe |
Mn |
Cu |
Hg |
Cr |
%,мас.* |
2 |
42 |
53 |
0.2 |
1 |
0.7 |
0.05 |
0.05 |
---- |
---- |
* При аналізі не було враховано вклад елементів, розташованих в таблиці Д.І. Мендлєєва до магнію.
При перерахунку же отриманих відсотків на повний склад (з урахуванням кисню і водню та ін.) було встановлено, що у точковому місцезнаходженні зразок на 92,5 % складався з мінералу каолініту з домішками доломіту та мулиту.
3.3.2.3 Термогравіметричні дослідження каолінової сировини
Каолінову глину підготовану, як описано в розділі 2.2, поміщали в алундовий тигель дериватографа і нагрівали до 1000 0С зі швидкістю 5град/хв. Отримана дериватограма наведена на рисунку 3.5.
Рис. 3.5 - Дериватограма каолінової глини Веселовського родовища в температурному інтервалі 15-900 0С.
На дериватограмі каоліну спостерігається дві значні зміни маси: перша зміна маси спостерігається в температурному інтервалі 55 – 255 0С (втрачається 7 % маси зразку), друга зміна маси спостерігається в інтервалі температур 415 - 615 0С ( втрачається 13,5 % маси зразку).
В інтервалі температур 415-615 0С має поступовий розвиток реакція 3.1.
A l2Si2O5(OH)4 Al2O32SiO2 + 2 H2O; (3.1)
Достовірність перебігу саме цієї реакції доведено шляхом перевірки поступового утворення відповідного продукту прецизійними методами аналізу.
Знаючи
масовтрати в даному інтервалі температур
та приймаючи, що початкова маса суміші
склала 1 г, маса мінералу каолініту
Al2Si2O5(OH)4
складе
![]() грам, що відповідає 96,75 % мінералу
каолініту в каоліновій глині.
грам, що відповідає 96,75 % мінералу
каолініту в каоліновій глині.
3.4 Висновки до розділу 3
1. Проведено систематичне вивчення низькоякісних каолінових глин Веселовського та Просянівського родовищ з точки зору технологічно-підгототвчих заходів до їх наступної переробки у реагент для очищення води. Досліджено фізико-хімічні і фізико-механічні властивості каолінів Веселовського та Просянівського родовищ і відповідних каолінових пульп, а саме: насипну щільність( коливається у межах 1,23-1,5 г/см3) , здатність до ущільнення для повітряно-сухих зразків, відносну щільність, кут натурального скосу (знаходится у межах 31-420), температуру змерзання для вологих зразків, дисперсність, на підставі чого розроблені рекомендації з підбору необхідної апаратури й устаткування для добування каоліну зі сховищ, транспортування, підготовки до використання і дозування.
2. На підставі комплексного вивчення каолінової сировини хімічними, рентгенофазовим, рентгенофлуоресцентним, термогравіметричним, мікроскопічним методами встановлений її склад. Основними компонентами каолінової сировини є каолініт (Al2Si2O5(OH)4)-96 %, кварц (SiO2)-2 % та 1 % домішок різних оксидів ряду елементів (Mg, Ca, Fe, Mn, Cu та ін.). Визначено, що концентраційні показники досліджуваних незбагачених каолінових глин за цільовим компонентом (алюмінієм) є прийнятними для їх використання в процесах одержання коагуляційно-цінної продукції.
РОЗДІЛ 4
ДОСЛІДЖЕННЯ ПРОЦЕСУ ОДЕРЖАННЯ НЕОЧИЩЕНОГО АЛЮМІНІЙ СУЛЬФАТУ
Як було показано в розділі 1 в сучасній літературі відсутня інформація про хімізм отримання неочищеного сульфату алюмінію з каолінової сировини, зустрічаються деякі окремі публікації з даної проблеми проте автори розглядають лише деякий конкретний випадок і не дають якихось закономірностей а лише деякі рецептурні рекомендації. В даному розділі планується всебічно розглянути процес одержання неочищеного сульфату алюмінію з каолінової сировини за допомогою методу сульфатно кислотного спікання, отримати термодинамічні та кінетичні дані, які б описували процес.
