
Кинетика параллельных реакций
Параллельные реакции характеризуются одновременным протеканием в системе несколько реакций, взаимно связанных друг с другом.
Рассмотрим:
Реакцию 1-го порядка, протекающую по схеме:
А ↔ В
Общая скорость реакции равна разности скоростей прямой и обратной реакций:
 (6.32)
(6.32)
где
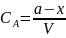 ,
,
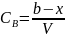 ,
,
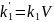 ,
,
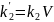
a, b – начальные количества веществ А и В;
V – объем системы;
x – убыль вещества А или прибыль вещества В к моменту времени τ.
Тогда
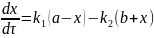 (6.33)
(6.33)
В момент равновесия скорость реакции равна нулю. Отсюда
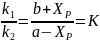 (6.34)
(6.34)
где
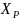 - убыль вещества А или прибыль вещества
В в момент равновесия.
- убыль вещества А или прибыль вещества
В в момент равновесия.
К – константа равновесия.
Преобразуем уравнение (6.33) в следующий вид:
 (6.35)
(6.35)
где
 (6.36)
(6.36)
интегрирование уравнения (6.35) дает выражение
 (6.37)
(6.37)
Из
уравнений (6.34) и (6.37) можно найти значения
 и
и
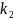 .
Разделив числитель и знаменатель в
(6.36) на
и учитывая (6.34), получим выражение для
расчета постоянной L:
.
Разделив числитель и знаменатель в
(6.36) на
и учитывая (6.34), получим выражение для
расчета постоянной L:
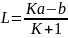 (6.38)
(6.38)
Реакцию 1-го порядка, протекающую по следующей схеме:
В
А
D
Общая скорость превращения вещества А может быть выражена:
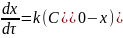 (6.39)
(6.39)
где C0 – начальная концентрация вещества А;
x – изменение концентрации вещества А к моменту времени τ;
k – константа скорости превращения вещества А по обоим направлениям.
После интегрирования:
 (6.40)
(6.40)
Пусть x=y+z, где y – концентрация вещества В, z – концентрация вещества D.
Тогда
 (6.41)
(6.41)
Скорость превращения вещества А в вещество В выражается уравнением
 (6.42)
(6.42)
а скорость превращения вещества А в вещество В
 (6.43)
(6.43)
Подставляем уравнения (6.39), (6.42), (6.43) в (6.41) получим
 (6.44)
(6.44)
Из (6.40) и (6.44) находим
 (6.41)
(6.41)
Разделим (6.42) на (6.43):
 (6.42)
(6.42)
где Н – коэффициент, который не зависит от времени.
Из уравнений (6.41) и (6.43) находим значения и двух параллельных реакций.
Аналогичным путем можно получить кинетические уравнения для расчета констант скоростей параллельных реакций, если исходное вещество реагирует по трем направлениям.
Кинетика последовательных реакций
К последовательным реакциям относят реакции с промежуточными стадиями. В подавляющем большинстве случаев механизм многостадийной реакции неизвестен. Поэтому составляют вероятную схему протекания реакции по стадиям. По этой схеме получают общее кинетическое уравнение суммарной реакции. Если расчетное кинетическое уравнение согласуется с опытными данными, то предложенный механизм реакции является вероятным, но не достоверным, т.к. не исключена возможность, что существует другая схема протекания реакции, которая приведет к такому же кинетическую уравнению.
Расчет кинетики последовательных реакций в общем виде довольно сложен. Кинетика процесса описывается системой дифференциальных уравнений. По мере увеличения числа стадий возрастает число дифференциальных уравнений.
Простейшую последовательную реакцию можно представить схемой:
k1 k2
A → B → C
Константа скорости первой реакции k1 отличается от константы скорости второй реакции k2 на один порядок.
Вещество В – промежуточное вещество.
Пусть обе стадии являются лимитирующими.
В начальный момент времени τ=0:
А – a моль
В – 0 моль
С – 0 моль
В момент времени τ:
А – х моль
В – у моль
С – 0 моль
Осталось
А mA=(a-x) моль
В mB=(x-y) моль
С mC=y моль
Скорость превращения вещества А можно выразить уравнением
 (6.43)
(6.43)
После интегрирования
 (6.44)
(6.44)
Отсюда
 (6.45)
(6.45)
 (6.46)
(6.46)
Скорость превращения вещества В в вещество С описывается уравнением:
 (6.47)
(6.47)
Подставляя х из (6.46) в (6.47) получим
 (6.48)
(6.48)
Интегрируем уравнение (6.48):
 (6.49)
(6.49)
Вычитая уравнение (6.49) из (6.45) получим
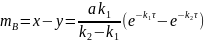 (6.50)
(6.50)
Зависимость mA, mB, mC, х от времени τ представлена на рисунке. Количество промежуточного продукта mB меняется по кривой с максимумом во времени.
τmax
τи

x
mC
mB
mA
τ




mi
Из
условия
 находим
находим
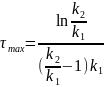 (6.51)
(6.51)
где
 - время, соответствующее наибольшему
содержанию вещества В.
- время, соответствующее наибольшему
содержанию вещества В.
Подставляем (6.51) в (6.50)
 (6.52)
(6.52)
где

Из уравнения (6.52) видно, что наибольшее накопление вещества В не зависит от констант скоростей обеих последовательных реакций, а зависит только от их соотношения. Чем меньше значение r, тем быстрее идет первая реакция, тем выше лежит максимум кривой mB и тем ближе он к начальному моменту времени.
Скорость накопления продукта реакции С в начале процесса очень мала. Потом этот начальный период сменяется периодом быстрого развития химического превращения и называется периодом индукции. Период индукции наблюдается не только в реакциях с несколькими лимитирующими стадиями, но и в цепных и автокаталитических реакциях.
В период индукции доля вещества С по сравнению с веществом А
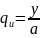 (6.53)
(6.53)
Можно считать, что вещество С еще практически отсутствует в реакционной массе.
В соответствии с уравнением (6.49) можно рассчитать период индукции τи:
 (6.54)
(6.54)
Последовательная реакция протекает по схеме:
k1 k2
A → B ↔ C
k2'
Если k1 << k2, то лимитирующей является первая стадия реакции, а во второй стадии успевает установиться равновесие, практически не отличающееся от равновесного.
Пусть в момент времени τ прореагировало х молей вещества А. Тогда
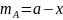 (6.55)
(6.55)
Уравнение скорости первой лимитирующей стадии:

 (6.56)
(6.56)
Интегрируем
(6.57)
(6.58)
(6.59)
Константу равновесия второй стадии К2 можно представить уравнением
 (6.60)
(6.60)
Из уравнения (6.60) выражаем
 (6.61)
(6.61)
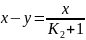 (6.62)
(6.62)
Подставляем уравнение (6.59) в (6.61) и (6.62) находим
 (6.63)
(6.63)
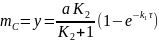 (6.64)
(6.64)
Из рисунка видно, что промежуточное вещество В постепенно накапливается при протекании реакции. Оно находится в равновесии с веществом С
x
mC
mB
mA
τ
mi



Последовательная реакция протекает по схеме:
k1 k2
A ↔ B → C
k1'
Если k1 >> k2, то лимитирующей является вторая стадия реакции.
Пусть в начальный момент времени τ=0 находится a молей вещества А и b молей вещества В. При этом
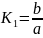 (6.65)
(6.65)
Прореагировало х молей вещества А, тогда
(6.66)
Поскольку на первой стадии сохраняется равновесие, практически не отличающееся от равновесного, то
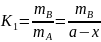 ,
,
 )
(6.67)
)
(6.67)
При этом
 (6.68)
(6.68)
Кинетика второй стадии определяет закономерность протекания всего процесса:

 (6.69)
(6.69)
Интегрируем (6.69)
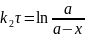 (6.70)
(6.70)
 (6.71)
(6.71)
 (6.72)
(6.72)
Тогда можно записать
 (6.73)
(6.73)
 (6.74)
(6.74)
Количество
исходного вещества А и промежуточного
вещества В в процессе реакции уменьшается
до нуля, а количество вещества С
приближается к предельному значению
 .
.
τ
x
mC
mB
mA
mi




Сравнивая все рисунки для трех случаев протекания последовательных реакций можно сделать вывод о том, что вид кинетических кривых различен и по их виду можно различить вид протекания последовательной реакции.
