
Тема №6 Химическая кинетика
Химическая кинетика изучает закономерности протекания химических реакций во времени. Основная задача химической кинетики заключается в установлении связи между скоростью химической реакции и условиями ее проведения. Химическая кинетика стремится раскрыть механизм химических реакций, т.е. выяснить из каких элементарных стадий состоит химический процесс, как эти стадии связаны между собой, какие промежуточные частицы принимают участие в реакции.
Элементарная стадия – превращение одной или нескольких находящихся в контакте частиц (молекул, радикалов, ионов) в другие частицы за время порядка 10-13 с.
Механизм химической реакции – совокупность элементарных стадий, из которых складывается процесс превращения исходных веществ в конечные вещества.
Промежуточные вещества – вещества (молекулы, ионы, радикалы и т.д.), образующиеся в одних и исчезающие в других стадиях химического процесса, а реакции образования и расходования этих веществ называются промежуточными реакциями.
Кинетическая схема химической реакции – совокупность предполагаемых элементарных стадий, из которых складывается суммарный химический процесс.
Простая реакция – одностадийный процесс. В простой реакции осуществляется элементарный акт взаимодействия между молекулами с преодолением одного энергетического барьера. Простая реакция состоит из одних и тех же элементарных актов.
Гомогенная реакция – реакция, протекающая в одной фазе.
Гетерогенная реакция – протекает на поверхности раздела фаз.
Если одна стадия сложной реакции – гомогенная, а другая – гетерогенная, то эта реакция называется гомогенно-гетерогенной.
Различают гомофазные и гетерофазные реакции.
Понятия гомофазности, гетерофазности и гомогенности, гетерогенности следует отличать.
Так, например, реакция нейтрализации водного раствора щелочи раствором кислоты является гомогенным гомофазным процессом.
Реакция взаимодействия газообразных HCl и NH3 с образованием кристаллов NH4Cl – гомогенно-гетерофазной.
Реакция образования гипса по реакции
(CaSO4)2·H2O +3H2O → 2CaSO4·2H2O
где участники реакции образуют 3 фазы и реакция идет на поверхности раздела (CaSO4)2·H2O и воды – реакция гетерогенно-гетерофазная.
В химической кинетике реакции классифицируют по кинетическому параметру – по молекулярности – по числу частиц, принимающих участие в элементарной стадии химической реакции:
- мономолекулярные;
- бимолекулярные;
- тримолекулярные.
Скорость химической реакции служит важнейшей количественной характеристикой химического взаимодействия.
Скорость химической реакции – изменение количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема:
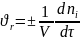 (6.1)
(6.1)
где V – объем реакционной массы;
ni – число молей компонентов;
τ – время реакции.
Знак «+» относится к продуктам реакции, знак «-» - к исходным веществам.
При постоянном объеме:
 (6.2)
(6.2)
где
 – молярная концентрация i-го
компонента.
– молярная концентрация i-го
компонента.
Таким образом, скорость гомогенной реакции, протекающей в закрытой системе при постоянном объеме, по определенному компоненту может быть рассчитана как производная от концентрации этого компонента по времени:
 (6.3)
(6.3)
Скорость
реакции в целом
 и скорость по отдельному компоненту
и скорость по отдельному компоненту
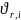 связаны следующим образом:
связаны следующим образом:
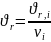 (6.4)
(6.4)
Для реакции aA + bB → cC + dD
 (6.5)
(6.5)
Для определения скорости достаточно следить за изменением какого-либо одного компонента. Изменения концентраций других участников реакции можно найти по соотношениям стехиометрических коэффициентов. Так, скорость реакции по компоненту А

связана со скоростями по другим компонентам соотношением:
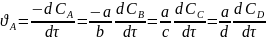 (6.6)
(6.6)
Таким образом, за скоростью реакции можно следить по любому веществу и выбор обусловлен удобством измерения. В ходе реакции определяют: концентрации веществ или свойства, которые пропорциональны их концентрациями. Применяют химические и физические методы. При использовании химических методов определения концентрации (например, титрование) реакция должна быть остановлена. Физические методы (измерение электрической проводимости, угла вращения плоскости поляризации и т.д.) являются более предпочтительными, т.к. не требуют остановки реакции.
В процессе определения концентрации компонента в различные моменты времени получают зависимость с=f(τ) – кинетическую кривую. Кинетическую кривую обычно строят в координатах:

τ
1/C



τ
lnC


τ
С




Скорость реакции в данный момент времени определяют дифференцированием зависимости с=f(τ). На графической зависимости скорости определяют по тангенсу угла касательной к кинетической кривой:
β
α
τ
С












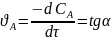 (6.7)
(6.7)
 (6.8)
(6.8)
Средняя скорость, например, по реагенту А за интервал времени (τ2 – τ1) равна:
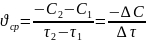 (6.9)
(6.9)
Определив скорость реакции по компоненту, по соотношению (6.4) вычисляют скорость реакции в целом.
Математическое соотношение, выражающее зависимость скорости химической реакции от концентрации веществ, называют кинетическим уравнением:
 (6.10)
(6.10)
В зависимости от реакций функция f может быть более или менее сложной.
Для элементарных реакций кинетическое уравнение описывается законом действия масс:
aA + bB → cC + dD
 (6.11)
(6.11)
где k – константа скорости химической реакции.
Скорость химической реакции в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ, возведенных в степени, равные соответствующим стехиометрическим коэффициентам.
Для сложных реакций, состоящих из несколько элементарных стадий, которые могут быть описаны одним стехиометрическим уравнением aA + bB → cC + dD, кинетическое уравнение записывают в виде:
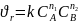 (6.12)
(6.12)
где ni – частный порядок реакции по i-му компоненту.
Общий порядок реакции
n = n1 + n2 (6.13)
Для многих сложных многостадийных реакций кинетическое уравнение может быть определено только из экспериментальных данных и его нельзя получить из стехиометрического уравнения реакции.
Показатели степени определяют из опытных данных, они могут принимать целые, дробные, нулевые значения.
В простых реакциях, протекающих в одну стадию, порядок реакции и молекулярность совпадают и имеют целые положительные значения.
Для большинства реакций порядок реакции меньше молекулярности. Порядок реакции зависит от условий протекания процесса. Так, при избытке одного из реагентов его концентрация в течение реакции остается практически постоянной, и порядок реакции будет на единицу меньше, чем ожидаемый в соответствии с механизмом реакции.
Хотя большинство реакций можно описать кинетическим уравнением вида:
 (6.14)
(6.14)
известны реакции, кинетические уравнения которых гораздо сложнее.
