- •Органическая химия
- •Программа цели и задачи учебной дисциплины, её место в учебном процессе Цели и задачи изучения дисциплины
- •Краткая характеристика дисциплины, её место в учебном процессе
- •Связь с предшествующими дисциплинам
- •Связь с последующими дисциплинами
- •Содержание дисицплины ( Лекционный курс)
- •При выполнении задания рекомендуется использовать следующую литературу:
- •Конспеты лекций Органические соединения
- •Значение органической химии
- •Основные положения теории химического строения Бутлерова:
- •Формулы строения
- •Структурные изомеры
- •Стереоизомеры
- •Горение.
- •Галогенирование алканов.
- •Алкены, алкадиены, алкины (ненасыщенные углеводороды).
- •Номенклатура алкенов
- •Общие свойства ненасыщенных (непредельных) углеводородов
- •Другие реакции алкенов и алкинов.
- •Отличительные реакции алкинов.
- •Методы получения алкинов
- •Система является циклической Цикл является плоским
- •Ниже приведены примеры ароматических систем
- •Номенклатура ароматических соединений.
- •Номенклатура замещенных бензолов
- •Окисление
- •Методы получения бензола и его гомологов
- •Система является циклической Цикл является плоским
- •Производные углеводородов Галогеналканы.
- •Строение галогеналканов
- •Способы получения галогеналканов
- •Реакции нуклеофильного замещения при насыщенном атоме углерода Реакции нуклеофильного замещения (примеры)
- •Одноатомные спирты
- •Строение и свойства спиртов
- •Получение спиртов
- •Свойства спиртов
- •Алкоголяты
- •Основность спиртов
- •Водородные связи
- •Нуклеофильность
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Простые эфиры
- •Получение
- •Свойства
- •Этиленоксид
- •Краун-эфиры
- •Металлоорганические соединения
- •Получение металлорганических соединений
- •Свойства реактивов Гриньяра Основность
- •Нуклеофильность
- •Альдегиды и кетоны
- •Альдегиды
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Карбоновые кислоты
- •Получение
- •5. Гидролиз функциональных производных (сложных эфиров, ангидридов, галогенангидридов, амидов). Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Азотсодержащие соединения (амины)
- •Номенклатура
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды. Белки
- •Химические свойства
- •Углеводы. Генетический d- ряд сахаров
- •Генетический d- ряд сахаров
- •Построение формул Хеуорса для d- галактозы
- •Рассмотрим построение формул Хеуорса на примере d- галактозы.
- •Получение
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •Дисахариды
- •Полисахариды
- •Крахмал
- •Целлюлоза (клетчатка)
- •Электронные эффекты и механизмы некоторых реакций
- •Нуклеофильное замещение у насыщенного атома углерода sn1 и sn2 реакции.
- •Мономолекулярное нуклеофильное замещение (sn1)
- •Бимолекулярное нуклеофильное замещение (sn2)
- •Реакции элиминирования (е1,е2)е1е2
- •Мономолекулярное элиминирование е1.
- •Бимолекулярное элиминирование е2.
- •Реакции конденсации
- •Реакция Канниццаро
- •Бензоиновая конденсация
- •Конденсация Перкина
- •Кляйзена-Шмидта реакция
- •Cложноэфирная конденсация
- •Конденсация Дикмана
- •Нуклеофильное замещение у насыщенного атома углерода sn1 и sn2 реакции.
- •Примеры решения задач
- •Перечень вопросов по самоконтролю Углеводороды
- •Алкилгалогениды и спирты
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Электрофильное и нуклеофильное замещение в ароматическом ряду
- •Амины и диазосоединения
- •1.Расположите следующие азотсодержащие соединения по возрастанию их основности:
- •Перечень вопросов к экзамену по всему курсу
Этиленоксид
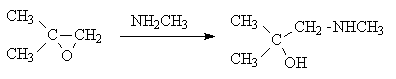
Среди циклических простых эфиров выделяется своей реакционной способностью этиленоксид. В лаборатории его получают из этиленхлоргидрина действием щелочи, а в промышленности – пропусканием смеси этилена и кислорода над нагретым до 250оС серебром с добавками солей бария, кальция или кадмия. Напряжение валентных углов в молекуле этиленоксида очень велико, поэтому его кольцо легко раскрывается под действием нуклеофилов, особенно, в кислой среде. Этиленоксид реагирует с водой в присутствии протонных кислот. Продуктами гидратации являются этиленгликоль, протонированная форма которого дает продукты его конденсации – полиэтилен-гликоли.
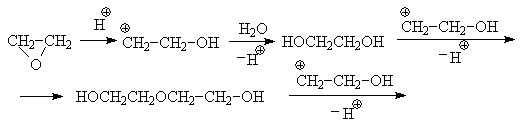
Превращения этиленоксида с протонными кислотами можно остановить на стадии винилового спирта и получить таким образом ацетальдегид.
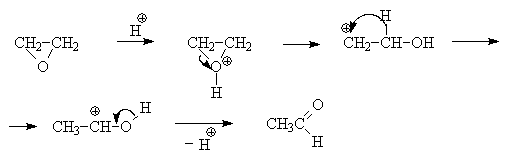
Этиленоксид в присутствии кислот Льюиса может участвовать в реакции Фриделя-Крафтса с ароматическими соединениями, образуя -гидроксиэтилпроизводные.
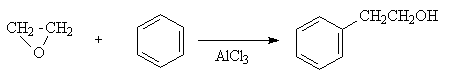
Действие других нуклеофилов на окись этилена так же приводит к раскрытию цикла и присоединению нуклеофила к метиленовому углероду и протона к кислороду.
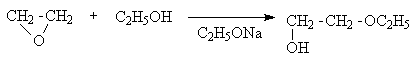
Краун-эфиры
В органическом синтезе находят широкое применение макроциклические простые эфиры. Их называют краун-эфирами за схожесть графических формул с изображениями короны; в названии краун-эфиров используются два числа – первое обозначает общее количество атомов в цикле, второе – количество атомов кислорода. Краун-эфиры обладают уникальной способностью удерживать соли щелочных металлов в растворе в малополярных органических средах, что возможно за счет координирования катиона металла внутри "короны". Практически для каждого катиона существует свой краун-эфир, размер кольца которого пропорционален радиусу этого иона.
Металлоорганические соединения
Металлоорганическими соединениями называют такие производные углеводородов, в которых один из атомов водорода замещен металлом. Наиболее часто в практике применяют органические соединения магния, лития, натрия, а так же цинка, ртути и др. Названия образуются из соответствующих алкила и металла.
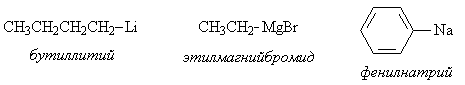
Получение металлорганических соединений
Прямое превращение углеводорода в металлоорганическое соединение возможно лишь в тех случаях, когда он обладает повышенной СН-кислотностью, т.е. способен к образованию стабилизированного карбаниона, чему способствуют эффект сопряжения и наличие электроноакцепторных групп. Кроме того, необходимо, чтобы металл обладал высокой активностью как, например, натрий.
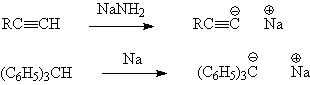
Поэтому синтез металлоорганических соединений значительно чаще производят путем замещения галогена на металл. Прямой путь, т.е. взаимодействие металла с галогени-дом, не всегда дает положительные результаты и иногда замещение проводят взаимодействием галогенопроизводного не с металлом, а с другим, более активным, металлоорганическим соединением.
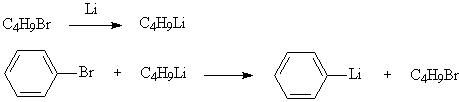
Натрий- и литийорганические соединения отличаются наиболее высокой реакционной способностью, они самовозгораются при соприкосновении с кислородом воздуха. В связи с этим их получают и работают с ними исключительно в инертной атмосфере (азот, аргон), при низких температурах. В лабораторной практике часто используют смешанные магнийорганические соединения, называемые реактивами Гриньяра. Они достаточно стабильны, не требуют, как правило, для работы с ними специальных условий и, в то же время, обладают весьма высокой реакционной способностью.
![]()
Получают их, действуя на магниевые опилки или стружку органическим галогенидом в среде абсолютного диэтилового эфира, предохраняя реакционный сосуд от доступа влаги . Легкость этой реакции возрастает в ряду F < Cl < Br < J, что согласуется с ростом поляризуемости связи углерод-галоген. Внедрение магния по связи С-галоген можно представить как процесс одноэлектронного переноса. Все участники превращения сближены и промежуточные свободные частицы не образуются (реакция протекает в клетке растворителя).
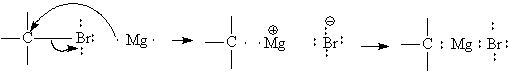
Реакция Вюрца при образовании магнийорганических соединений наблюдается лишь в тех случаях, когда используют очень активное галогенопроизводное, например, аллилхлорид. Напротив, при взаимодействии алкилгалогенидов с натрием она является основным процессом. Вопрос о строении реактивов Гриньяра окончательно не решен, но высказываются предположения о том, что они образуют координационные соединения с эфиром и находятся в равновесии с соответствующими симметричными соединениями. Это подтверждается, например, тем, что при добавлении диоксана к эфирному раствору реактивов Гриньяра бромид магния выпадает в осадок. Обративший на этот факт внимание Шленк предложил считать, что алкилмагний-галогениды находятся в равновесии с диалкилмагнием и галогенидом магния (равновесие Шленка).
![]()
Для изображения структуры реактивов Гриньяра в эфирном растворе предложено несколько вариантов, например: