- •Органическая химия
- •Программа цели и задачи учебной дисциплины, её место в учебном процессе Цели и задачи изучения дисциплины
- •Краткая характеристика дисциплины, её место в учебном процессе
- •Связь с предшествующими дисциплинам
- •Связь с последующими дисциплинами
- •Содержание дисицплины ( Лекционный курс)
- •При выполнении задания рекомендуется использовать следующую литературу:
- •Конспеты лекций Органические соединения
- •Значение органической химии
- •Основные положения теории химического строения Бутлерова:
- •Формулы строения
- •Структурные изомеры
- •Стереоизомеры
- •Горение.
- •Галогенирование алканов.
- •Алкены, алкадиены, алкины (ненасыщенные углеводороды).
- •Номенклатура алкенов
- •Общие свойства ненасыщенных (непредельных) углеводородов
- •Другие реакции алкенов и алкинов.
- •Отличительные реакции алкинов.
- •Методы получения алкинов
- •Система является циклической Цикл является плоским
- •Ниже приведены примеры ароматических систем
- •Номенклатура ароматических соединений.
- •Номенклатура замещенных бензолов
- •Окисление
- •Методы получения бензола и его гомологов
- •Система является циклической Цикл является плоским
- •Производные углеводородов Галогеналканы.
- •Строение галогеналканов
- •Способы получения галогеналканов
- •Реакции нуклеофильного замещения при насыщенном атоме углерода Реакции нуклеофильного замещения (примеры)
- •Одноатомные спирты
- •Строение и свойства спиртов
- •Получение спиртов
- •Свойства спиртов
- •Алкоголяты
- •Основность спиртов
- •Водородные связи
- •Нуклеофильность
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Простые эфиры
- •Получение
- •Свойства
- •Этиленоксид
- •Краун-эфиры
- •Металлоорганические соединения
- •Получение металлорганических соединений
- •Свойства реактивов Гриньяра Основность
- •Нуклеофильность
- •Альдегиды и кетоны
- •Альдегиды
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Карбоновые кислоты
- •Получение
- •5. Гидролиз функциональных производных (сложных эфиров, ангидридов, галогенангидридов, амидов). Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Азотсодержащие соединения (амины)
- •Номенклатура
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды. Белки
- •Химические свойства
- •Углеводы. Генетический d- ряд сахаров
- •Генетический d- ряд сахаров
- •Построение формул Хеуорса для d- галактозы
- •Рассмотрим построение формул Хеуорса на примере d- галактозы.
- •Получение
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •Дисахариды
- •Полисахариды
- •Крахмал
- •Целлюлоза (клетчатка)
- •Электронные эффекты и механизмы некоторых реакций
- •Нуклеофильное замещение у насыщенного атома углерода sn1 и sn2 реакции.
- •Мономолекулярное нуклеофильное замещение (sn1)
- •Бимолекулярное нуклеофильное замещение (sn2)
- •Реакции элиминирования (е1,е2)е1е2
- •Мономолекулярное элиминирование е1.
- •Бимолекулярное элиминирование е2.
- •Реакции конденсации
- •Реакция Канниццаро
- •Бензоиновая конденсация
- •Конденсация Перкина
- •Кляйзена-Шмидта реакция
- •Cложноэфирная конденсация
- •Конденсация Дикмана
- •Нуклеофильное замещение у насыщенного атома углерода sn1 и sn2 реакции.
- •Примеры решения задач
- •Перечень вопросов по самоконтролю Углеводороды
- •Алкилгалогениды и спирты
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Электрофильное и нуклеофильное замещение в ароматическом ряду
- •Амины и диазосоединения
- •1.Расположите следующие азотсодержащие соединения по возрастанию их основности:
- •Перечень вопросов к экзамену по всему курсу
Строение и свойства спиртов
Длины связей и валентные углы в молекуле метанола приведены на рисунке
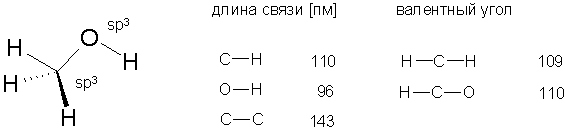
Неподеленные электронные пары атома кислорода расположены на sp3-гибридных орбиталях. ОН-связь имеет такую же длину как в молекуле воды, связь С-Н чуть короче, чем в метане (111,2 пм). Наличие гидроксильной группы придает спиртам свойства как кислот, так и оснований. Кислотность спиртов обусловлена полярностью связи О-Н, о чем позволяют судить величины дипольных моментов, имеющие значения: μС-О = 0,9 D, μ О-Н = 1,5 D. Эти величины указывают на значительное разделение зарядов в гидроксильной группе, благодаря чему водород весьма легко протонизуется. pKaнизших алифатических спиртов близка к pKa воды. В то же время, полярность связи С-О обусловливает возможность замещения гидроксила, о чем будет сказано позднее. Суммарный дипольный момент метанола равен 1,69 D и не соответствует сумме диполей С-О и гидроксила. Это можно объяснить вкладом неподеленных пар электронов кислорода и направлен к кислороду

Неподеленные пары электронов атома кислорода делают спирты слабыми основаниями, способными реагировать с протоном и различными кислотами Льюиса.
Получение спиртов
Способы получения спиртов можно объединить в группы по типам реакций замещения, присоединения и окисления-восстановления. К первой группе относятся гидролиз алкилгалогенидов, сложных эфиров а также реакции замещения других функциональ-ных групп. Гидролиз галогеналканов проводят в условиях реакций нуклеофильного замещения, подбирая их таким образом, чтобы устранить или хотя бы уменьшить возможность протекания побочной реакции элиминирования, приводящей к образо-ванию алкенов.

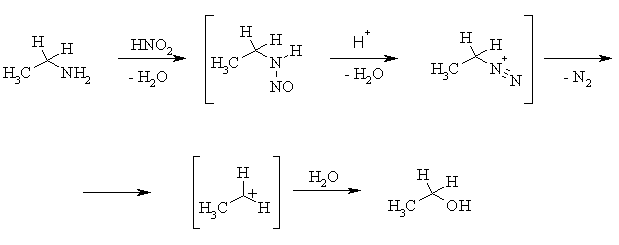
Широко распространен способ получения спиртов действием азотистой кислотой на первичные алкиламины. В этом превращении первоначально образуется нестабильная алифатическая соль диазония, реагирующая с любым имеющимся в избытке нуклеофилом, в данном случае – с водой.
К реакциям присоединения, приводящим к образованию спиртов, относятся гидратация алкенов, присоединение металлоорганических соединений,к карбонильной группе, гидрирование оксосоединений и карбоновых кислот и др.
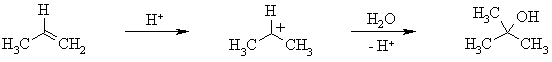
Гидратация алкенов протекает в присутствии кислот по правилу Марковникова.
Взаимодействие реактивов Гриньяра и других металлоорганических соединений с альдегидами позволяет получать спирты различного строения и имеет важное препаративное значение. В случае использования формальдегида образуются первичные спирты, из других альдегидов образуются вторичные, а из кетонов – третичные спирты, например:

или
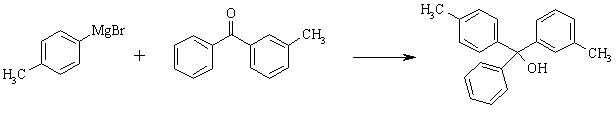
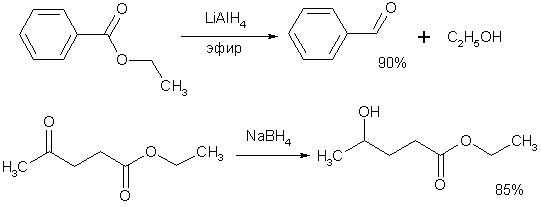
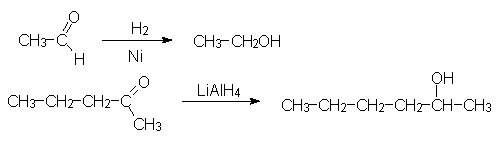
Гидрирование карбонильных соединений проводят как водородом на катализаторе, так и комплексными гидридами металлов (LiAlH4, NaBH4).
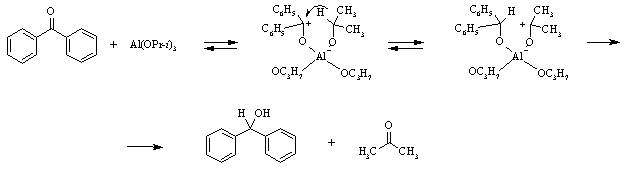
Другой способ получения спиртов восстановлением альдегидов и кетонов основан на реакции гидридного обмена, где источником гидрид-иона является алкоголят вторичного спирта, чаще всего изопропилат алюминия (Реакция Меервейна-Пондорфа-Верлея). Эта реакция обратима, поэтому для ее полного протекания необходимо использование большого количества спирта-восстановителя, причем последний должен превращаться в более легко кипящий, чем восстанавливаемое оксосоединение, продукт, чтобы его можно было удалять путем отгонки.
Кроме альдегидов и кетонов, восстановлению до спиртов поддаются также производные карбоновых кислот – хлорангидриды и сложные эфиры.
Можно привести схему восстановления хлорангидрида LiAl(OBut)3H
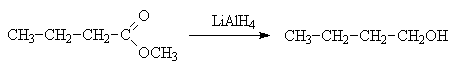
Более активный алюмогидрид лития восстанавливает в эфирах оксокислот как алкилкарбоксигруппу, так и карбонильный фрагмент, боргидрид натрия сложноэфирную группу не затрагивает.