
Билет12 вопр1
Изомеризация
Изомеризация - это процесс, в результате которого происходит перераспределение связей или групп внутри данной молекулы. В результате этого процесса не происходит ни присоединения, ни отрыва ат0мов от молекулы субстрата. В отличие от гидрирования и всех других каталитических реакций, этот процесс приводит к изменению только структуру молекулы не изменяя форму субстрата. К двум наиболее хорошо изученным типам изомеризации, катализируемым гомогенными комплексами переходных металлов, относятся - структурная изомеризация алкенов, которая сопровождается перераспределением двойных связей углерод - углерод внутри молекулы и скелетная изомеризация, которая сопровождается перераспределением одинарных или двойных связей углерод-углерод внутри карбоциклической, обычно разветвленной молекулы.
7.3.1. Изомеризация алкенов
Почти все d-элементы, способные координировать алкены, в определенной степени катализируют изомеризацию алкенов. Однако, как и большинство других гомогенных каталитических реакций, наибольший интерес представляют комплексы металлов VIII группы, т.е. Ru, Os, Co, Rh, lr, Ni, Pd, Pt. В ходе изомеризации, катализируемой этими металлами, алкен претерпевает два процесса активации, т.е. активацию путем координации и активацию путем присоединения. Процесс активации путем присоединения непосредственно отвечает за перемещение двойной связи или, другими словами, за перемещение атомов водорода. Миграция двойной связи, по существу, происходит путем сдвига водорода алкильной группы, расположенной рядом с двойной связью, к атому а - углерода двойной связи:

Именно этот процесс катализирует комплекс переходного металла. Формально можно выделить два основных типа реакций изомеризации, а именно: реакции, протекающие через образование металлалкильных интермедиатов, и реакции, протекающие через образование металлаллильных интермедиатов.
Билет12 вопр2
Изомеризация, протекающая через образование
металлалкильных интермедиатов
Весьма
важными частицами в осуществлении этой
реакции являются металлгидридные
комплексы. Координация алкена приводит
к образованию гидридоолефинового
комплекса металла, который быстро
претерпевает реакцию миграции гидридного
лиганда с образованием металлалкильного
соединения. Эта миграция, вероятно,
протекает через четырехцептровое
переходное состояние и идентична
той, которая была описана ранее для
процесса каталитического гидрирования.
Почти во всех гидридоолефиновых
комплексах переходных металлов в случае,
когда алкен и гидридная группа находятся
взаимно в цис-положении, миграция
гидридного лиганда протекает
исключительно быстро. Образовавшееся
металлалкильное соединение может
претерпевать
 -элиминирование
(рис. 7.1).
-элиминирование
(рис. 7.1).
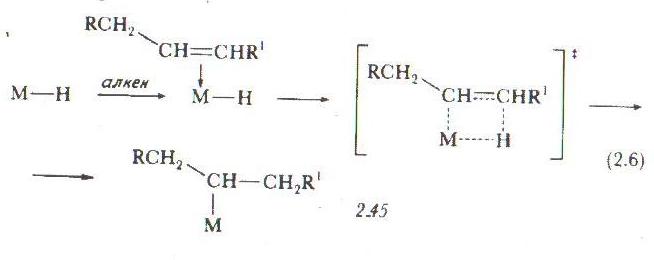
Рис. 7.1. Образование металлалкильного интермедиата
Известен
каталитический цикл для изомеризации
алкенов, катализируемый
 Металлгидридный комплекс может быть
либо добавлен в реакционную среду
как таковой, либо образован из комплекса
металла и подходящего источника водорода,
такого как газообразный водород или
водный раствор кислоты. Указанный
родиевый комплекс является примером
первого способа, a
Металлгидридный комплекс может быть
либо добавлен в реакционную среду
как таковой, либо образован из комплекса
металла и подходящего источника водорода,
такого как газообразный водород или
водный раствор кислоты. Указанный
родиевый комплекс является примером
первого способа, a
 и
и
 - примерами второго типа. Каталитически
активным является соединение с 16
валентными электронами - транс-
- примерами второго типа. Каталитически
активным является соединение с 16
валентными электронами - транс-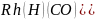 ,
которое образуется из 18-элек-тронного
бипирамидального комплекса родия при
диссоциации третичного фосфинового
лиганда. В этом каталитическом цикле
водород присоединяется к менее
замещенному атому углерода двойной
связи, т.е. присоединение происходит по
правилу Марковникова. Противоположный
способ присоединения, против правила
Марковникова, не должен приводить к
перемещению двойной связи, поскольку
-элиминирование
водорода может привести только к
образованию олефинового комплекса.
,
которое образуется из 18-элек-тронного
бипирамидального комплекса родия при
диссоциации третичного фосфинового
лиганда. В этом каталитическом цикле
водород присоединяется к менее
замещенному атому углерода двойной
связи, т.е. присоединение происходит по
правилу Марковникова. Противоположный
способ присоединения, против правила
Марковникова, не должен приводить к
перемещению двойной связи, поскольку
-элиминирование
водорода может привести только к
образованию олефинового комплекса.
Согласно электронным представлениям, следует ожидать, что направление присоединения зависит от заряда на атоме водорода. Увеличение локализации отрицательного заряда на атоме водорода должно благоприятствовать присоединению против правила Марковникова, и наоборот. По стерическим соображениям линейный алкильиый комплекс более предпочтителен, чем разветвленный. Это связано с тем, что, поскольку оба комплекса содержат два объемистых трифенилфосфиновых лиганда, существенным оказывается любое уменьшение стерических затруднений. В случае комплекса родия оба фактора облегчают присоединение против правила Марковникова, и поэтому ни этот, ни большинство других комплексов родия не являются достаточно хорошими катализаторами изомеризации. Фактически скорость изомеризации в присутствии газообразного водорода пренебрежимо мала по сравнению со скоростью гидрирования.
С
другой стороны, в каталитической системе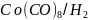 каталитически активным соединением
служит
каталитически активным соединением
служит
 .
Это соединение образуется путем
гемолитического присоединения водорода:
.
Это соединение образуется путем
гемолитического присоединения водорода:

Водород
в
кислотный, а не гидридный, так как в
водном растворе СоН(СО)4
ведет себя как сильная кислота, диссоциируя
с образованием карбонилатного иона
 .
Таким образом,
более склонен присоединяться к
терминальным олефинам по правилу
Марковникова, чем
.
Таким образом,
более склонен присоединяться к
терминальным олефинам по правилу
Марковникова, чем
 .
.
Фактически, при определенных условиях проведения реакции гидро-формилирования, катализируемой , благодаря изомеризующей способности кобальтового катализатора образующаяся смесь альдегидов по существу не зависит от изомерного состава исходного олефина.
Билет13 вопр1.
Карбонилы металлов
Химия карбонилов металлов за последнее время получила большое развитие, что объясняется исключительно важными теоретическими результатами, полученными при их исследовании, а также их все более широким практическим использованием.
Большой интерес представляет открытие карбонильных кластеров и производных карбонилов со связью переходный металл - непереходный металл и карбонильных комплексов с кратными связями между металлами [5]. Карбонилы металлов из необычных для начала XX века соединений металлов с монооксидом углерода, имеющих к тому же непонятное для ученых того времени строение, трансформировались к настоящему времени в весьма распространенный класс соединений, лежащий на стыке органических и неорганических веществ и относящихся к металлорганическим соединениям со связью металл-углерод.
Необычайный интерес к химии карбонилов металлов оправдан не только фантастическими возможностями синтеза самых разнообразных гомологических рядов и семейств карбонильных соединений, но и каталитической активностью карбонилов. Сейчас практически нет таких каталитических процессов, в которых то или иное карбонильное соединение не проявило своей активности. Каталитическая активность карбонилов объясняется образованием «поверхности» энергетически неустойчивых (возбужденных) атомов переходных металлов в результате частичного отторжения электронов металла лигандами.
Карбонилы металлов Мх(СО)у имеют связь металл-углерод и поэтому относятся к металлорганическим соединениям, но они подчиняются (за некоторыми исключениями) и правилу эффективного атомного номера (ЭАН) Сиджвика для комплексных соединений.
При рассмотрении самых различных карбонильных соединений необходимо придерживаться классификации, учитывающей, с одной стороны, характер центральных атомов переходных металлов (их число, природу и др.), а с другой - природу лигандов (СО или их заместителей), а также наличие или отсутствие заряда у карбонильных комплексов. Ниже приведена классификация карбонилов металлов.
1. Истинные гомолигандные карбонилы металлов Мх(СО)у, у которых центральный атом переходного металла связан лишь с лигандами СО. Они могут быть как одноядерными, например Ni(CO)4, Fe(CO)5, Mo(CO)6, Сг(СО)6, так и миогоядерными, например Re2(CO)10, Со,(СО)8, Rh6(CO)lfj. Истинные карбонилы содержат одинаковые атомы переходных металлов в нульвалент-ном состоянии, электронейтральны и почти все диамагнитны.
2. Гетеролигандные карбонилы металлов, являющиеся фактически производными истинных карбонилов металлов, у которых часть дигандов СО замещена другими лигандами, имеют общую формулу Mx(CO)nLm и подразделяются на карбонилгидриды (L = водород), карбонилгалогениды (L = галоген), кабонилнитрозилы (L = N0), карбониламины (L = NR3), карбонилфосфины (L = PR3), карбониларсины (L = AsR3), карбонилсульфиды (L = SR,) и др. Формула Mx(CO)nLm отражает состав как обычных замещенных карбонилов металлов, так и карбонильных соединений п- и я-комплексов.
3. Полиметаллические ионные карбонильные соединения, представляющие собой анионные и катионные карбонильные комплексы и их производные - карбонилметаллат-анионы, например в Na[Mn(CO)5]_, и карбонил-металл-катионы, например в [Мп(СО)6]+[А1С14]~.
4. Полиметаллические карбонильные кластеры - производные карбонилов металлов ковалентного характера с о-связью двух или более различных металлов, как переходных, например (CO)5MnRe(CO)5, так и переходных и непереходных, например VHgTa(CO)6. В ряде публикаций эти соединения именуют смешанными карбонилами металлов [6].
