
- •Вопрос 26.
- •Параметры равновесия
- •Вопрос 27.
- •Биохимические окислительно-восстановительные процессы
- •Вопрос 28. Окислительно-восстановительная зональность подземных вод, ее разновидности и причины.
- •Вопрос 29.
- •Изотопные процессы
- •Радиоактивный распад
- •Космогенные радиоактивные изотопы
- •Вопрос 30. Методы выражения изотопного состава отдельных элементов. Изотопные стандарты. Изотопное фракционирование и смешивание. Равновесное фракционирование
- •Изотопное смешивание
- •Определение возраста подземных вод
Вопрос 26.
Равновесие между водой и гидрофобными жидкостями. Коэффициенты растворимости и распределения органических компонентов и методы их определения
Массообмен с гидрофобными веществами
Гидрофобными веществами (hydrophobic matter) в данном случае считаются любые преимущественно жидкие скопления неполярных практически нерастворимых в воде, в основном органических соединений. В из составе преобладают углерод (80-90% веса) и водород (10-15%). Заметную роль играют кислород, сера и азот. Они могут быть подвижными жидкими (нефти, нефтепродукты) , неподвижными вязкими (мальты, асфальты и пр.) и даже твердыми (торф, уголь, гумус почв и т.д.). Все рассматриваемые гидрофобные вещества, прежде всего, удобно разделить на неподвижные и подвижные.
Неподвижные
гидрофобные вещества представлены
преимущественно сложными органическими
образованиями, остатками планктона и
растительности. У поверхности наиболее
концентрированной формой такого
органического вещества являются торф
и гумус почвенного слоя. На больших
глубинах имеет место преимущественно
рассеянное органическое вещество,
весовая доля которого обычно не превышает
1-2%. Относительное содержание этого
органического вещества в породах
характеризуется средним весовым
содержание его углерода
 ,
которое
в
глинистых породах равно приблизительно
1%, в песчано-алевритовых и мергелях -
0,4%, в карбонатах – 0,2%. К неподвижными с
некоторой долей условности можно отнести
и тяжелые твердые битумы, асфальты и
озокериты. Таким образом, неподвижное
гидрофобное вещество по существу
представляет собой органическое вещество
породы или осадков.
,
которое
в
глинистых породах равно приблизительно
1%, в песчано-алевритовых и мергелях -
0,4%, в карбонатах – 0,2%. К неподвижными с
некоторой долей условности можно отнести
и тяжелые твердые битумы, асфальты и
озокериты. Таким образом, неподвижное
гидрофобное вещество по существу
представляет собой органическое вещество
породы или осадков.
Подвижные гидрофобные жидкости это сложные растворы, в составе которых преобладают органические вещества, алкановые, нафтеновые и ароматические углеводороды с высоким молекулярным весом. Большинство их компонентов в чистом виде и в стандартном состоянии находится в жидком и парообразном состояниях. Эти жидкости выделяет их миграционная подвижность, которая в значительной степени зависит от их плотности и вязкости. Они, как и подземные газы, способны мигрировать относительно подземной воды, и аккумулироваться в виде скоплений, в частности залежей нефти. Присутствие гидрофобных жидкостей на малых глубинах связано, как правило, с загрязнением геологической среды нефтепродуктами (бензин, керосин, дизельное топливо, толуол и т.д.).
Параметры равновесия
Взаимодействие гидрофобной жидкости с породой, водой и подземным газом в условиях относительно низких температур связано с физической сорбцией. Часть её поглощается породой в количесве так называемой минимальной или остаточной насыщенности (residual saturation). Вторая часть испаряется (улетучивается) в подземный газ, и третья часть растворяется в воде. Все эти процессы и составляют массообмен гидрофобной жидкости с окружающей геологической средой.
При
достижении абсорбционного равновесия
любой компонент i
распределяется так, что его парциальные
давления во взаимодействующих средах
равны одной и той же величине pi.
Поэтому для оценки равновесного
распределения компонента i
в сравниваемых средах достаточно
сопоставить его парциальные давления
в них. Поэтому
отношение
 служит показателем степени насыщения
воды компонетом i
относительно гидрофобной жидкости, а
величина
служит показателем степени насыщения
воды компонетом i
относительно гидрофобной жидкости, а
величина
 - индексом их неравновесности.
При равновесии степень насыщения равна
1, а индекс – нулю. Если степень насыщения
больше 1 (индекс <0), вода перенасыщена
относительно гидрофобной жидкости,
если меньше (индекс > 0), вода недонасыщена.
- индексом их неравновесности.
При равновесии степень насыщения равна
1, а индекс – нулю. Если степень насыщения
больше 1 (индекс <0), вода перенасыщена
относительно гидрофобной жидкости,
если меньше (индекс > 0), вода недонасыщена.
Чаще
показателем равновесности воды и
гидрофобной жидкости по компоненту i
чаще используют коэффициент распределения
 в
уравнениях (II-351). Если
в
уравнениях (II-351). Если
 ,
то компонент i
мигрирует
из воды в гидрофобную жидкость, а если
,
то компонент i
мигрирует
из воды в гидрофобную жидкость, а если
 ,
то наоборот. При достижении равновесия
,
то наоборот. При достижении равновесия
 .
.
В связи с этим для оценки поведения неполярных компонентов на границе воды и гидрофобная жидкость необходимо сравнить либо их парциальные давления, либо концентрации в мольных долях.
При полном равновесии суммы парциальных давлений компонентов в воде и в гидрофобной жидкости равны:
 ,
(II‑1)
,
(II‑1)
где
 -
даление насыщения гидрофобной жидкости.
Парциальное давление любого неполярного
компонента в воде, как и газового, можно
определить с помощью коэффициентов
растворимости Генри или Бунзена,
определенных при парциальном давлении
1 атм, по уравнениям (II-352) и (II-379),
соответственно. Как правило, используют
коэффициент Генри.
-
даление насыщения гидрофобной жидкости.
Парциальное давление любого неполярного
компонента в воде, как и газового, можно
определить с помощью коэффициентов
растворимости Генри или Бунзена,
определенных при парциальном давлении
1 атм, по уравнениям (II-352) и (II-379),
соответственно. Как правило, используют
коэффициент Генри.
Необходимо помнить, что у компонентов с давлением насыщенного пара меньше 1 атм величины коэффициентов растворимости не соответствуют самой растворимости в стандартных условиях. При стандартных условиях эти компоненты растворяются в воде при парциональном давлении равном давлению насыщенного пара Pi0, что заметно ниже 1 атм. Поэтому коэффициент растворимости Генри для таких компонентов равен связан с растворимостью уравнением:
 ,
(II‑2)
,
(II‑2)
где
 -
величина растворимости компонента i
при его парциальном давлении равном
Pi0.
Коэффициент
растворимости Генри, как и в случае
газовых компонентов, выражают в
атм·л·мл-1,
в атм·л·моль-1,
но чаще всего в атм·м3·моль-1.
Если величина давления насыщенного
пара
выражена в мм ртутного столба, а
растворимость в весовых единицах, то
-
величина растворимости компонента i
при его парциальном давлении равном
Pi0.
Коэффициент
растворимости Генри, как и в случае
газовых компонентов, выражают в
атм·л·мл-1,
в атм·л·моль-1,
но чаще всего в атм·м3·моль-1.
Если величина давления насыщенного
пара
выражена в мм ртутного столба, а
растворимость в весовых единицах, то
 ,
(II‑3)
,
(II‑3)
где
 -
давление насыщенного пара в мм рт.ст.,
Mi
-
молекулярный вес гидрофобного компонента,
а Cв,max,i
– растворимость того же компонента в
мг·л-1.
Достаточно часто коэффициент Генри
выражают безразмерной величиной, как
соотношение концентраций, выраженных
в одинаковых единицах (коэффициент
растворимости Оствальда):
-
давление насыщенного пара в мм рт.ст.,
Mi
-
молекулярный вес гидрофобного компонента,
а Cв,max,i
– растворимость того же компонента в
мг·л-1.
Достаточно часто коэффициент Генри
выражают безразмерной величиной, как
соотношение концентраций, выраженных
в одинаковых единицах (коэффициент
растворимости Оствальда):
 ,
(II‑4)
,
(II‑4)
где
 –
безразмерный коэффициент растворимости
Генри, а P
=1
атм.
–
безразмерный коэффициент растворимости
Генри, а P
=1
атм.
Как водно из уравнений (II-392 и II-393), коэффициент растворимости Генри (HM,i) пропорционален величине давления насыщенного пара и может служить мерой летучести неполярных компонентов. Поэтому Дональд Маккей и Янг Шу (Mackay, D., Shiu W.Y., 1981) предлогают использовать его для классификации компонентов по летучести:
Высоко летучие, если Hi > 10-3 атм·м3·моль-1 (испарение быстрое),
Летучие, если Hi находится в интервале 10-3 to 10-5 атм·м3·моль-1 (испарение значительное),
Полулетучие, если Hi находится в интервале 10-5- 3×10-7 атм·м3·моль-1 (испарение медленное),
Нелетучие, если Hi <3×10-7 атм·м3·моль-1 (испарение не значительное).
При низких концентрациях равновесные парциальные давления органических соединений в воде, гидрофобной жидкости и подземном газе равны, и согласно уравнениям II-352, II-374 и II-384, соблюдают равенство:
 .
(II‑5)
.
(II‑5)
Для определения парциального давления любого органического соединения i необходимы сведения по величинам его растворимости или коэффициентов растворимости о в подземной воде и гидрофобном веществе. Эти величины для пресной воды можно найти в справочной литературе. Давления насыщенного пара и параметры растворимости для наиболее актуальных компонентов приведены в таблице II-39. Как правило, давление насыщенного пара дается в мм рт. ст., реже в Па или атм. 1 мм рт. ст. равен 133,3224 Па или 1,31610-3 атм.
Однако, во-первых, природные воды представляют собой растворы электролитов, что необходимо учитывать,согласно уравнению II-364. Растворимость неполярных соединений с ростом минерализации падает. Так например, коэффициент Сеченова в нормальных условиях равен для фенола 0,133, для бензола и нитробензола 0,166, для анилина 0,130 (Сергеева В.Ф., 1965). Во-вторых, природные гидрофобные вещества представляют собой сложные растворы, для которых параметры раствормости отдельных компонентов, как правило, отсутствуют. В связи с этим определение парциального давления в природных органических растворах представляет собой слишком сложную задачу, решение которой связано с использованием уравнений состояния. Поэтому при оценке равновесности подземных вод и гидрофобных растворов органических веществ препочитают пользоваться коэффициентами распределения.
Рисунок II-1. Молекулярная масса, давление насыщенного пара, растворимость и коэффициент углеродного распределения некоторых органических компонентов.
Соединения |
Формула |
Mi |
Давление насыщенного пара в мм Hg при 20°C. |
Коэффициент растворимости Генри, атм·м3моль-1 (оС) |
Растворимость при 1 атм, Моль/л при 20°C. |
ГАЛОГЕНИЗИРОВАННЫЕ УГЛЕВОДОРОДЫ |
|||||
Метил хлорид (Хлорометан) |
CH3Cl |
50,48 |
5 атм (г) |
5,84·10-3 (17,5) оС |
0,005556 0,0077-0,0071 |
Метилендихлорид (Дихлорметан) |
CH2Cl2 |
84,93 |
349 |
3·10-3 1,31·10-3 17,5 оС |
0,0065 0,00426 |
Хлороформ (Трихлорметан) |
СНСl3 |
119,38 |
160 |
4,8 ·10-3 2,46·10-3 17,5 оС |
4,39·10-2 6,7·10-2 6,87·10-2
|
Тетрахлорметан |
CCl4 |
|
90 |
2,3 ·10-2 2,11·10-2 17,5 оС |
5,15·10-3
|
Четыреххлористый углерод |
CCl4 |
153,82 |
91 |
21,1·10-3 17,5 оС |
5,2·10-3 5,1·10-3
|
Бромоформ |
СНВr3 |
252,75 |
5,6 (25°С) |
5,8 ·10-4 с |
1,27·10-2 1,19·10-2-1,26·10-2
|
Метилбромид |
CH3Br |
94,94 |
1420 (г) |
|
9,48·10-3
|
1,1-Дихлорэтан |
CHCl2CH3 |
98,97 |
180 |
4,3 ·10-3 с 3,89·10-3 17,5 оС |
5,51·10-2 5,56·10-2 5,56·10-2
|
1,2-Дихлорэтан |
CH2ClCH2Cl |
98,97 |
61 |
9,1·10-4 с
|
8,82·10-2 8,78·10-2 8,78·10-2
|
1,1 -Дихлорэтен |
H2C=CCl |
61,49 |
500 |
— |
6,50·10-3
|
Хлорэтан (этилхлорид) |
CH2ClCH3 |
64,51 |
1000 (г) |
8,46 ·10-3 17,5 оС |
8,90·10-2
|
Транс-1,2-дихлорэтен |
CHCl=CHCl |
96,94 |
200 (14°C) |
4,2 ·10-2 с 6,6·10-3 17,5 оС |
6,37·10-3 6,19·10-3 6,19·10-3
|
1,1,1-Трихлорэтан |
ССl3СН3 |
131,39 |
100 |
18 ·10-3 12·10-3 17,5 оС |
7,31·10-3 33,49·10-3 3.65·10-3-33,49·10-3
|
Трихлорэтилен (TCE) |
Cl2C=CHCl |
131,39 |
60 |
10 ·10-3 6,32·10-3 17,5 оС |
7,89·10-3 8,37·10-3 25 оС 8,37·10-3 |
1,1,2-Трихлорэтан |
CH2ClCHCl2 |
133,40 |
19 |
7,4 ·10-4 с |
3,38·10-2 3,37·10-2 3,37·10-2
|
1,1,2,2-Тетрахлорэтан |
CHCl2CHCl2 |
167,86 |
5 |
|
17,28·10-3 17,28·10-3
|
1,2,2,2-Тетрахлорэтан |
CCl3CHCl2 |
|
|
|
|
Тетрахлорэтилен |
CCl2=CCl2 |
165,82 |
|
|
0,90·10-3-1.21·10-3
|
Пентахлорэтан |
CCl3CCl3 |
236,74 |
3,4 |
|
0,21·10-3 22 оС |
Гексахлорэтан |
ССl3СН3 |
|
|
|
|
Тетрахлорэтилен (Перхлорэтилен) |
С12С=СС12 |
165,82 |
14 |
8,3 ·10-3 11,7·10-3 17,5 оС |
2,22·10-3 0,90·10-3 25 оС |
Винил хлорид (Хлорэтен) |
С H2=СHС1 |
62,49 |
2660 25 оС (г) |
19,3·10-3 17,5 оС |
1,76·10-5 25 оС 1,76·10-5-0,96·10-3 |
1,1-Дихлорэтен (Винилиденхлорид) |
СС12=СH2 |
96,94 |
500 |
19,1·10-3 17,5 оС |
|
Цис-1,2-Дихлорэтен |
CHCl=CHCl |
96,94 |
200 25 оС |
2,65·10-3 17,5 оС |
8,25·10-3 |
1,2-Дихлорпропан |
|
|
|
|
2700мг/л |
1,3-Дихлорпропилен |
|
|
|
|
2700-2800 мг/л |
Этилбензол |
C6H5CH2CH3 |
106,17 |
|
|
1,43·10-3 |
Хлорбензол |
C6H5Cl |
112,56 |
8,7 |
|
3,98·10-3 |
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ |
|||||
Бензол |
C6H6 |
78,12 |
76 74,8 |
5,5 ·10-3 |
1,82·10-2 1,05·10-2-2,3·10-2
|
Фенол |
C6H5OH |
94,12 |
0,2 |
3,0 ·10-7 с |
8,77·10-1 |
Хлорбензол |
C6H5C1 |
112,56 |
8,8 |
2,6 ·10-3 с |
4,45·10-3 3,98·10-3-4,44·10-3
|
Этилбензол |
C6H5C2H5 |
106,17 |
7 |
8,7 ·10-3 |
1,06·10-3 |
Толуол |
С6Н5СН3 |
92,14 |
22 |
5,7 ·10-3 |
5,08·10-3 5,80·10-3
|
o-Ксилол |
С6Н4(СН3)2 |
106,17 |
5 |
5,3 ·10-3 |
1,24·10-3 |
ДРУГИЕ ОРГАНИЧЕСКИЕ РАСТВОРИТЕЛИ |
|||||
Ацетон |
СН3-СО-СН3 |
58,08 |
89(5°C) |
— |
|
Диэтиловый эфир |
С2Н5OС2Н5 |
|
442 |
5,1·10-4 с |
1,14 |
Тетрагидрофуран |
С4Н8O |
72,10 |
|
— |
|
1,4-Диоксан |
O(CH2-CH2)2O |
|
30 |
— |
|
1-Октанол |
CH3(CH2)6CH2OH |
130,23 |
|
|
|
BIOCIDES |
|
|
|
|
|
Пентохлорфенол |
СбСl5ОН |
|
1.1·10-4 |
3,4·10-6 |
4,26·10-5 |
DDT |
(СlС6Н4)2СНССl3 |
|
1·10-7 |
3,8·10-5 |
3,46·10-9 |
Линдан (гексахлорциклогексан) |
СбН6Cl6 |
290,86 |
9,4·10-6 |
4,8·10-7 |
2,58·10-5 |
2атм-м3/моль;
с -показывает величины, рассчитанные по данным давления пара и растворимости.
Скорректированные из( Jackson R.E. et al., 1985, ).
Коэффициенты распределения любого компонента между подземной водой и гидрофобной жидкостью в условиях равновесия обычно характеризуют соотношением концентраций в мольных долях (см. уравнение II-351). Если в условиях низких давлений, например, в зоне аэрации, приравнять парциальные давления компонента i в подземном газе и гидрофобной жидкости и воде, то получим:
 .
(II‑6)
.
(II‑6)
Это уравнение позволяет связать равновесные концентрации компонента i в сравниваемых средах. Действительно, согласно равенствам (II-351) и (II-389) уравновешенные коэффициенты распределения компонента i в этих трех средах связаны уравнением:
 ,
(II‑7)
,
(II‑7)
где
 -
коэффициент распределения компонента
i
между гидрофобной жидкостью и подземным
газом. В стандартных условиях (при P
=1
атм) этот коэффициент распределения
численно равен величине давления
насыщенного пара.
-
коэффициент распределения компонента
i
между гидрофобной жидкостью и подземным
газом. В стандартных условиях (при P
=1
атм) этот коэффициент распределения
численно равен величине давления
насыщенного пара.
Так
как органические вещества, с которыми
взаимодействуют подземные воды, как
правило, представляют собой сложные
смешанные растворы неизвестного состава,
в практике геохимических и экологических
исследований вместо коэффициента
распределения для чистого органического
растворителя
используют коэффициент распределения
 ,
определенный для конкретного природного
органического вещества.
Этот коэффициент
распределения абсорбции органическим
веществом
представляет
собой отношение весовых уравновешенных
концентраций отдельного неполярного
компонента i
в
органическом веществе и, согласно
уравнениям I-18 и II-388,
равен:
,
определенный для конкретного природного
органического вещества.
Этот коэффициент
распределения абсорбции органическим
веществом
представляет
собой отношение весовых уравновешенных
концентраций отдельного неполярного
компонента i
в
органическом веществе и, согласно
уравнениям I-18 и II-388,
равен:
 .
(II‑8)
.
(II‑8)
Здесь
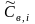 -
весовая концентрация компонента i
в
органическом веществе,
νср
– средний молекулярный объем органического
вещества, см3·моль-1,
γw
– удельный вес воды, г·мл-1,
m
- минерализация воды, мг·л-1,
18,016 г моль-1-
молекулярная масса H2O.
-
весовая концентрация компонента i
в
органическом веществе,
νср
– средний молекулярный объем органического
вещества, см3·моль-1,
γw
– удельный вес воды, г·мл-1,
m
- минерализация воды, мг·л-1,
18,016 г моль-1-
молекулярная масса H2O.
Однако,
достаточно часто содержание органического
вещества часто выражено через содержание
его органического углерода
 .
В таком случае необходимо иметь
представление о равновесной концентрации
компонента i
отнесено веса не всего органического
вещества, а только его углерода. Согласно
опытным данным вес органического
вещества пород приблизительно в 1,724
раза превосходит вес углерода в нём.
Отсюда и концентрация любого
абсорбированного компонента i
по отношению к весу органического
углерода
должна быть приблизительно в 1,724 раз
больше величины
.
Поэтому можно считать, что коэффициент
распределения абсорбции органическим
углеродом
равен:
.
В таком случае необходимо иметь
представление о равновесной концентрации
компонента i
отнесено веса не всего органического
вещества, а только его углерода. Согласно
опытным данным вес органического
вещества пород приблизительно в 1,724
раза превосходит вес углерода в нём.
Отсюда и концентрация любого
абсорбированного компонента i
по отношению к весу органического
углерода
должна быть приблизительно в 1,724 раз
больше величины
.
Поэтому можно считать, что коэффициент
распределения абсорбции органическим
углеродом
равен:
 .
(II‑9)
.
(II‑9)
Величины
 и
и
 ,
очевидно, зависят от состава воды и
природы органического вещества. Можно
полагать, что их величины ростут с
минерализацией, согласно уравнению
II-364. Но коэффициенты Свыченко для
природных органических веществ
отсутствуют. Замечено, что абсорбции
так же препятствует увеличение pH .
Исследования показывают, что величина
коэффициента
растет
и вследствие увеличением зрелости
органического вещества. Поэтому,
например, величина
бензола в разных
условиях может
меняться от 32 до 97. Однако, влияние этих
факторов пока исследовано недостаточно,
и
наиболее достоверными являются величины
,
полученные непосредственно экспериментально
для каждого конкретного случая.
,
очевидно, зависят от состава воды и
природы органического вещества. Можно
полагать, что их величины ростут с
минерализацией, согласно уравнению
II-364. Но коэффициенты Свыченко для
природных органических веществ
отсутствуют. Замечено, что абсорбции
так же препятствует увеличение pH .
Исследования показывают, что величина
коэффициента
растет
и вследствие увеличением зрелости
органического вещества. Поэтому,
например, величина
бензола в разных
условиях может
меняться от 32 до 97. Однако, влияние этих
факторов пока исследовано недостаточно,
и
наиболее достоверными являются величины
,
полученные непосредственно экспериментально
для каждого конкретного случая.
При отсутствии экспериментальных данных для определения величин коэффициентов распределения и широко используется метод аналогий. Для этого в качестве стандартного аналога, как правило, используют октанол, т.е. октиловый спирт (CH3(CH2)6CH2OH), который является хорошим органическим растворителем, но плохо растворим в воде. Коэффициент равновесного распределения любого компонента i между чистой водой и октанолом будем называть коэффициентом распределения абсорбции октанолом (Octanol-water partition coefficient). Его величина определяется, как отношение равновесных весовых концентраций одного неполярного компонента i в октаноле и в воде:
 .
(II‑10)
.
(II‑10)
Здесь
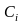 и
и
 – концентрация компонента i
в октаноле и в воде соответственно.
Величина этого коэффициента безразмерная.
В случае ионизируемых органических
соединений, предворительно устанавливается
такое pH раствора, при котором они
нейтральны. Этот
коэффициент первоначально использовали
как
показатель возможного накопления
токсичных компонентов в жировых тканях
организмов. Октанол
играет роль липидов (жиров), а вода –
окружающей среды. Благодаря этому
величины коэффициента распределения
абсорбции октанолом
определены
почти для всех опасных органических
соединений и их можно легко найти в
справочной литературе.
– концентрация компонента i
в октаноле и в воде соответственно.
Величина этого коэффициента безразмерная.
В случае ионизируемых органических
соединений, предворительно устанавливается
такое pH раствора, при котором они
нейтральны. Этот
коэффициент первоначально использовали
как
показатель возможного накопления
токсичных компонентов в жировых тканях
организмов. Октанол
играет роль липидов (жиров), а вода –
окружающей среды. Благодаря этому
величины коэффициента распределения
абсорбции октанолом
определены
почти для всех опасных органических
соединений и их можно легко найти в
справочной литературе.
Исследования
показали, что величины растворимости
органических соединений в воде CM,max,i,
а также коэффициенты
,
и
 в наибольшей степени зависят от их
природы и в меньшей степени от растворителя.
Поэтому все эти параметры связаны между
собой функциональными зависимостями,
которые позволяет использовать один
параметр для оценки другого.
в наибольшей степени зависят от их
природы и в меньшей степени от растворителя.
Поэтому все эти параметры связаны между
собой функциональными зависимостями,
которые позволяет использовать один
параметр для оценки другого.
Как правило, чем выше растворимость компонента i в воде, тем ниже его растворимость в органическом веществе. Поэтому величины и находятся в обратной зависимости от величин растворимости компонентов в воде CM,max,i. Это позволяет при отсутствии экспериментальных данных оценивать величину либо по величинам коэффициента растворимости в воде, либо по октанол-водномоу коэффициенту распределения) , либо даже по самой структуре молекулы абсорбата.
Существует много эмпирических уравнений, описывающих обратную зависимость от величины растворимости Cв,max,i. Последним и наиболее общим среди них является уравнение, предложенное Дж. Хассеттом и др. в 1983 году (Hassett J.J., и др., 1983):
 ,
(II‑11)
,
(II‑11)
где растворимость Cв,max,i измеряется в мгл-1.
Однако величины растворимости органических веществ в природной воде, в свою очередь, зависят от условий эксперимента (температуры, чистоты вещества и ионной сила раствора). Так как эти параметры не всегда публикуются, использование чужих значений растворимости не всегда достаточно корректно.
Величины коэффициентов распределения и разных органических компонентов, как правило, связаны между собой прямой зависимостью. Предложено много эмпирических уравнений этой зависимости от для разных соединений или их групп. Гидрогеологи и инженеры, которые хотят определить величину , оказываются в ситуации выбора, какое уравнение использовать. Наилучшим выбором является уравнение для соединений близких к исследуемому по составу и свойствам. Наиболее общим является эмпирическое уравнение Дж. Хассетта и др. (Hassett J.J. et al., 1983):
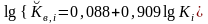 ,
(II‑12)
,
(II‑12)
где имеет размерность см3г-1, а - безразмерная величина.
Пример II‑11.
Вследствие аварии в зону аэрации проник чистый жидкий толуол (C6H5CH3). Надо определить его максимальную концентрацию в газах зоны аэрации при 20°C. Молекулярный вес толуола 92,1 г/моль, его давление насыщенного пара 0,029 атм.
Мольная
доля чистого толуола
 =1. Поэтому согласно закону Рауля
максимальное парциальное давление
толуола не превысит 0,029 атм. Тогда весовая
концентрация толуола в газе
=1. Поэтому согласно закону Рауля
максимальное парциальное давление
толуола не превысит 0,029 атм. Тогда весовая
концентрация толуола в газе
 =
= =111
мг/л
=111
мг/л
Пример II‑2.
Вследствие аварии в зону аэрации проникло большое количество трихлорэтилена (Cl2C=CHCl), который имеет молекулярный вес MТХЭ =131,4 г/моль, давление насыщенного пара P0 =60 мм рт .ст. Грунт в зоне аэрации имеет пористостью n =30%, коэффициенты остаточного насыщения водой KТХЭ =0,33 и трихлорэтиленом KТХЭ= 0,17. Необходимо определить максимальное весовое количетво трихлорэтилена, которое содержится в подземном газе 1 м3 грунта.
Коэффициент
насыщенности грунта газом равен
 =1-
KТХЭ-
KТХЭ=1-
0,33- 0,17 =0,50. Поэтому доля подземного газа
в объеме грунта равна n∙
=0,30∙0,50=0,15.
=1-
KТХЭ-
KТХЭ=1-
0,33- 0,17 =0,50. Поэтому доля подземного газа
в объеме грунта равна n∙
=0,30∙0,50=0,15.
Парциальное давление чистого трихлорэтана в подземном газе
 =7999
Па
=7999
Па
Парциальное давление позволяет определить весовое содержание трихлорэтилена
 =
= =436,7
г/м3.
=436,7
г/м3.
Следовательно, в подземном газе 1 м3 зоны аэрации будет содержаться 453,7∙0,15= 68 г трихлорэтилена.
С другой стороны, существуют обратная зависимость между величиной и растворимостью компонентов в воде. Эта зависимость для разных классов жидких и твердых органических соединений показано на Рис. II-71. С.Т. Хиу и другие (Chiou C.T. et al., 1982) предложили для всех этих компонентов уравнение регрессии:
 ,
(II‑13)
,
(II‑13)
где
 –
коэффициент растворимости
компонента
i
в воде, мольл-1атм-1.
–
коэффициент растворимости
компонента
i
в воде, мольл-1атм-1.
|
Рисунок II-2. Зависимость между растворимостью в воде и коэффициентами октанол/водного распределения для разных органических соединений: 1-спирты, 2-кетоны, 3-сложные эфиры, 4-эфиры, 5-галогеналкилы, 6-алкины, 7-алкены, 8-ароматические, 9-алканы, 10-органофосфаты и 11-полихлорированные бифенилы (ПХБ) и ДДТ. ( Chiou, C.T, et al., 1982). |
Пример II‑32.
При загрязнении зоны аэрации некоторое количество трихлорэтилена (Cl2C=CHCl) растворилось в воде остаточного насыщения. Грунт в зоне аэрации имеет пористостью n =30%, и коэффициент остаточного насыщения водой Kw =0,33. Коэффициент растворимости трихлорэтилена в воде BТХЭ=1100 мг∙л-1∙атм-1 . Надо определить максимальное весовое количетво трихлорэтилена, которое может содерать вода в 1 м3 грунта.
Количество воды в кубическом метре зоны аэрации равно 1∙0,30∙0,33=0,10 м3. Максимальное количество трихлорэтана в 1 м3 воды в нормальных условиях равно произведению его коэффициента растворимости на величину внешнего давления (1 атм), т.е. 1∙1100 =1100 г/м3. Поэтому общее количество этого компонента в 1 м3 грунта будет равно 0,10∙1100=110 г/м3.
Пример II‑4.
В зону аэрации проник нефтепродукт. Пористость грунта n=0,2, Коэффициенты остаточного насыщения равны для воды 0,5, для нефтепродукта 0,05. После этого в воздухе зоны аэрации обнаружили присутствие бензола со средней концентрацией 503 мкг/л. Необходимо определить наибольшее суммарное содержание бензола в 1 м3 зоны аэрации.
Нефтепродукт
имеет средний молекулярный вес Mср=226
г/моль и плотность ρср=0,810
г/см3.
У бензола молекулярный вес MБ=78,12,
плотность
ρБ=0,88
г/см3,
давление насыщенного пара
 =76 мм рт. ст., и коэффициент растворимости
в воде SБ
=1,82·10-2
моль∙л-1∙атм-1.
=76 мм рт. ст., и коэффициент растворимости
в воде SБ
=1,82·10-2
моль∙л-1∙атм-1.
Доля объема газовой фазы в 1 м3 зоны аэрации равна 0,2∙(1-0,5-0,05)= 0,09. Следовательно, содержание бензола в газовой фазе 1 м3 грунта равно 0,09∙503=45,3 мг/м3.
Содержание бензола в воде и нефтепродуктах можно определить по его парциальному давлению, которое рассчитывается по молярной концентрации (См. пример II-19):
 атм.
атм.
Тогда мольная доля бензола в составе нефтепродукта равна
 =1,55·10-3
=1,55·10-3
Величина мольной доли бензола в нефтепродукте позволяет определить эффективную растворимость бензола в воде:
 ∙106=221
мг/м3,
∙106=221
мг/м3,
В воде 1 м3 грунта может содержаться до 0,2∙0,5∙221=22,1 мг/м3 бензола. Содержание бензола в питьевой воды не должно превышать 5 мг/м3.
Для определения весовой концентрации бензола в самом нефтепродукте воспользуемся величинами Mср и ρср:
 ∙106=434
г/м3.
∙106=434
г/м3.
Это означает, что 1 м3 грунта содержит в нефтепродукте 434∙0,05∙0,2∙1000=4340 мг/м3 бензола.
Таким образом, после инфильтрации нефтепродукта в зоне аэрации остаточное загрязнение бензолом в сумме может достигать 45,3+15,5+300= 360,8 мг на каждый кубический метр грунта.
Неподвижное
органическое вещество обычно
рассматривается как компонент породы
или осадков. В этом случае массообмен
между водой и органическим веществом
пород часто определяется как абсорбция
непосредственно породой, по аналогии
с адсорбцией минеральных компонентов.
В отличие от адсорбции абсорбция более
медленный процесс, так как требует время
для равномерного распределения абсорбатов
внутри органического вещества. Поэтому
вместо коэффициента распределения
адсорбции породой ( см. ионный обмен)
используют аналогичный коэффициент
распределения абсорбции породой
-
 .
.
Неполярные органические соединения практически не сорбируются минеральной частью пород, и поэтому абсорбционный коэффициент распределения мало зависит от их минерального состава. При содержании органического вещества в породе ниже 1% существует некоторый уровень, при котором абсорбционные способности органического и минерального вещества в грунтах уравниваются. Ниже этого уровня органические компоненты сорбируются преимущественно минеральной поверхностью, выше – органическим веществом. Эту пороговую концентрацию органического вещества в породе или осадках, ОВкр , называют критической (critical concentration). Величина ОВкр зависит от дисперсности и удельной поверхности грунта, содержания глинистых минералов и свойств самого гидрофобного компонента i. Как правило, сорбция органических компонентов минеральным скелетом ничтожно мала, и ею обычно пренебрегают.
При
концентрациях органического вещества
более ОВкр
наблюдается прямая зависимость между
величинами
и содержанием органического вещества
или его углерода в породе. Если содержание
органического вещества в породе выше
ОВкр
и равно
 ,
а
содержание его углерода -
,
а
содержание его углерода -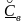 (в весовых долях), то имеем:
(в весовых долях), то имеем:
 ,
( II‑14)
,
( II‑14)
где Cв,i – содержание абсорбированного компонента i в 1 грамме породы (осадка). Здесь величины измеряется в мл·г-1 и характеризует коэффициент распределения концентраций компонента i между 1 г породы и 1 мл воды. Если компонент i в породе отсутствовал, то при взаимодействии с ней вода теряет его в количестве (см. уравнение II-272):
 .
( II‑15)
.
( II‑15)
Тогда, по аналогии с уравнением II-273, получим безразмерную величину коэффициента распределения:
 ,
(II‑16)
,
(II‑16)
где e – приведенная пористость, ρ – плотность скелета грунта.
Пример II‑5.
В
зону аэрации с пористостью n
=30% и содержанием органического углерода
=0,014
попал трихлорэтилен (Cl2C=CHCl).
Растворимость трихлорэтилена в воде
1100 мг/л и коэффициент абсорбции грунта
 =139
мл/г. Объемная плотность осадков δ
=1,85 г/см3.
Необходимо определить количество
трихлорэтана, поглощаемое 1 м3
осадка, т.е. qв,ТХЭ.
=139
мл/г. Объемная плотность осадков δ
=1,85 г/см3.
Необходимо определить количество
трихлорэтана, поглощаемое 1 м3
осадка, т.е. qв,ТХЭ.
Содержание трихлорэтана абсорбированного породой можно определить по уравнению:
 .
.
Для
этого необходимо рассчитать его
коэффициент распределения
 и максимальное содержание в воде
и максимальное содержание в воде
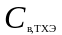 .
Коэффициент абсорбционного распределения
равен:
.
Коэффициент абсорбционного распределения
равен:
 =139∙0,014
=1,95 (мл/г)
=139∙0,014
=1,95 (мл/г)
Максимальное содержание трихлорэтана в воде при внешнем давлении 1 атм равно его эффективной растворимости. Так как трихлорэтан присутсвует в чистом виде и имеет CТХЭ=1, воспользуемся величиной его растворимости в воде 1100 мг/л. Отсюда следует, что
 =1,95∙1100∙10-6=0,002156
(г/г) или 2,16 г/кг .
=1,95∙1100∙10-6=0,002156
(г/г) или 2,16 г/кг .
Таким образом
 =0,0133
г/мл или 13,300 кг/м3.
=0,0133
г/мл или 13,300 кг/м3.

