
- •31. Тиолы. Номенклатура. Кислотные свойства, образование тиолятов.
- •32. Амины. Классификация. Номенклатура. Физические свойства. Способы
- •33. Анилин. Активирующее влияние аминогруппы на реакционную
- •34. Диазо- и азосоединения. Номенклатура. Реакция диазотирования,
- •35. Альдегиды и кетоны. Номенклатура. Физические свойства. Реакции
- •I. Реакции присоединения
- •II. Реакции замещения
- •III. Элиминирование карбонильной группы
- •IV. Реакции окисления
- •V. Действие галоидов
- •VI. Реакции полимеризации и конденсации
- •36. Карбоновые кислоты. Классификация. Номенклатура. Физические
33. Анилин. Активирующее влияние аминогруппы на реакционную
способность ароматического ядра. Галогенирование, сульфирование,
нитрование ароматических аминов. N-метиланилин, N,N-
диметиланилин, толуидины, фенетидины, дифениламин.
Идентификация аминов. Спектральные характеристики аминов.
Ответ:
АНИЛИН Смешивается во всех соотношениях с большинством орг. р-рителей, р-римость анилина в воде и воды в анилине (% по массе): соотв. 4,5 и 7,2 (60°С), 6,4 и 9,9 (90°С). Образует с большинством углеводородов и их галогензамещенными азеотропные смеси с минимумом темп-ры кипения и азеотроп с водой (18% анилина, т. кип. 91,5°С).
Анилин - основание более слабое (К 5,2*10-10 при 25°С, 1,7*10-9 при 60°С), чем амины жирного ряда, что объясняется уменьшением электронной плотности у атома N вследствие сопряжения его неподеленной пары электронов сэлектронами бензольного ядра. При действии электроф. агентов в анилине легко замещаются атомы Н в орто-и пара-положениях. С минер. к-тами анилин образует соли, напр. C6H5NH3C1 (т. пл. 198°С, т. кип. 245 °С), C6H5NH3Br (т. пл. 286°С), C6H5NH2*H3AsO4 (т. пл. 140°С). С H2SO4 анилин образует сульфат, к-рый при 200 °С переходит в сульфаниловую к-ту. Анилин легко образует соль диазония, сочетанием к-рой со мн. реагентами и самим анилином синтезируют азокрасители. Алкилируется по атому N алкилхлоридами, олефинами, в присут. Н2 - альдегидами и кетонами. В пром-сти N-алкиланилины и N,N-диалкиланилины получают каталитич. взаимод. анилина со спиртами. При пропускании паров анилина над активной А12О3 при 400°С, а также при нагр. анилина с его гидрохлоридом при повыш. давлении образуется дифениламин.
При взаимод. анилина с CS2 получают 2-меркаптобензотиазол (каптакс) и ди(2-бензотиазолил)дисульфид (альтакс), а также N,N'-дифенилтиомочевину - промежут. продукт в синтезе индиго, изатина и N,N-дифенилгуанидина; каптакс, альтакс и дифенилгуанидин - ускорители вулканизации. Конденсацией анилина с формальдегидом с послед. фосгенированием образующегося n,n'-диаминодифенилметана синтезируют дифенилметандиизоцианат - сырье в произ-ве полиуретанов, при гидрировании анилина на никелевых кат. - циклогексиламин, являющийся промежут. продуктом в произ-ве капролактама.
Осн. способ произ-ва анилина-каталитич. восстановление нитробензола водородом в газовой или жидкой фазе. Газофазный процесс осуществляют в трубчатом контактном аппарате при 250-350°С на никель- или медьсодержащем кят
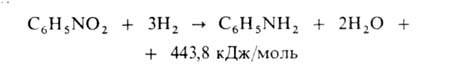
Анилин отделяется от воды расслаиванием и очищается дистилляцией; реакц. вода обезвреживается биохимически. Для получения 1 т анилина расходуется 1,35 т нитробензола, 800 м3 Н2 и 1 кг катализатора.
В жидкой фазе анилин получают при повыш. давлении Н2 (до 1,1 МПа) и 160-170°С на никелевом или палладиевом кат. с одноврем. отгонкой воды и анилина благодаря теплоты р-ции.
Анилин получают также аммонолизом фенола при 300-600 СС и давлении выше 1 МПа в адиабатич. реакторе с неподвижным слоем катализатора (А12О3 или алюмосиликат). Конкурентноспособность метода зависит от доступности фенола в сравнении с нитробензолом.
Качественно анилин обнаруживают по фиолетовому окрашиванию его водного р-ра под действием хлорной извести, а также по образованию азокрасителей при диазотировании с послед. азосочетанием снафтолом или др. азосоставляющей. Количественно определяют диазотированием или методом газовой хроматографии.
С начала пром. произ-ва (1847) анилин использовали гл. обр. для получения красителей, после 2-й мировой войны - в осн. в произ-ве ускорителей вулканизации, с 70-х гг. - в произ-ве полиуретанов. Анилин применяют также для произ-ва лек. ср-в и пестицидов.
Для анилина т. всп. 79°С, т. самовоспл. 493°С, КПВ (при 140°С) 1,2-8,3%. Температурные пределы воспламенения 70-90°С; тушить водой. Превращает гемоглобин в метгемоглобин; ПДК 0,1 мг/м3.
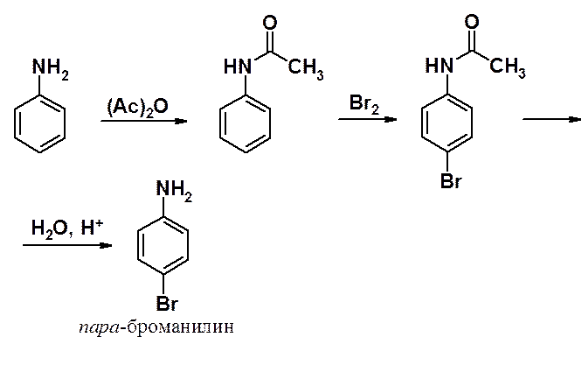
Галогенирование ароматических аминов
Аминогруппа так сильно активирует кольцо, что бромирование протекает без катализатора, а реакция останавливается только когда все орто- и пара-положения заняты галогенами.

Для получения моногалогенопроизводного предварительно проводят ацилирование аминогруппы, превращая ее из амино- в амидную. Последняя обладает теми же ориентирующими свойствами, но выраженными в заметно меньшей степени. После проведения бромирования проводят гидролиз ацильной группы (снимают защиту), получая пара-броманилин, как основной продукт.
Нитрование
Нитрование самого анилина или ароматических аминов выполнить невозможно. Азотная кислота обладает сильными окислительными свойствами, а амины, как все вещества богатые электронами, склонны к окислению. В присутствии окислителей амины превращаются во множество различных продуктов, которые обычно не удается разделить и идентифицировать.
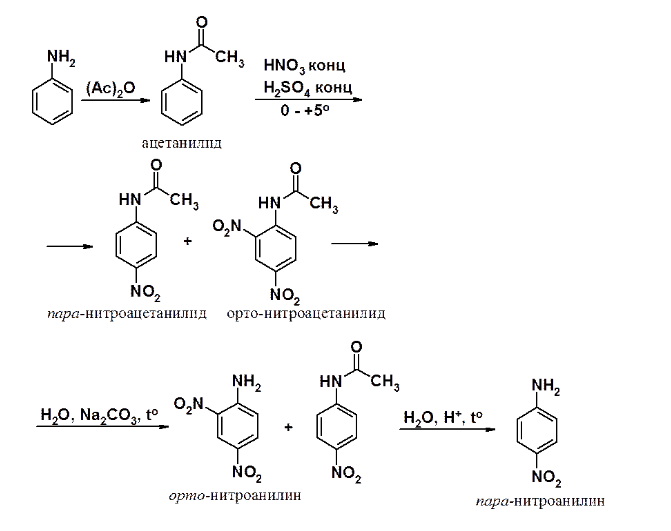
Для проведения нитрования используют ацильную защиту, превращая аминогруппу в амид. Затем проводят нитрование, после которого удаляют защитную группу. Защита реакционоспособной функциональной группы - стандартный прием в синтетической органической химии.
Классический пример: нитрование анилина. Действием уксусного ангидрида анилин превращают в ацетанилид. Нитрование ацетанилида при пониженной температуре приводит к смеси орто- и пара-нитроацетанилидов. Орто-изомер гидролизуется в значительно более мягких условиях, чем пара-. После первой стадии гидролиза выделяют орто-нитроанилин. Затем проводят кислый гидролиз ацетильной группы в пара-нитроацетанилиде, получая пара-нитроанилин.
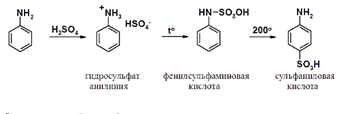
Сульфирование ароматических аминов, как все реакции сульфирования, отличаются от других реакций SEAr.
Взаимодействие серной кислоты с анилином на холоду приводит к гидросульфату анилиния. Реакция в кольцо не происходит из-за образования сильно акцепторной дезактивирующей аммонийной группы. Незначительное нагревание гидросульфата анилиния приводит с фенилсульфаминовой кислоте, которая при длительном нагревании при 200о превращается в пара-аминобензолсульфониевую (сульфаниловую) кислоту.
Идентификация аминов



