
- •31. Тиолы. Номенклатура. Кислотные свойства, образование тиолятов.
- •32. Амины. Классификация. Номенклатура. Физические свойства. Способы
- •33. Анилин. Активирующее влияние аминогруппы на реакционную
- •34. Диазо- и азосоединения. Номенклатура. Реакция диазотирования,
- •35. Альдегиды и кетоны. Номенклатура. Физические свойства. Реакции
- •I. Реакции присоединения
- •II. Реакции замещения
- •III. Элиминирование карбонильной группы
- •IV. Реакции окисления
- •V. Действие галоидов
- •VI. Реакции полимеризации и конденсации
- •36. Карбоновые кислоты. Классификация. Номенклатура. Физические
31. Тиолы. Номенклатура. Кислотные свойства, образование тиолятов.
Алкилирование, ацилирование тиолов. Окисление. Идентификация
тиолов. Простые эфиры. Номенклатура. Физические свойства.
Основные свойства, образование оксониевых солей. Нуклеофильное
расщепление галогеноводородными кислотами. Окисление.
Представление об органических гидропероксидах и пероксидах.
Диэтиловый эфир, анизол, фенетол. Диоксан. Полиэтиленгликоль.
Идентификация простых эфиров. Сульфиды. Номенклатура.
Алкилирование. Окисление.
Ответ:
Тиолы.
Тиолы RSH и сульфиды R1SR2 следует рассматривать как производные спиртов и эфиров. Тиолы в номенклатуре ИЮПАК имеют окончание тиол:
2-метил-1-бутантиол;
3-пентантиол;
Циклогексантиол;
1-пропинтиол;
Сульфиды называют аналогично простым эфирам. В соответствии с общей номенклатурой перед словом сульфид дается название двух алкильных или арильных групп.
По номенклатуре ИЮПАК сульфиды называются алкилтиоалканами. Префикс алкилтио- подобен префиксу алкокси- в названии простых эфиров. Как и у простых эфиров, большая из алкильных групп дает название главной цепи алкана.
Номенклатура ИЮПАК для сульфидов применяется только для соединений сложной структуры, в более простых случаях пользуются общей номенклатурой, где их называют диалкил- (арил)сульфидами.
Наиболее важным физическим свойством тиолов является отвратительный запах. Человеческий нос распознает запах тиола в концентрации 107-l0 8 моль/л (т.е. 1 мл тиола в 50 биллионах миллилитров воздуха), не доступной для многих спектральных и хроматографических методов. Тиолы в очень низкой концентрации вводят в природный гaз для того, чтобы по их запаху можно было определить утечки газа в помещении. Известный своим противным запахом хорек скунс выделяет два простых тиола: З-метил-1-бутантиол и 2-бутен-1-тиол.
Свойства тиолов
Кислотность
Тиолы обладают слабыми кислотными свойствами, с металлами образуют тиоляты. Являются значительно более сильными кислотами, чем соответствующие спирты.
Тиол Константа диссоциации
C6H5SH 3,0×10
C6H5CH2SH 3,75×10
CH2=CH-CH2SH 1,1×10
C2H5SH 2,5×10
н-C3H7SH 2,26×10
трет-C4H9SH 0,89×10
Тиолят-анионы высоконуклеофильны, и многие реакции замещения водорода группы -SH протекают через промежуточное образование тиолятов.
Так, тиолы алкилируются под действием алкилгалогенидов:
RS + RHal
 RSR + Hal
RSR + Hal
Тиолы в присутствии оснований ацилируются с образованием S-ацилпроизводных:
RSH + RCOHal RSR RCOSR
Нитрозирование тиолов азотистой кислотой или нитрозилхлоридом ведёт к неустойчивым окрашенным нитрозилтиолам:
RSH + HNO2 RSNO + H2O
Эта реакция используется как качественная реакция на тиолы.
Присоединение
Тиолы вступают в реакции присоединения к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Окисление
Тиолы окисляются самым широким спектром окислителей. Мягкие окислители реагируют с тиолами с образованием дисульфидов:
2RSH RSSR,
которые, в свою очередь, при реакции с хлором образуют тиохлориды:
RSSR' + Cl2 → RSCl + R’SCl
При действии более жёстких окислителей сначала образуются сульфиновые кислоты и далее — сульфокислоты:
RSH + + RSO3H
В случае окисления тетраацетатом свинца4Pb в присутствии спиртов окисление идёт с образованием сульфинатов — соответствующих эфиров сульфиновых кислот:
RSH + + CH3OH RSO2CH3
В присутствии воды тиолы окисляются хлором до соответствующих сульфонилхлоридов:
RSH + H2O + Cl2 RSO2Cl
Простые эфиры
Простыми эфирами называются вещества, которые представляют собой соединение двух одновалентных углеводородных радикалов с атомом кислорода. Их можно рассматривать также как продукты замещения в молекуле воды обоих атомов водорода на одновалентные углеводородные радикалы.
От простейшего из эфиров — диметилового эфира, или просто метилового эфира, СН3—О—СН3 последовательным замещением атомов водорода в одной из метальных групп на остаток метил можно произвести гомологический ряд:
![]()
Для простых эфиров возможна такая же изомерия радикалов, какая существует для спиртов и вообще для одноатомных производных парафиновых углеводородов. От каждого из членов этого ряда можно, кроме того, произвести гомологический ряд, заменяя второй метил на высшие радикалы. Благодаря этому для класса простых эфиров, кроме обычной изомерии радикалов, возможна также особая изомерия, вызванная тем, что с кислородным атомом могут быть связаны радикалы различного состава. Так, эфир С2Н5—О—С2Н5 изомерен эфиру СН3—О—С3Н7, поскольку оба эфира имеют эмпирическую формулу С4Н10О. Изомерия этого рода носит название метамерии.
Простые эфиры, содержащие два разных радикала, называются смешанными эфирами.
Названия эфиров производятся от названий радикалов. Так, мы имеем диметиловый (метиловый) эфир, метилэтиловый эфир, диэтиловый (этиловый), метилпропиловый, метилизопропиловый эфиры и т. д.
Свойства:
Простые эфиры, получаемые из низших спиртов, кипят при более низкой температуре, чем соответствующие спирты. Диметиловый эфир и метилэтиловый эфир при обыкновенной температуре — газы. Первый имеет т. кип. —23,7° С, а второй +10,8° С. Даже низшие эфиры не смешиваются с водой, но несколько в ней растворяются и сами ее несколько растворяют.
Простые эфиры — нейтральные вещества. Они довольно трудно вступают в реакции, но с концентрированной и особенно с дымящей серной кислотой реагируют с образованием сложных эфиров серной кислоты — кислых и средних.
Соответственно строению простых эфиров, атомы водорода в них не могут заменяться на металл, но довольно легко замещаются на атомы хлора. Иодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и иодистый алкил:
![]()
Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров за счет окисления в α-положении к эфирному кислороду, например:
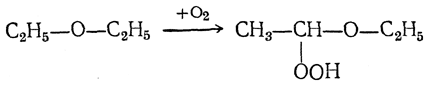
Эти вещества чрезвычайно взрывчаты и являлись причиной сильных взрывов в лабораториях. Взрывы происходили в конце перегонки эфира, не очищенного предварительно от перекисей.
Натрий при низких температурах не действует на простые эфиры. При более высоких температурах простые эфиры (особенно их высшие гомологи) расщепляются по уравнению
R—О—R + 2Na→ R—ONa + R—Na
Еще легче реагирует калий и особенно легко — литий. Как показал П. П. Шорыгин, образующиеся металлоорганические соединения легко подвергаются дальнейшим превращениям.
Оксониевые соединения
Простые эфиры. способны присоединять молекулу галоидоводородной кислоты, давая так называемые оксониевые соединения. Так, Фридель еще в 1875 г. получил соединение диметилового эфира с хлористым водородом следующего строения:

В настоящее время известно много соединений органических кислородсодержащих веществ с сильными кислотами. В таких соединениях атом кислорода, подобно атому азота в аммониевых солях и атому серы в сульфониевых солях, обнаруживает основные свойства. Эти вещества по аналогии с соединениями замещенного аммония рассматривают как продукты замещения атомов водорода в ионе оксония Н3О+.
Интересные трехзамещенные оксониевые соли получены Меервейном (1937). При действии фтористого этила на продукт присоединения фтористого бора к диметиловому эфиру получается кристаллический тетрафтороборат диметилэтилоксония:

Водой этот продукт тотчас же расщепляется с выделением эфира и спирта. При попытке провести обменное разложение комплекса с NaJ были получены лишь продукты распада ожидаемого иодида диметилэтилоксония — диметиловый эфир и иодистый этил.
Представление об органических гидропероксидах и пероксидах
Подобно тому, как от воды можно произвести классы спиртов и простых эфиров, так от перекиси водорода НО—ОН можно произвести классы органических гидроперекисей, содержащих группировку —О—О—Н, и органических перекисей, в которых имеется группировка —О—О—. Эти группировки могут быть связаны с алкилами (гидроперекиси и перекиси алкилов), с оксиалкилами (перекисные соединения, получаемые из альдегидов и кетонов, стр. 253), с α-алкоксиалкилами (например, гидроперекиси простых эфиров, стр. 224), с ацилами (надкислоты и диацилперекиси, стр. 307) и т. п.
Гидроперекиси алкилов
Гидроперекиси жирных радикалов — маслянистые жидкости с неприятным запахом, напоминающим запах озона, обжигающие кожу, подобно высокопроцентной перекиси водорода. Низшие члены этого ряда растворимы в воде, высшие — обладают ограниченной растворимостью.
Гидроперекиси алкилов могут быть получены, например, действием на перекись водорода диалкилсульфатов:
![]()
При избытке диалкилсульфата реакция может пойти дальше — с образованием перекисей алкилов.
Гидроперекись метила СН3—О—О—Н перегоняется при осторожном нагревании в вакууме (65 мм рт. ст.) при 38—40° С.
Гидроперекиси первичных радикалов малоустойчивы, и работа с ними требует особой осторожности, так как они при перегреве или соприкосновении с пламенем сильно взрывают. Более устойчивы гидроперекиси вторичных радикалов, например гидроперекись изопропила (СН3)2СН—О—О—Н — жидкость, при атмосферном давлении перегоняющаяся при 107—109° С.
Еще прочнее гидроперекиси третичных радикалов, представителем которых является гидроперекись трет-бутила

Она представляет собой жидкость, застывающую при —13,5° С, перегоняющуюся в вакууме (18 мм рт. ст.) при 38—38,5° С; 60%-ные растворы гидроперекиси трет-бутила (в триметилкарбиноле) безопасны в обращении и применяются в технике.
Гидроперекиси алкилов быстро выделяют иод из подкисленных растворов иодистого калия
![]()
на чем основано их качественное и количественное определение. Гидроперекиси алкилов обладают слабыми кислотными свойствами и дают с едкими щелочами соответствующие металлические производные, например NaOOR, Ba(OOR)2, которые иногда удается выделить в кристаллическом виде. Углекислота тотчас же вытесняет из этих «солей» свободные гидроперекиси.
При термическом разложении гидроперекисей сначала, по-видимому, образуются свободные радикалы
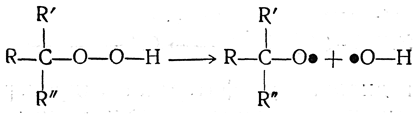
которые могут являться инициаторами некоторых цепных реакций, например реакций полимеризации винильных соединений или диенов. В качестве такого инициатора в технике применяется гидроперекись трет-бутила.
Установлено, что во многих (если не в большинстве) случаях гидроперекиси алкилов являются первичными продуктами окисления кислородом органических веществ.
Более шестидесяти лет назад (1897) А. Н. Бах высказал впервые мысль о том, что окисляющая молекула кислорода не разрывается на отдельные атомы, а присоединяется как одно целое к окисляемому веществу. Сейчас вопрос о механизме окисления углеродистых соединений, по-видимому, близок к выяснению. Оказывается, что окислительные процессы являются цепными реакциями, чувствительными к малейшим посторонним примесям, и, по-видимому, протекают таким образом:

Здесь А* — возбужденная молекула инициатора цепной реакции.
Все конечные продукты окисления являются продуктами дальнейших превращений первичных гидроперекисей.
ДИЭТИЛОВЫЙ ЭФИР (этиловый эфир, серный эфир) С2Н5ОС2Н5,По хим. св-вам Д. э. - типичный алифатич. эфир простой. Обладает слабыми основными св-вами и при действии сильных к-т превращается в неустойчивые оксониевые соли, напр.:
![]()
С к-тами Льюиса дает относительно устойчивые комплексы, напр., эфират трифторида бора (C2H5)2O.BF3, используемый как катализатор. В пром-сти Д. э. получают как побочный продукт в произ-ве этилового спирта гидратацией этилена в присут. фосфорной к-ты или 96-98%-ной H2SO4 при 65-75 °С и давлении 2,5 МПа:

Осн. часть Д. э. образуется на стадии гидролиза этилсульфатов (95-100°С, 0,2 МПа):

Выход эфира максимален при небольшом разбавлении и достигает 7% на пропущенный этилен. Д. э. получают также как побочный продукт прямой газофазной гидратации этилена в этанол в присут. фосфорной к-ты на носителе. При хранении на свету образует нестойкие взрывчатые пероксиды, к-рые м. б. причиной его самовоспламенения при комнатной т-ре.
АНИЗОЛ (метоксибензол, метилфениловый эфир) С6Н5ОСН3
В пром-сти А. получают: взаимод. C6H5ONa с CH3OSO2ONa; алкилированием фенола метанолом при 175-225°С (кат.-А12О3). Препаративный способ: взаимод. фенола с диметилсульфатом в водно-щелочной среде при кипячении (выход 72-75%). Цветная р-ция: темно-зеленое окрашивание при нагр. А. с SeO2 в присут. H2SO4.
А. - р-ритель, промежут. продукт в произ-ве красителей, лек. и душистых в-в. Для А. т. всп. 41 °С, т. самовоспл. 485 °С, КПВ 0,34-6,3%; ЛД50 3,5-4 Г/КГ (белые крысы, подкожно). Н.Н.Артамонова.
ФЕНЕТОЛ (этоксибёнзол , этилфениловый эфир),
Ф. обладает св-вами ароматических соединений. При взаимод. с Cl2 образует смесь 4-хлор-, 2,4-дихлор- и 2,4,6-трихлорфенетолов. Действие Br2 в CH3COOH при охлаждении или нагревание с PBr5 на паровой бане приводит к 4-бромфене-толу; бромирование Br2 при 25 0C в нитробензоле или CCl4 -к смеси 2-бром- и 4-бромфенетолов. При нагр. Ф. с I2 в присут. конц. HNO3 и пиридина при 180 0C образуется 2-иодфенетол с примесью 4-производного. Нитрование оксидами азота в зависимости от условий проведения протекает по положениям 2 и 4. Взаимод. с SO3 в паровой фазе приводит к бис-(4-этоксифенил)сульфону, кипячение с бензилхлори-дом в присут. порошка церия - к 4-бензилфенетолу, кипячение с (CH3CO)2O в 85%-ной H3PO4 - к 4-этоксиацетофенону. При пропускании над Al2O3 при 200-240 0C Ф. разлагается на фенол, 2-этилфенол, 2,6-диэтилфенол и др. соед., при нагр. с 48%-ной HBr - на фенол и этилбромид. В кислом р-ре при нагр. выше 45 0C или при УФ облучении образует пероксиды.
Ф. получают взаимод. фенолята Na с этилсульфатом Na при 180 0C, алкилированием фенола этилхлоридом, взаимод. фенолята Na с этиловым эфиром n-толуолсульфокислоты в водно-щелочном р-ре.
Ф.- р-ритель, промежут. продукт в произ-ве красителей, лек. и душистых в-в. С. И. Диденко.
Полиэтиленгликоль
полимеры этиленоксида общей формулы [—ОСН2СН2—]n. Вязкие жидкости, воскообразные вещества или кристаллические термопластичные полимеры Полиэтиленоксид растворим в бензоле, ацетонитриле, СС14, хлороформе, ДМФА и многих других органических растворителях, при повышенных температурах в спиртах, ацетоне, анизоле, диоксане; не растворим в парафинах, гликолях, глицерине. Неограниченно растворим в воде, но выпадает в осадок из водных растворов выше 100°С, а также при введении неорганических солей.
Диоксан
диэтилендиоксид, циклический простой эфир; бесцветная подвижная жидкость с эфирным запахом; tпл 11,8°С, tkип 101,3°C, плотность 1,03375 г/см3; показатель преломления n20D 1,42241; tвсп 5°С (в закрытой чашке); пределы взрываемости в воздухе 1,97—22,5% (по объёму). Д. смешивается с водой, спиртом, эфиром; образует с водой азеотропную смесь (tkип 87,8°С, 81,6% Д.). В промышленности Д. получают из этиленгликоля (1), из хлорекса (2) и из окиси этилена (3):
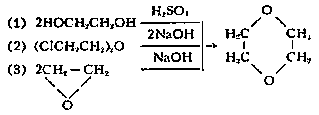
Д. применяют во многих производствах как хороший растворитель, например для ацетилцеллюлозы, минеральных и растительных масел, красок; Д. сравнительно токсичен. Предельно допустимая концентрация его в воздухе 0,01 мг/л.
