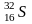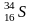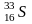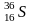- •Вопрос 26.
- •Параметры равновесия
- •Массообмен с гидрофобными веществами
- •Свойства гидрофобных жидкостей
- •Параметры равновесия
- •Распределение гидрофобных компонентов
- •Равновесие гетерогенных процессов
- •Вопрос 27.
- •Биохимические окислительно-восстановительные процессы
- •Вопрос 28. Окислительно-восстановительная зональность
- •Вопрос 29.
- •Изотопные процессы
- •Радиоактивный распад
- •Космогенные радиоактивные изотопы
- •Вопрос 30. Равновесное фракционирование
- •Изотопное смешивание
- •Определение возраста подземных вод
Вопрос 30. Равновесное фракционирование
Под изотопным фракционированием (isotopic fractionation) понимают изменение изотопного состава элемента вследствие только физико-химических процессов. Фракционирование проявляется в изменение относительного содержания только стабильных изотопов. Его причиной служит преимущественно энергетическая неравноценность изотопов обладающих разной массой. Из-за этого наблюдаемые в природе эффекты изотопного фракционирования тем больше, чем легче элемент. Наиболее заметное изотопное фракционирование возможно у водорода и гелия.
Рисунок II-20. Элементы, изотопные соотношения которых чаще всего используются в гидрогеохимии (Хёфс И., 1983).
|
I |
II |
3 |
4 |
5 |
6 |
7 |
8 |
1 |
2 |
|
|
III |
IV |
V |
VI |
VII |
VIII |
1 |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
2 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
3 |
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
Ar |
4 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
5 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
6 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
7 |
Fr |
Ra |
Ac |
Ku |
Ns |
|
|
|
|
|
|
|
|
|
|
|
|
|
Как было сказано выше, изотопный состав элемента измеряется количественным соотношением его изотопов или величиной отклонения этого соотношения от некоторого стандартного (stable isotope standards) значения согласно уравнению:
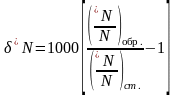 .
(II‑42)
.
(II‑42)
Здесь *N - концентрация менее распространенного и более тяжелого изотопа элемента N в образце и в стандарте; N - то же для более распространённого и более легкого изотопа.
Рисунок II-21. Относительная распространенность изотопов и стандарты, используемые в гидрогеохимических исследованиях
Элемент |
Изотопы |
Среднее относительное содержание (%) |
Стандарты стабильных изотопов |
|
Значение |
Наименование. Авторы. |
|||
Водород |
|
0,015 |
1,557610-4 |
SMOW R. Hageman et al., 1970 г. |
|
99,984 |
|||
|
10-14 до 10-16 |
|
|
|
Кислород |
|
0,10 |
|
SMOW, R. Hageman et al., 1970 г. |
|
99,76 |
|||
|
0,037 |
|
|
|
Азот |
|
99,634 |
272,2 |
Атмосферный азот, G. Junk, H. P. Svec, 1958 г.
|
|
0,366 |
|||
Аргон |
|
99,60 |
295,6
5,35
|
Атмосферный аргон, A. 0. Nier, 1950 г. |
|
0,337 |
|||
|
0,063 |
|||
Гелий |
|
1,310-4 |
1,4010-6 |
Атмосферный гелий, Б. А. Мамырин и др., 1970 г. |
|
99,9999 |
|||
Углерод |
|
1,11 |
1,1237210-2 |
PDB, H. Craig, 1957 г. |
|
98,89 |
|||
|
~10-10 |
|
NBS У. Ф. Либби, 1949 г. |
|
Сера |
|
95,02 |
|
|
|
4,21 |
22,220 |
Троилит метеорита Каньон Дьяболо, J. Mac Namara, H. G. Tkode, 1950 г. |
|
|
0,75 |
|||
|
0,02 |
|
|
|
Мерой изменения изотопного состава при фракционировании служит коэффициент фракционирования (fractionating coefficient) - , который представляет собой соотношение изотопных отношений одного и того же элемента (*N/N) до и после любого физико-химического процесса:
 .
(II‑43)
.
(II‑43)
Например, при испарении влаги коэффициент фракционирования определяется уравнением
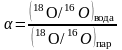 .
.
Коэффициент фракционирования связан с величиной отклонения от стандарта N (‰) уравнением:
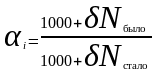 ≈
1000+(δNбыло
– δNстало).
(II‑44)
≈
1000+(δNбыло
– δNстало).
(II‑44)
При испарении воды имеем
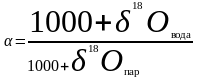 .
.
Во многих случаях пользуются более простой аддитивной формой выражения коэффициента фракционирования - ij, определяемой по уравнению:
= Nбыло Nстало. (II‑45)
Изотопное фракционирование отражает стремление системы к минимуму свободной энтальпии и так же контролируется константами равновесия, которые, однако, имеют значительно более сложную природу. Наиболее заметное фракционирование наблюдают при гетерогенном массообмене, в частности при испарении или конденсации влаги. Несколько меньшее значение имеет фракционирование, связанное с миграцией (диффузией и адвекцией), абсорбцией и химическими процессами. Химические процессы играют заметную роль, когда изотопы переходят из одной молекулы в другую. Все коэффициенты фракционирования находятся в непосредственной зависимости от температуры, давления и состава среды.
Изотопы семи элементов имеют наибольшую значимость в гидрохимических исследованиях. Их относительная распространенность и используемые изотопные стандарты приведены в таблица II-44. Фракционированию в наибольшей степени подвержены изотопы относительно легких элементов, активно участвующих в химических реакциях и фазовым превращениях, а именно H, O, C, S и N.
Изотопные составы H и O в природных водах определяются, как правило, изотопными соотношениями D/2H и 18O/16O в молекуле H2O и поэтому тесно связаны между собой. Для их измерения используется один и тот же стандарт Средней Океанической Воды (Standard Mean Ocean Water- SMOW), а именно соотношения D/2H и 18O/16O в смеси вод Тихого, Атлантического и Индийского океанов с глубин 500-2000 м в удалении от континентов (Дривер Дж., 1985, Ферронский В.И., Поляков В.А., 1983).
При испарении более легкие изотопы H и 16O легче переходят в газообразное состояние и тем самым делают парообразную влагу изотопно более легкой. Пар в нормальных условиях беднее материнской воды по дейтерию почти на 8% и по кислороду-18 на 0,9%. Вследствие этого жидкая вода при испарении становится изотопно тяжелее. Напротив, при конденсации в жидкое состояние легче переходят тяжелые изотопы D и 18O, и пар в процессе конденсации становится изотопно легче.
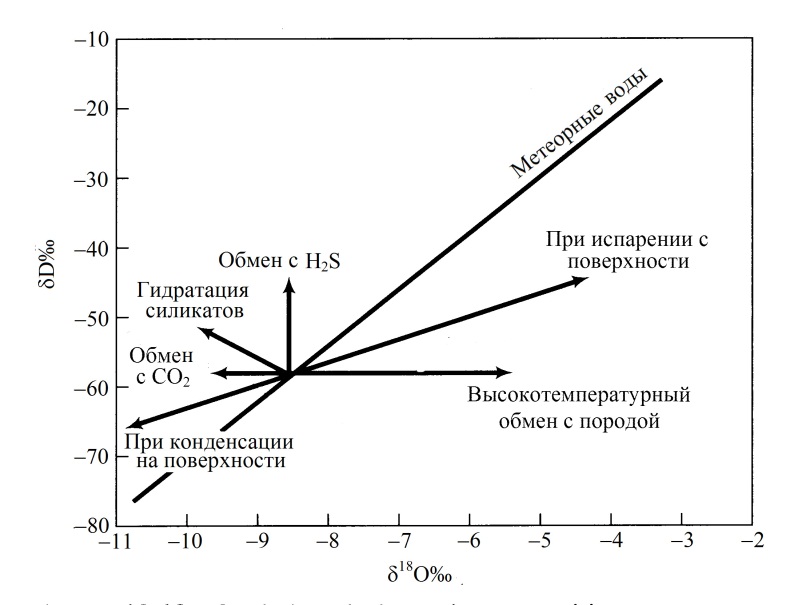
С понижением температуры парообразная влага атмосферы постепенно конденсируется и удаляется в виде осадков. Вследствие этого оставшийся в атмосфере пар постепенно обогащается легкими изотопами H и 16O. При температуре 20oC коэффициент фракционирования α для HDO и H218O равен соответственно 1,08 и 1,09. При этом коэффициент фракционирования с понижением температуры уменьшается. Хармон Крейг (1926-2003) в 1961 году сопоставил графически величины δD и δ18O 400 проб разных природной воды и получил линейную зависимость, известную как общая линия метеорных вод (global meteoric water line)(Рис. II-87). Уравнение этой зависимости:
D = 818O + 1%. ( II‑46)
часто называется уравнением Крейга (Craig equation). Оно характеризует зависимость изотопного состава влаги осадков от среднегодовой температуры воздуха. В настоящее время полагают, что поверхностные и подземные воды, которые активно участвуют в круговороте влаги на Земле, имеют изотопный состав соответствующий этой зависимости. Поэтому влага с изотопным составом уравнения Крейга считается генетически связанная с атмосферными осадками. Любое заметное отклонения от общей линии метеорных вод (Рис. II-87) рассматривается, как результат либо присутствия молекул H2O другого генезиса, либо особых условий их формирования. Такими условиями могут быть химический массообмен с породой, CO2, H2S и т.д., когда O и H меняют свой изотопный состав независимо друг от друга.
|
Рисунок II-22. Отклонения изотопного состава от общей линии метеорных вод, как следствие гидрохимических процессов. (Isotopie techniques in…, 1983).
|
Изотопный состав C определяется соотношением стабильных изотопа 12C и 13C. В качестве стандарта PDB принят изотопный состав углерода кальцита в белемните из формации PD около Мичигана с соотношением 13C/12C=1,12372·10-2.
В гидросфере Земли средняя величина отношения 12С/13С равна 89,3, что близко к значениям, наблюдаемым в карбонатных породах 88,1-88,9 (Галимов Э.М., 1968 ). Реакции изотопного обмена углерода в растворенных карбонатах имеет вид:
13CO2 (газ) + H12CO3-(вода) 12CO2 (газ) + H13CO3-(вода),
13CO2 + 12CO3-2 12CO2 + 13CO3-2,
и характеризуется при 25o C коэффициентом фракционирования соответственно 1,014 и 1,012. Эти реакции контролируют взаимоотношение между изотопным составом углерода CO2 в атмосфере и карбонатных ионов в морской воде. Они объясняют заметное обогащение тяжелым изотопом 13C карбонатных ионов моря и известняков.
Большие успехи достигнуты в изучении изотопного состава углерода в углеводородах, и прежде всего, в наиболее прочном органическом соединении - метане. Величина 13C метана варьирует от -90 ‰ до -20 ‰. С одной стороны, наблюдается явная тенденция его изотопного утяжеления с глубиной, что может быть следствием как температурного, так и миграционного фракционирования. С другой стороны, Алла Ивановна Поливанова (Поливанова А.И., 1981 ) обращает внимание, что изотопно тяжелый метан связан с рассолами. Главный источник метана и его гомологов однозначно не установлен. Тем не менее, более обоснованной представляется гипотеза, что таковым является углерод захороненного органического вещества. В связи с этим в настоящее время различают два основных источника метана: биогенный и термокаталитический. Изотопно легким метаном (C < -50 ‰) с ничтожным содержанием этана и более тяжелых углеводородов рассматривается, как продукт низкотемпературных биохимических процессов (ферментации или восстановления CO2). Изотопно тяжелый метан (C > -50 ‰) с заметным содержанием тяжелых углеводородов связывают с термокаталитическим разложением органического вещества пород на больших глубинах.
Изотопный состав S определяется обычно соотношением 34S/ 32S при наличии 4 стабильных изотопов ( 32S,33 S,34S и 36S). В качестве стандарта используется изотопный состав серы железного метеорита КаньонДьябло. Сера обладает относительно большим атомным весом и минимальным изотопным фракционированием. Поэтому ее изотопный состав исследован заметно хуже. Источником изотопно тяжелой серы является сульфатный ион, сера которого в океанических водах имеет состав 20,1±0,8‰. Основной причиной фракционирования серы является изотопный обмен между SO42- и H2S, который происходит при участии бактерий.

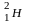 (D)
(D)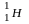
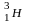 (T)
радиоактивный
(T)
радиоактивный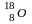
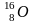
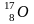
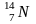
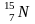
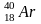 радиогенный
радиогенный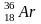
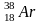
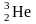
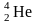 ,
радиогенный
,
радиогенный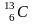
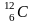
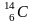 ,
радиоактивный
,
радиоактивный