
- •О.Ю. Петрова, т.В.Смекалина, о.Л.Хабибулина
- •Учебное пособие
- •Оглавление
- •2. Координаты
- •3. Перемещение
- •4. Время
- •5. Средняя скорость
- •6. Мгновенная скорость
- •7. Ускорение
- •8. Угловой путь
- •10. Угловое ускорение
- •11. Нормальное ускорение
- •12. Тангенциальное ускорение
- •§2. Определения динамики
- •1. Масса
- •2. Сила
- •3. Результирующая сила
- •4. Импульс силы
- •5. Импульс материальной точки
- •6. Импульс системы материальных точек
- •7. Работа
- •8. Мощность
- •9. Энергия
- •10. Потенциальная энергия
- •11. Кинетическая энергия
- •12. Коэффициент полезного действия
- •13. Нормаль к поверхности
- •14. Центр масс
- •15. Сила нормального давления и вес
- •§3. Определения статики
- •1. Момент силы
- •2. Плечо силы
- •2. Сила тяжести
- •3. Закон Гука
- •4. Сила трения
- •5. Первый закон Ньютона
- •6. Второй закон Ньютона
- •7. Третий закон Ньютона
- •8. Закон сохранения энергии. Вечный двигатель первого рода.
- •9. Сила инерции при прямолинейном движении
- •§5. Законы статики
- •2. Выражение времени через среднюю скорость и путь
- •3. Связь мгновенной скорости и постоянного ускорения
- •4. Связь координаты и постоянного ускорения
- •5. Связь линейной и угловой скоростей при равномерном движении по окружности
- •6. Выражение нормального ускорения через линейную и угловую скорости
- •§7. Формулы кинематики и динамики
- •1. Первая космическая скорость
- •§8. Формулы динамики
- •1. Потенциальная энергия вблизи поверхности Земли
- •2. Закон сохранения импульса
- •3. Выражение второго закона Ньютона через изменение импульса материальной точки
- •Глава 4. Модели механики
- •1. Физическое тело, или просто тело
- •2. Материальная точка
- •3. Система отсчета
- •4 . Абсолютно упругий удар
- •5. Абсолютно неупругое соударение
- •2. Объем
- •3. Давление
- •4. Термодинамические параметры
- •5. Термодинамическая система
- •6. Молекулярная единица массы
- •7. Молярная масса
- •8. Число Авогадро
- •9. Масса молекулы
- •10. Количество вещества
- •11. Плотность
- •12. Концентрация
- •13. Теплота
- •14. Внутренняя энергия
- •15. Теплоёмкость
- •16. Удельная теплоёмкость
- •17. Молярная теплоёмкость
- •18. Насыщенный пар
- •19. Относительная влажность
- •20. Термодинамический процесс
- •21. Изотермический процесс3
- •22. Изобарический процесс4
- •23. Изохорический процесс5
- •24. Адиабатический процесс
- •25. Круговой процесс, или цикл
- •26. Цикл Карно
- •27. Коэффициент полезного действия тепловой машины
- •2. Закон Гей-Люссака
- •3. Закон Бойля−Мариотта
- •4. Первое начало термодинамики
- •5. Второе начало термодинамики. Вечный двигатель второго рода
- •6 . Закон Паскаля
- •7. Зависимость давления насыщенного пара от температуры
- •8. Удельная теплоемкость жидкости и газа Формулировки экспериментального закона: удельные теплоемкости жидкостей и газов остаются постоянными в широком диапазоне температур.
- •9. Молярная теплоемкость жидкости и газа Формулировки экспериментального закона: молярные теплоемкости жидкостей и газов остаются постоянными в широком диапазоне температур.
- •10. Удельная теплота плавления
- •11. Удельная теплота парообразования
- •Глава 7. Теоремы термодинамики и гидростатики Формулы §9. Формулы термодинамики
- •1. Уравнение Менделеева−Клапейрона
- •2. Уравнение состояния идеального газа
- •3. Закон Дальтона
- •4. Основное уравнение молекулярно-кинетической теории
- •5. Значение числа Авогадро
- •6. Способы расчета количества вещества
- •7. Внутренняя энергия одноатомного идеального газа. Смысл термодинамической температуры
- •8. Работа в термодинамике
- •9. Работа в изобарическом процессе
- •10. Коэффициент полезного действия цикла Карно
- •11. Формула связи полезной работы с тепловыми энергиями нагревателя и холодильника тепловой машины
- •12. Коэффициент полезного действия реальной тепловой машины (Второе начало термодинамики)
- •13. Связь температурных шкал Кельвина и Цельсия
- •§10. Формулы термодинамики и гидростатики
- •1. Давление столба жидкости или газа
- •2. Сила Архимеда
- •§11. Формулы гидростатики
- •1. Формула гидравлического пресса
- •Глава 8. Модели термодинамики
- •1. Идеальный газ
- •2. Температурная шкала Цельсия
- •3. Равновесный термодинамический процесс
- •2. Пробный заряд
- •3. Заряд электрона
- •4. Физическое поле
- •5. Однородное поле
- •6. Потенциальная энергия заряда
- •7. Потенциал
- •8. Напряженность электрического поля
- •9. Электрическое поле
- •10. Силовая линия напряженности электрического поля
- •11. Эквипотенциальная поверхность
- •12. Электроемкость уединенного проводника
- •13. Взаимная электроемкость проводников
- •§13. Определения постоянного тока
- •1. Постоянный электрический ток
- •2. Электродвижущая сила − эдс
- •3. Сторонние силы
- •4. Напряжение на участке цепи
- •2. Закон Кулона в вакууме или в воздухе
- •3. Закон Кулона в среде
- •4. Результирующая сила Кулона
- •5. Электроемкость уединенного проводника
- •§ 15. Законы постоянного тока
- •1. Закон Ома для однородного участка цепи
- •2. Удельное сопротивление и проводимость проводников
- •3. Температурная зависимость сопротивления проводников Формулировки экспериментального закона: температурная зависимость сопротивления проводников.
- •4. О равномерном протекании постоянного тока по цепи Формулировки экспериментального закона: постоянный ток сохраняет свою величину для любого поперечного сечения проводников в любой точке цепи.
- •2. Вычисление силы по напряженности
- •3. Связь напряженности электрического поля и силы Кулона, действующей на пробник
- •4. Принцип суперпозиции для напряженности электрического поля
- •5. Потенциальная энергия электростатического поля
- •6. Потенциал точечного заряда
- •7. Потенциал суммы точечных зарядов
- •8. Связь разности потенциалов и работы электрических сил
- •9. Связь напряженности и потенциала однородного электростатического поля
- •10. Связь силовых линий и эквипотенциальных поверхностей электростатического поля
- •11. Потенциал поверхности уединенного проводника
- •12. Потенциал объема уединенного проводника
- •13. Ёмкость шара
- •14. Поле плоского конденсатора
- •15. Ёмкость плоского конденсатора
- •§17. Формулы постоянного тока
- •1. Закон Джоуля–Ленца
- •3. Сопротивление участка цепи при последовательном соединении проводников
- •4. Сопротивление участка цепи при параллельном соединении проводников
- •5. Ёмкость участка цепи при последовательном соединении ёмкостей
- •6. Ёмкость участка цепи при параллельном соединении емкостей
- •7. Закон Ома для полной цепи. Закон Ома для цепи, содержащей эдс (неоднородный участок цепи)
- •8. Первый закон Кирхгофа
- •9. Второй закон Кирхгофа
- •10. Два закона электролиза: закон Фарадея и выражение для электрохимического эквивалента
- •Глава 12. Модели электричества §18. Модели электростатики
- •1. Заряд как невесомая невидимая «жидкость»
- •2. Заряд как избыток или недостаток электронов в веществе
- •§19. Модели электрического тока
- •1. Электрический ток как поток невесомой невидимой «жидкости»
- •2. Электрический ток как поток заряженных частиц
2. Закон Гей-Люссака
Формулировки экспериментального закона: формулировок много: закон Гей-Люссака. Изобарический процесс. Процесс при постоянном давлении. Связь объёма и температуры при постоянном давлении. Уравнение изобарического процесса.
Формула экспериментальной связи физических величин и словесное изложение формулы: есть три формулы для представления закона Гей-Люссака.
1 .
V(t)
= V0(1+
αt).
Для заданной массы газа m
=
const
и при постоянном давлении Р
=
const
объём при температуре t
градусов по Цельсию равен произведению
объёма при нуле градусах Цельсия
V0
на
сумму единицы и произведения температурного
коэффициента объёма α
на
температуру по Цельсию t,
при которой и определяется объем V(t).
.
V(t)
= V0(1+
αt).
Для заданной массы газа m
=
const
и при постоянном давлении Р
=
const
объём при температуре t
градусов по Цельсию равен произведению
объёма при нуле градусах Цельсия
V0
на
сумму единицы и произведения температурного
коэффициента объёма α
на
температуру по Цельсию t,
при которой и определяется объем V(t).
2. V/T = const. Для заданной массы газа m = const и при постоянном давлении Р = const отношение объёма к температуре по Кельвину есть величина постоянная
3. V1/T1 = V2/T2. Для заданной массы газа m = const и при постоянном давлении P = const отношение объёма к температуре по Кельвину в состоянии 1 равно отношению объёма к температуре по Кельвину в состоянии 2.
Расшифровка формулы: V(t) –объем фиксированной массы газа при постоянном давлении при некоторой температуре t по Цельсию; V0 –объем фиксированной массы газа при постоянном давлении при 0 °С; α − температурный коэффициент объема; V –объём в некотором состоянии изобарического процесса при температуре Т; V1 и Т1 − объем и температура в состоянии (1) изобарического процесса; V2 и Т2 в состоянии (2) того же процесса.
Смысл константы (фундаментальная/нефундаментальная): α − температурный коэффициент объема α= . [α] = .
Коэффициент характеризует уровень возрастания объёма с ростом температуры по сравнению с объёмом при нуле градусах Цельсия.
Условия применения закона: при неизменной массе газа m = const и при постоянном давлении Р = const выполняется для идеального газа.
3. Закон Бойля−Мариотта
Формулировки экспериментального закона: формулировок много: закон Бойля−Мариотта. Изотермический процесс. Процесс при постоянной температуре. Связь давления и объема при постоянной температуре. Уравнение изотермического процесса.
Ф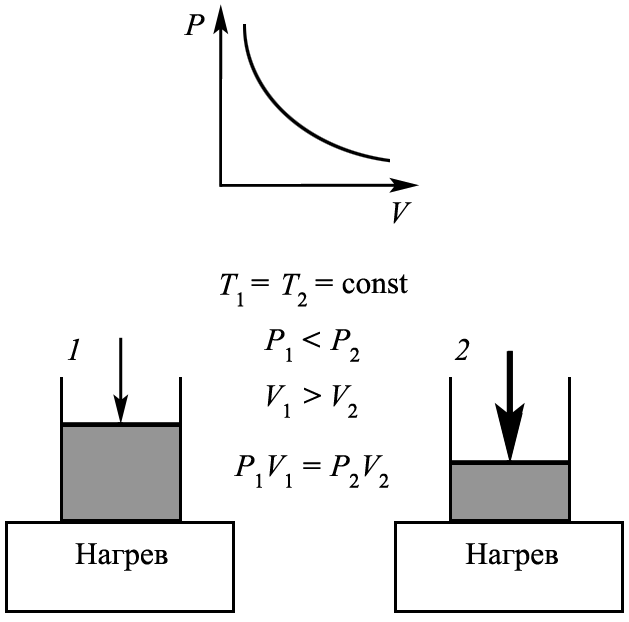 ормула
экспериментальной связи физических
величин и словесное изложение формулы:
есть две формулы представления закона
Бойля−Мариотта.
ормула
экспериментальной связи физических
величин и словесное изложение формулы:
есть две формулы представления закона
Бойля−Мариотта.
1. Для заданной массы газа m = const и при постоянной температуре Т = const произведение давления на объём есть величина постоянная: PV = const.
2. Для заданной массы газа m = const и при постоянной температуре Т = const произведение давления на объём в состоянии 1 равно произведению давления на объём в состоянии 2: P1V1 = P2V2.
Расшифровка формулы: m − масса газа; Т − постоянная температура; P – давление фиксированной массы газа при постоянной температуре; V – объём фиксированной массы газа m при постоянной температуре; P1, V1 – давление и объём фиксированной массы газа при постоянной температуре в состоянии 1; P2, V2 – давление и объём фиксированной массы газа при постоянной температуре в состоянии 2.
Смысл константы (фундаментальная/нефундаментальная): новой константы не возникает.
Условия применения закона: при неизменной массе газа m = const и при постоянной температуре Т = const выполняется для идеального газа.
