
Система комплимента
.docМосковская Государственная Академия Ветеринарной
медицины и Биотехнологии им. К.И.Скрябина
Реферат по иммунологии на тему: «Система комплимента»
Работу выполнила
Котлярова А. Д.
6 группа 3 ФВМ
Работу проверил
Москва 2008 г.
Система комплемента — сложный комплекс белков, представленных главным образом во фракции β-глобулинов, насчитывающий, включая регуляторные, около 20 компонентов, на долю которых приходится 10 % белков сыворотки крови. Комплемент впервые описал Бухнер в 1889 г. под названием «алексин» — термолабильный фактор, в присутствии которого наблюдается лизис микробов. Свое название (Эрлих, 1895) комплемент получил благодаря тому, что он комплементирует (дополняет) и усиливает действие антител и фагоцитов, защищая организм человека и животных от большинства бактериальных инфекций.
Комплемент представляет собой систему каскадно-действующих пептид-гидролаз, получивших обозначение от С1 до С9. Установлено, что большая часть компонентов комплемента синтезируется гепатоцитами и другими клетками печени (около 90 %, СЗ, С6, С8, фактор В и др.), а также моноцитами/макрофагами (С1, С2, СЗ, С4, С5).
С1-компонент представлен в плазме крови тремя белками (Clq, Clr, С Is).
Наиболее сложной из них является молекула Clq (рис. 1), состоящая из 18 полипептидных цепей трех типов (по 6 цепей А-, В- и С-типов). Все 18 цепей своими коллагеноподобными N-конца-ми (78 остатков аминокислот) образуют канатообразную спирально закрученную структуру, от которой расходятся в разные стороны С-концевые участки цепей (103—108 аминокислотных остатков), завершающиеся глобулярными головками, которые могут взаимодействовать с комплементсвязывающими участками Сн-доменов антител (в составе иммунного комплекса АГ—AT).
В норме все компоненты комплемента — неактивные или малоактивные соединения, но могут последовательно активироваться за счет отщепления или присоединения пептидных факторов (например, С2а, C2b, C4a, C4b и др.) и факторов активации (факторов В и D, липополисахаридов, гликолипидов, антител и др.) — продукт одной реакции катализирует последующую. Катаболизм компонентов комплемента самый высокий по сравнению с другими белками сыворотки крови, с обновлением в течение суток до 50 % белков системы комплемента.

Рис. 1. Молекула Clq-компонента комплемента (электронная микроскопия)
Молекула состоит из шести терминальных субъединиц, соединенных центральной единицей (из Schaechter M., Medoff G., Eisenstein В. Mechanisms of microbial diseases, 2nd ed, Williams & Wilkins, 1993)
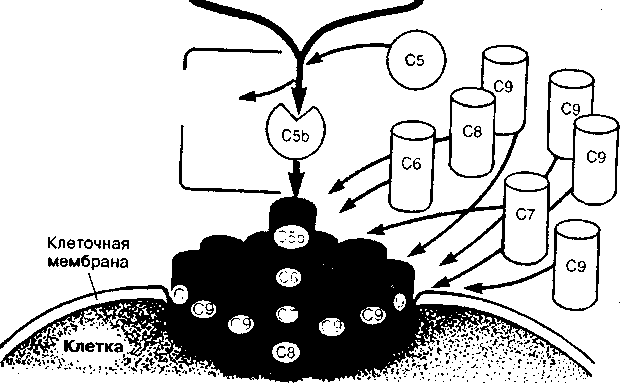
Различные компоненты комплемента и их фрагменты, образующиеся в процессе активации, способны вызывать воспалительные процессы, лизис клеток, стимулировать фагоцитоз. Конечным результатом активации может быть сборка комплекса из С5-, С6-, С7-, С8- и С9-компонентов, атакующего мембрану с образованием в ней каналов и повышением проницаемости мембраны для воды и ионов, что обусловливает гибель клетки.
Активация комплемента может происходить двумя основными путями: альтернативным — без участия антител и классическим — с участием антител (рис. 2).
![]()
![]()
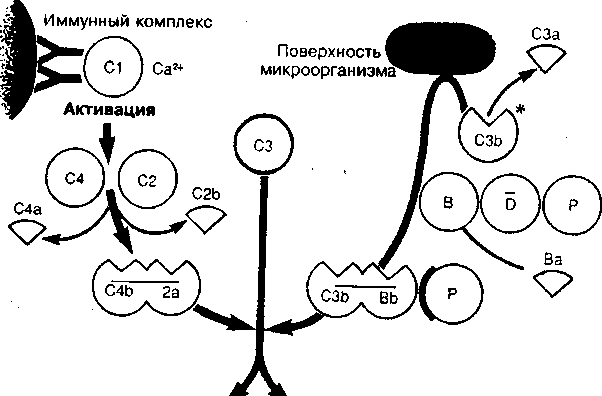
Альтернативный путь более древний. В его основе лежит способность некоторых микроорганизмов активировать СЗ-конвертазу (СЗЬВЬ) путем связывания ее на углеводных участках своей поверхностной мембраны с последующей стабилизацией СЗ-кон-вертазы белком пропердином (Р). Про-пердин способен связываться с поверхностью бактериальной клетки и инициировать при этом фиксацию на ней СЗ-конвертазы и присоединение к комплементу дополнительных молекул СЗЬ. СЗЬ способен закрепляться как на поверхности микроорганизма, так и на рецепторах фагоцитов (нейтрофилов и макрофагов), выполняя роль опсонина, усиливающего фагоцитоз различных бактерий. Образовавшийся комплекс СЗЬВЬР обладает функцией СЗ-конвертазы. Формирование СЗ/С5-конвертаз при альтернативном пути активации комплемента происходит при участии факторов В, D, Р в присутствии ионов Mg2+ и регулируется некоторыми факторами (Н, I и др.) инактивации.
Стабилизированная на мембране активная конвертаза расщепляет СЗ — один из компонентов системы комплемента, содержащийся в крови в наибольшей концентрации, что ведет к цепной реакции активации других компонентов комплемента.
В результате действия СЗ/С5-кон-вертаз вначале при участии СЗ-конвертазы происходит расщепление СЗ-компонента, содержащегося в крови в наибольшей концентрации, что ведет к цепной реакции активации других компонентов комплемента, а последующее сформирование С5-конвертазы ведет к расщеплению С5-компонента на более крупный (С5Ь) и мелкий (С5а) фрагменты. С5Ь связывается с комплексом компонентов комплемента на клеточной мембране, а С5а остается в жидкой фазе, обладая хемотаксической и анафилактогенной активностью.
С5Ь-фрагмент обладает способностью связывать компонент С6 с образованием комплекса С5Ь — С6, к которому быстро присоединяется С7, а затем С8. Комплекс С5Ь — С6, 7, 8 проникает внутрь липидного бислоя мембраны. На завершающем этапе к С8 присоединяются 12—20 молекул С9, что завершает формирование высокоактивного литического комплекса (А. А. Ярилин, 1999), формирующего трансмембранный канал, через который внутрь клетки поступают ионы водорода, натрия и вода, что ведет к набуханию и лизису клетки. С9-белок, гомологичный перфорину, способный к полимеризации при контакте с фосфолипидами мембраны, ответствен за формирование трансмембранного канала цилиндрической формы, наружная поверхность которого образована гидрофобными, а внутренняя (обращенная в полость канала) — гидрофильными участками.
Классический путь активации комплемента возник для усиления фагоцитоза в отношении микроорганизмов, которые не запускают альтернативный путь, т. е. не имеют на мембране полисахаридного участка связывания СЗ-конвертазы. Главная особенность этого пути — взаимодействие антигена и антитела с образованием иммунного комплекса (АГ—AT), активирующего компоненты комплемента (С1, С2, С4), которые, в свою очередь, формируют СЗ-конвертазу (С4Ь2а), расщепляющую СЗ-компонент.
В Сн4-доменах IgM и Сн2-доменах IgG имеются участки, обладающие сродством к Clq (только в составе иммунных комплексов). Clq связывается не менее чем с двумя Сн4-доменами одной и той же молекулы IgM и с Сн2-до-менами одновременно двух молекул IgG, в связи с чем комплементактиви-рующая активность IgG ниже, чем у IgM. С комплементсвязывающими участками антител (IgM, IgGl, IgG3 и IgG2) взаимодействуют концевые (глобулярные) участки Clq, что ведет к активации молекулы Clq, приобретающей свойства сериновой пептидгидро-лазы. Clq-пептидгидролаза активирует Clr, который участвует в активации Cls. В результате образующиеся при активации и расщеплении Clr- и Cls-фрагменты встраиваются в Clq, располагаясь между его глобулярными участками (головками). При этом формируется комплекс Clqrs, обладающий активностью трипсиновой пептидгидролазы, катализирующей расщепление С4 (на С4а- и С4Ь-фрагменты) и С2 (на С2а- и С2Ь-фрагменты). Следствием взаимодействия Clqrs, C4b и С2а в присутствии ионов Са2+ является образование комплекса С4Ь2а, обладающего свойствами и активностью СЗ-конвертазы, расщепляющей СЗ, и участвующего в формировании С5-конверта-зы (С4Ь2аЗЬ). Дальнейшая активация комплемента по классическому пути полностью совпадает с альтернативным путем и завершается формированием мембраноатакующего комплекса С5Ь — 6789 и лизисом клеток.
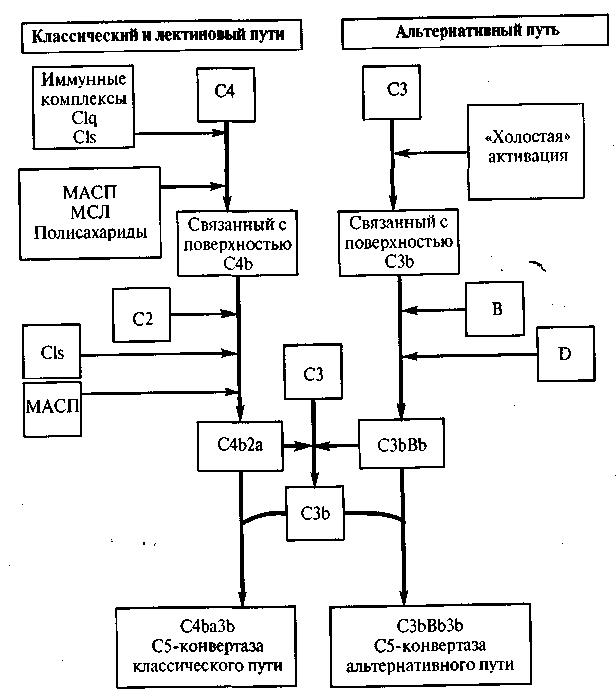
Рис. 3. Аналогичные этапы активации комплемента по классическому, лектиновому и альтернативному механизмам:
Как классический так и альтернативный путь активации комплемента приводит к появлению СЗ-конвертазы: С4Ь2а и C3bBb соответственно. Классический путь начинается с активации комплексом антиген-антитело и последующего расщепления активированным CIs компонентов С4 и С2. Фрагменты меньшего размера C4a и C2b, высвобождаются, а более крупные образуют С4Ь2а. Компоненты С4 и С2 могут быть активированы также МАСП (маннан-связывающей лектин-ассоциированной сериновой протеиназой) - белком лектинового пути, аналогичным CIs, и МСЛ (сывороточным маннан-связывающим лектином). На первых этапах альтернативного пути возникший в результате «холостой» активации и связавшийся с поверхностью белок СЗЬ соединяется с фактором В, от которого Фактор D отщепляет меньший фрагмент- Ва. Больший фрагмент, то есть ВЬ, остается связанным с СЗЬ, образуя СЗЬDЬ-СЗ-конвертазу которая расщепляет дополнительное количество молекул СЗ (механизм положительной обратной связи). Поверхность активирующая комплемент (например, микроорганизмов), стабилизирует СЗЬ, обеспечивая его связывание с Фактором В Это способствует дальнейшей альтернативной активации комплемента. СЗ-конвертазы классического и альтернативного путей могут дополнительно присоединять СЗЬ, образуя ферментные комплексы, называемые С5-конвертазами (С4Ь2аЗЬ и СЗЬВЬЗЬ соответственно), которые активируют следующий компонент систем комплемента — С5 (А. Ройт и соавт., 2000)
Таким образом, принципиальных биохимических различий между классическим и альтернативным путями активации комплемента, по существу, нет, тем более что факторы В и С2, участвующие в активации СЗ по альтернативному и классическому путям, сходны между собой (по размеру, строению, фрагментам расщепления, механизму действия). Есть мнение, что, возможно, факторы В и С2 возникли в результате дубликации одного гена (В. В. Чиркин и др., 1999). Однако по клиническим проявлениям различия между этими путями весьма существенны. При альтернативном пути в циркуляторном русле значительно увеличивается содержание осколков белковых молекул с высокой биологической активностью, для нейтрализации которых включаются сложные механизмы, что повышает возможность развития вялотекущего, зачастую генерализованного воспалительного процесса. Классический путь наиболее безвреден для организма. При нем на микроорганизмы одновременно воздействуют и фагоциты, и антитела, которые специфически связывают антигенные детерминанты микроорганизмов и активизируют систему комплемента, способствуя тем самым активации фагоцитоза. При этом уничтожение атакуемой клетки происходит одновременно при участии и антител, и комплемента, и фагоцитов, что внешне может никак не проявляться. В связи с этим классический путь активации комплемента считается более физиологическим путем обезвреживания и утилизации антигенов, чем альтернативный.
Помимо двух основных путей возможны и другие механизмы активации комплемента. В частности, существует вариант классической активации комплемента — лектиновый путь активации (рис. 3), который можно трактовать и как самостоятельный (А. А. Ярилин и др., 1999; А. Ройт и соавт., 2000). Как известно, лектинами называют белки, способные специфически соединяться с определенными группами углеводов. Запуск лектиново-го пути активации комплемента связан с одним из лектинов — маннозосвязывающим белком (МСБ, содержится в сыворотке крови в концентрации 0,1 — 5,0мкг/мл). МСБ имеет очень сходную с Clq структуру хотя негомологичен ему; является Са - зависимым, обладает сродством к маннозе, которая в свободной форме присутствует на микробных клетках, но не на клетках макроорганизма. Связавшись с маннозосодержащей клеткой, МСБ приобретает способность, подобно Clqrs, активировать С4 и С2.
Дальше лектиновый и классический пути активации совпадают (А. А. Яри лин, 1999). Возможно, что лектиновый путь активации комплемента в филогенезе появился позднее альтернативного, но раньше классического. В отличие от альтернативного лектиновый путь, как и классический, включает активацию С4 и С2, но без участия антител, а с участием лишь одного МСБ. Не исключено, что появление в процессе эволюции Clq, подобного маннозосвязывающему белку, но способного приобретать активность пептидгидролазы, инициирующей каскад реакций активации комплемента лишь после взаимодействия с антигенами, привело к возникновению более эффективного классического пути активации комплемента, что значительно расширило возможности для активации комплемента у позвоночных.
Классический путь активации комплемента может также запускаться С -реактивным белком, комплексом гепарина и протамина, некоторым гликолипидами, пептидгидролазами при некоторых формах острой воспалительной реакции (пепсином, трипсином, калликреином, лизосомальными и бактериальными ферментами) на какой-либо стадии от С1 до С5.
Список литературы:
-
Воронин Е.С., Петров А.М., Серых М.М., Девришов Д.А. – Иммунология /Под ред. Е.С. Воронина. – М.: Колос-Пресс, 2002. – 408с.
-
Кульберг А.Я. /Учебное пособие – Молекулярная иммунология – М.: Высш. Шк., 1985. – 287с.
-
http://ru.wikipedia.org/
