
- •Лабораторно-практическое занятие №2
- •§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
- •§2 Характеристики и свойства ковалентной связи.
- •§3 Ионная связь, ее возникновение. Особенности ионной связи.
- •§4 Водородная связь; виды водородной связи.
- •§5. Индуктивный эффект.
- •§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
- •§7 Мезомерный эффект.
- •§8 Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №3
- •§1 Основные положения теории Бренстеда-Лоури и Льюиса.
- •§2. Сила кислот и оснований Бренстеда. Шкала кислотности рКа и рКв.
- •§3. Факторы, определяющие кислотность.
- •§4. Теория Льюиса.
- •§5. Экспериментальная часть
- •§6 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №4
- •§1. Алканы. Номенклатура, изомерия. Способы получения.
- •§2.Физические свойства:
- •§3. Химические свойства
- •Сульфохлорирование и сульфоокисление.
- •Дегидрирование.
- •Изомеризация.
- •§4. Циклоалканы
- •§5. Химические свойства.
- •§6. Алкены. Номенклатура, изомерия. Способы получения.
- •§7. Химические свойства
- •Гидрогалогенирование.
- •3.Гидратация
- •Присоединение серной кислоты.
- •Окисление кислородом воздуха без катализатора.
- •Окисление кислородом воздуха в присутствии серебряного катализатора.
- •Гидроксилирование.
- •Жесткое окисление.
- •V. Полимеризация.
- •§8. Экспериментальная часть
- •§9 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №5
- •§1. Алкины. Номенклатура, изомерия.
- •§2. Электронное строение
- •§3. Получение алкинов
- •§4. Физические свойства
- •§5. Химические свойства ацетиленовых углеводородов
- •§6. Алкадиены; классификация, изомерия, номенклатура. Получение диенов.
- •§7. Особенности химического строения алкадиенов с сопряженными связями
- •§8. Химические свойства
- •§9. Экспериментальная часть
- •§10. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №6
- •§1. Ароматические углеводороды. Общая характеристика,
- •§2. Физические свойства аренов. Способы получения.
- •§3. Электронное строение на примере бензола. Ароматичность;
- •§4. Химические свойства
- •§5. Понятие о многоядерных аренах. Конденсированные арены
- •§6. Химические свойства
- •§7. Экспериментальная часть
- •§8. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №7 Итоговое занятие № 1
- •Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
- •Лабораторно-практическое занятие №13
- •§1. Классификация, номенклатура, изомерия карбоновых кислот.
- •Изомерия карбоновых кислот
- •§2. Способы получения
- •§3. Физические свойства
- •§4. Химические свойства
- •§5. Применение:
- •§6. Дикарбоновые кислоты
- •§7. Способы получения
- •§8. Физические свойства
- •§9. Химические свойства
- •§10. Применение:
- •§11. Экспериментальная часть
- •§12. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №13 Тема: «Гетерофункциональные органические соединения»
- •§1. Гидроксикислоты; номенклатура, изомерия, классификация.
- •§2. Оптическая (зеркальная) изомерия молочной и винной кислот.
- •§3. Методы получения оксикислот.
- •§4. Химические свойства
- •§5. Специфические свойства гидроксикислоты
- •§6. Фенолокислоты
- •§7. Альдегидо- и кетокислоты, способы их получения
- •Кетокислоты
- •§8 Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №14 Тема: «Аминокислоты, пептиды, белки»
- •§1. Аминокислоты; строение, изомерия. Классификация.
- •§2. Способы получения аминокислот.
- •§3. Особенности строения природных аминокислот.
- •§4. Химические свойства аминокислот
- •§5. Специфические реакции аминокислот
- •§6 Образование пептидов; строение пептидной группы. Понятие о первичной структуре белка.
- •Уровня пространственной организации белковых молекул.
- •§7. Аминобензойные кислоты
- •§8. Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №15 Итоговое занятие № 3
§4. Теория Льюиса.
Г.Льюис расширил понятие «кислота» и «основание». Согласно его теории
кислоты – это соединения или катионы, являющиеся акцепторами электронной пары;
основания – это соединения или анионы, являющиеся донорами электронной пары или соединения с двойными связями:


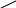 F
Cl R
F
Cl R


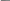

 F
B Cl Al R C+
H+
F
B Cl Al R C+
H+
F Cl R
кислоты Льюиса


 R
R


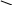
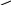 R
Nˉ
C
= C
R
Nˉ
C
= C
R
основания Льюиса
В электронейтральных соединениях, таких, как трифторид бора, хлорид алюминия, хлорид цинка и т.д., «недостаток» электронов проявляется в том, что эти соединения вместо устойчивой октетной оболочки имеют лишь секстет электронов. Они стремятся принять еще пару электронов (т.е. присоединить основание), чтобы создать таким образом октет электронов.
По Льюису, кислотный характер, вопреки теории Бренстеда, не связан с высвобождением протона, так что кислотность Н – ОН, Н – Сl и подобных соединений не отвечает определению Льюиса: только отщепившийся протон представляет собой, по Льюису, кислоту.

основание Льюиса кислота π-комплекс
Льюиса
§5. Экспериментальная часть
Кислотно-основные свойства органических соединений.
Опыт 1. Получение этилата натрия и его гидролиз.
В сухую пробирку поместите 1мл абсолютного этанола и внесите размером с рисовое зерно кусочек металлического натрия, предварительно очищенного от керосина с помощью фильтровальной бумаги. Соберите выделяющийся водород, прикрыв пробирку пробкой. Затем уберите пробку и поднесите пробирку отверстием к пламени горелки. Смесь водорода с воздухом сгорает с характерным «лающим» звуком. Белый осадок этилата натрия растворите в 2 – 4 каплях этанола и добавьте 1 каплю спиртового раствора фенолфталеина. После этого внесите в пробирку 2 – 3 капли воды. Объясните появление малиновой окраски.
Напишите уравнения реакции получения этилата натрия и уравнение его гидролиза.
Опыт 2. Обнаружение кислотных свойств многоатомных спиртов. Получение
глицерата меди (ΙΙ).
В пробирку внесите 2 капли 2%-ного раствора сульфата меди (ΙΙ) CuSO4 и добавьте 2 капли 10%-ного раствора гидроксида натрия NaOH. Образуется голубой хлопьевидный осадок гидроксида меди (ΙΙ) Cu(ОН)2. Добавьте к нему
1 каплю глицерина и встряхните пробирку. В результате образуется глицерат меди, раствор которого имеет синий цвет.
Напишите уравнения реакции глицерина с гидроксидом меди (ΙΙ) с образованием хелатного комплекса глицерата меди.
Опыт 3. Обнаружение кислотных свойств фенолов. Образование феноксида
натрия и разложение его кислотой.
В пробирку поместите 3 капли «жидкого» фенола, 3 капли воды и встряхните. К возникшей мутной эмульсии добавьте по каплям 10 %-ный раствор гидроксида натрия до образования прозрачного раствора. При подкислении этого раствора несколькими каплями 10%-ной НСl наблюдается помутнение. Напишите уравнения протекающих реакций.
Опыт 4. Обнаружение основных свойств алифатических и ароматических
аминов.
В две пробирки внесите по 2 капли воды.
а) В первую пробирку поместите 1 каплю анилина С6Н5NH2, а во вторую пробирку – 1 каплю диэтиламина (С2Н5)2NH и встряхните. Сравните растворимость этих аминов в воде. С помощью универсальной индикаторной бумаги определите приблизительное значение рН растворов в обеих пробирках.
б) К эмульсии анилина в первой пробирке добавьте 1 каплю 10%-ной НСl. Содержимое пробирки становится прозрачным. Во вторую пробирку к раствору диэтиламина прибавьте 3 капли насыщенного раствора пикриновой кислоты, перемешайте и поместите пробирку в стакан с холодной водой. Через некоторое время выпадает осадок пикрата диэтиламина. Напишите уравнения протекающих реакций.
